丹参酮Ⅰ在肾脏缺血再灌注损伤中的保护作用研究
高文强,邱雪峰,李凯,陈蔚,赵晓智,李笑弓,郭宏骞
(1.南京大学医学院附属鼓楼医院 泌尿外科,江苏 南京 210008; 2.东南大学 医学院,江苏 南京 210009)
肾脏缺血再灌注损伤(renal ischemia reperfusion injury,RIRI)是指缺血的肾脏恢复血流灌注后损伤反而加重和功能恶化的现象,常见于心血管手术、创伤、休克、烧伤和器官移植的患者[1-2],是临床上急性肾损伤(acute kidney injury,AKI)最常见的病因。目前RIRI的治疗以对症支持治疗为主,缺乏特异性治疗手段,探索治疗RIRI的新方法有重要的临床意义。
RIRI是一个复杂的多因素作用的病理生理过程,其具体发病机制目前仍不完全清楚,涉及自由基、钙超载和能量代谢功能障碍等多方面因素,且各因素间又相互转化、相互促进[3],但目前普遍认为氧化应激损伤在RIRI的病理生理过程中发挥着关键作用[4],因此,抗氧化应激损伤可作为RIRI治疗的一种有效手段。
丹参酮Ⅰ(Tanshinone Ⅰ,T-Ⅰ)为中药丹参根部的主要有效成分。研究表明,T-Ⅰ能够发挥舒张血管、清除氧自由基、稳定血管内皮功能等药理作用,对脑卒中、心肌缺血、闭塞性动脉炎及动脉粥样硬化等心脑血管疾病具有良好的治疗效果[5-6],但其在RIRI中的保护作用仍然未知,近期多项研究表明T-Ⅰ 通过激活氧化还原反应相关的防御性通路来发挥抗氧化性[7-9],提示T-Ⅰ 可能 通过抗氧化作用对RIRI起到保护作用。本研究通过体内、体外两方面探讨T-Ⅰ 在RIRI中的保护作用,希望为RIRI这一临床难题探索新的治疗手段。
1 材料与方法
1.1 实验动物及主要材料
普通雄性ICR小鼠(南京医科大学动物实验中心);T-Ⅰ、玉米油(C18H12O3,Aladdin公司,中国上海);超氧化物歧化酶(SOD)试剂盒、脂质过氧化产物丙二醇(MDA)试剂盒(南京建成生物工程研究所);人肾小管上皮细胞HK-2接种于含10%胎牛血清(美国HyClone公司)的高糖DMEM(美国Gibico公司)培养基中,培养条件为5%CO2、37 ℃,待细胞汇合度达到80%~90%时,用0.25%胰酶进行消化,以1∶3比例进行传代培养。试剂及仪器:酶标仪(美国Biord公司),CCK-8试剂盒(Vazyme Biotech),Annexin V-FITC/PI凋亡试剂盒(诺唯赞生物科技有限公司,中国南京),活性氧检测试剂盒DCFHDA(贝博生物,中国上海),Tunel细胞凋亡检测试剂盒(美国Roche公司)。
1.2 实验设计
1.2.1 体内实验 将普通雄性ICR小鼠(30~35 g)随机分成假手术(sham)组、sham+T-Ⅰ组、缺血再灌注(IR)组、IR+T-Ⅰ组4组,sham+T-Ⅰ 组及IR+T-Ⅰ 组予腹腔注射T-Ⅰ,剂量为10 mg·kg-1·(48 h)-1[8],sham组及IR组注射等量玉米油,2周后建立手术模型,小鼠用1%戊巴比妥钠(80 mg·kg-1)腹腔内给药麻醉,腹部正中切口,暴露左侧肾蒂,血管夹阻断左肾血供50 min,切除右肾,逐层关闭切口。sham组及sham+T-Ⅰ组只切除右侧肾脏,不阻断左肾血流,术后48 h留取左肾组织及血清标本。
1.2.2 体外实验 将HK-2按5×104ml-1接种于96孔板或6孔板,37 ℃、5%CO2培养6 h贴壁后,随机分为对照(C)组、T-Ⅰ组、H2O2组、H2O2+T-Ⅰ组4组,T-Ⅰ 组及H2O2+T-Ⅰ组用含T-Ⅰ培养基培养,C组及H2O2组用正常培养基培养,24 h后用H2O2模拟氧化应激模型;H2O2组及H2O2+T-Ⅰ组用含过氧化氢无血清培养基培养,C组及T-Ⅰ组更换无血清正常培养基培养;2 h后检测比较各组细胞活力、细胞凋亡及细胞内活性氧指标。
1.3 小鼠肾功能评估
每组血液样本经离心所得血清存储于-80 ℃冰箱,用作血清尿素氮(BUN)、肌酐(Cr)水平检测,评估肾功能。
1.4 小鼠肾脏组织学分析
用10%福尔马林固定中间部分肾脏组织,脱水并用石蜡包埋。HE染色,随机5 μm厚度切片,对肾脏的损伤程度进行组织病理学评分。评分反映10个随机选择非重叠区域(200倍)的肾组织损伤(包括肾小管坏死、管型形成、肾小管扩张、鲍氏囊扩张、刷状缘消失)所占比例,分级如下:0分,无肾组织损伤;1分,肾组织损伤≤10%;2分,肾组织损伤11%~25%;3分,肾组织损伤26%~45%;4分,肾组织损伤46%~75%;5分,肾组织损伤≥76%[10]。
1.5 小鼠肾脏组织凋亡检测
利用TUNEL细胞凋亡检测试剂盒,将切好的石蜡切片烘烤、脱蜡、再水化,根据说明书步骤检测肾脏细胞凋亡,通过计数10个随机视野内的凋亡细胞所占比例来反映各组小鼠肾脏凋亡情况。
1.6 小鼠肾脏氧化应激指标测定
通过测定肾脏SOD活性及MDA含量来反映小鼠肾脏氧化应激水平,按照SOD及MDA试剂盒相关步骤:小鼠肾脏匀浆后15 min、3 000 r·min-1离心,取上清液分别加入SOD、MDA检测试剂,每个测定重复3遍。
1.7 肾小管上皮细胞活力检测
采用CCK-8试剂盒,将上述处理的96孔板内细胞吸去培养液,用正常培养基洗涤2次,加入含10% CCK-8试剂的培养基100 μl,37 ℃、5%CO2培养2 h后,在450 nm波长测定各组吸光度(A)值,设置不加
细胞只加培养液的空白对照组,比色时作为空白调零孔,每组重复6孔。细胞活力=[A(加药)-A(空白)]/[A(对照)-A(空白)]×100%。
1.8 肾小管上皮细胞凋亡检测
将各组细胞用0.25%胰酶进行消化,PBS洗涤3次后,调整细胞浓度为5×105ml-1,加入预冷的结合缓冲液100 μl重悬细胞,加入5 μl Annexin V-FITC和5 μl PI染色液,轻轻混匀且室温、避光反应10 min;每组加入400 μl结合缓冲液,轻轻混匀后,将样品在1 h内使用流式细胞仪检测。
1.9 肾小管上皮细胞氧化应激指标测量
通过检测细胞内活性氧来反映HK-2氧化应激状态,采用ROS检测试剂盒:将1.2.2中处理的6孔板内细胞除去培养液并用正常培养基洗涤2遍,加入适当体积稀释好的DCFH-DA,37 ℃细胞培养箱内孵育20 min,在激发波长502 nm、发射波长530 nm附近,用荧光显微镜检测DCF荧光,从而测定细胞内ROS水平,然后利用Image J对每组的荧光水平进行定量分析。
1.10 统计学处理
使用SPSS 19.0统计软件对实验数据进行分析,数据以均数±标准差表示,采用Tukey’s检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 各组小鼠肾功能变化
术后48 h各组小鼠血清Cr、BUN水平如图1所示,sham+T-Ⅰ组与sham组相比血清Cr、BUN水平无明显差异(P>0.05),IR组血清Cr、BUN水平明显高于sham组、sham+T-Ⅰ组(P<0.05),IR+T-Ⅰ组血清Cr、BUN水平较IR组明显下降(P<0.05)。
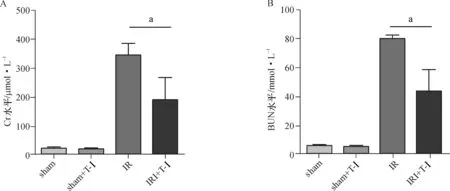
aP<0.05
图1各组小鼠肾脏血清Cr(A)及BUN(B)水平比较
2.2 T-Ⅰ改善RIRI后肾组织病理学改变
通过基于急性肾损伤微观结构的病理评分,包括肾小管坏死、刷状缘消失、管型形成、肾小管扩张等,来判断T-Ⅰ 对RIRI引起的肾损伤的影响。如图2所示,在肾脏皮质及髓质IR组评分均显著高于sham组及sham+T-Ⅰ 组,且与IR组相比,IR+T-Ⅰ 组评分明显较低。
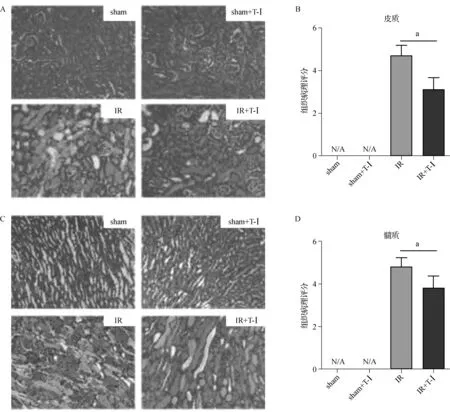
aP<0.05
图2T-Ⅰ改善RIRI后肾组织病理学改变
A.小鼠肾皮质病理学改变;B.小鼠肾皮质组织病理评分;C.小鼠肾髓质组织病理学改变;D.鼠肾髓质组织病理评分
2.3 各组小鼠肾组织细胞凋亡情况
通过TUNEL法检测小鼠肾脏组织中的凋亡细胞,结果如图3所示,褐色核染代表凋亡细胞,IR组以及IR+T-Ⅰ组均可见较多凋亡细胞,且IR+T-Ⅰ组凋亡细胞较IR组显著减少。
2.4 各组小鼠肾脏氧化应激状态
利用肾脏组织中SOD活力及MDA含量来评估肾脏氧化应激水平,如图4所示,与sham组及sham+T-Ⅰ 组相比,IR组SOD显著降低,而MDA水平明显升高,提示IR术后肾脏处于氧化应激状态,而IR+T-Ⅰ组SOD活力较IR组增高,MDA水平下降。
2.5 T-Ⅰ提高肾小管上皮细胞氧化应激损伤后细胞活力
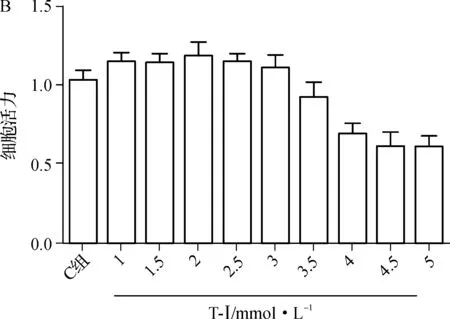
图5A为不同浓度H2O2处理人肾小管上皮细胞2 h后细胞活力变化,根据实验结果,后续实验使用H2O2终浓度为2 mmol·L-1;图5B为T-Ⅰ处理HK-2细胞24 h后细胞活力变化,提示较低浓度(终浓度≤3 μmol·L-1)处理24 h对HK-2没有细胞毒性,后续实验选用T-Ⅰ终浓度为3 μmol·L-1;图5C提示T-Ⅰ对H2O2处理后的HK-2细胞的保护作用,H2O2组与C组及T-Ⅰ组相比细胞活力显著降低(P<0.05),H2O2+T-Ⅰ组较H2O2组细胞活力明显升高(P<0.05)。

aP<0.05
图3各组小鼠肾脏组织细胞凋亡结果(A)及定量(B)
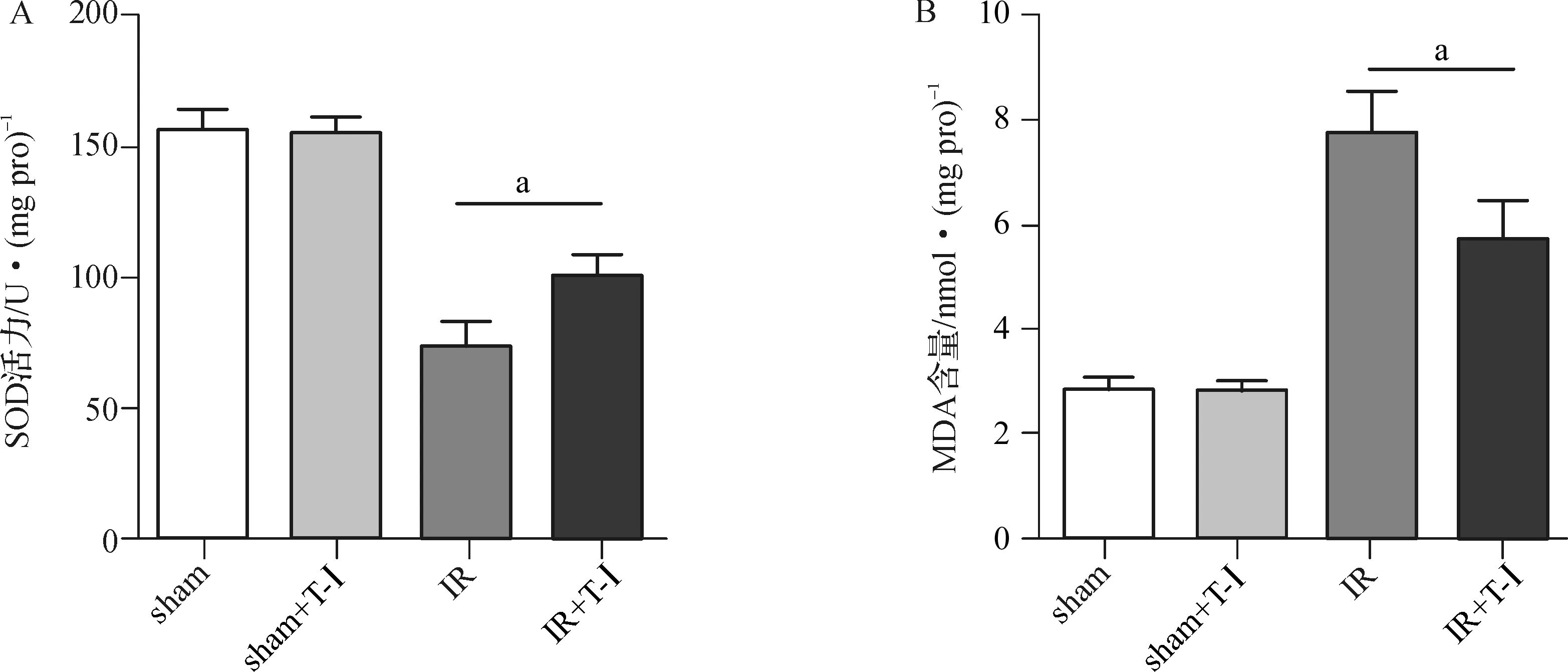
aP<0.05
图4各组小鼠肾脏SOD活力(A)及MDA含量(B)比较
2.6 各组肾小管上皮细胞凋亡情况
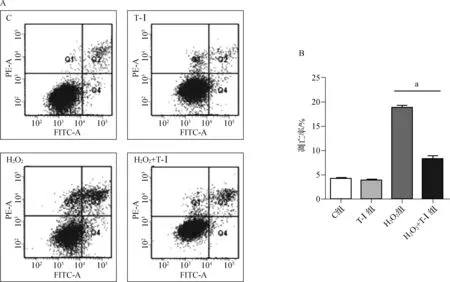
利用Annexin V-FITC/PI双染法检测各组细胞的凋亡情况,结果如图6所示,Q4、Q2分别代表早期及晚期凋亡(图6A),定量结果(图6B)显示H2O2组细胞凋亡比例较C组及T-Ⅰ组显著增加,而H2O2+T-Ⅰ组较H2O2组有所下降(P<0.05)。
2.7 各组肾小管上皮细胞内活性氧水平变化
利用细胞内活性氧水平来反映各组氧化应激状态,如图7所示,绿色荧光强度与细胞内活性氧水平呈正比,H2O2组细胞内绿色荧光水平显著高于C组及T-Ⅰ 组,而与H2O2组相比,H2O2+T-Ⅰ组细胞内绿色荧光强度明显下降,说明T-Ⅰ预处理可显著缓解H2O2诱导的HK-2内氧化应激状态。
3 讨 论
RIRI是临床常见的病理生理过程,在肾移植、心肺旁路及主动脉旁路手术、出血、创伤、脓毒血症及肾积水中均可出现[11],尤其在肾移植过程中不可避免地会出现IR损伤,导致AKI,影响移植后肾功能,甚至引
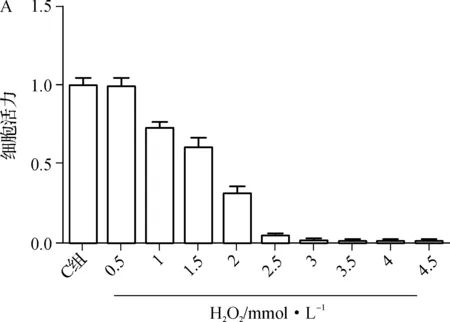

aP<0.05
图5T-Ⅰ减轻H2O2导致的细胞损伤
A.不同浓度H2O2处理2 h后HK-2活力变化;B.不同浓度T-Ⅰ处理24 h后HK-2细胞活力变化;C.T-Ⅰ预处理24 h显著增加H2O2处理后的细胞活力起移植后早期死亡率增高[12-13]。如上所述,RIRI的病理生理过程比较复杂,但目前普遍认为氧化应激在其中发挥着重大作用,是导致肾小管坏死、凋亡及加重局部炎症的主要原因[14]。在缺血过程中,组织缺氧会导致细胞内ATP消耗及次黄嘌呤堆积,血液复流后便产生大量的活性氧自由基(reactive oxygen species,ROS),导致肾小管上皮细胞凋亡及肾脏局部炎症反应[14-15]。因此,抗氧化损伤可作为治疗RIRI的一种重要手段。已有研究表明,抑制氧自由基形成及抗氧化损伤药物在RIRI中起到较好的保护作用[16-18]。
既往研究表明,T-Ⅰ具有强力的抗炎、抗氧化、抗癌作用,由于其分子质量较小且具有良好的脂溶性,可以穿透血脑屏障发挥良好的神经保护作用[9-19]。本实验通过体内及体外两部分研究证明T-Ⅰ在RIRI中的保护作用。体内实验IR术后48 h血Cr、BUN水平及病理组织学评分表明,T-Ⅰ预处理能够显著改善IR术后肾功能及肾脏组织结构变化,各组肾脏组织凋亡检测结果表明T-Ⅰ能够显著减少IR导致的细胞凋亡,保护肾脏组织;体外实验则是通过不同组别HK-2细胞活力以及凋亡比例变化说明T-Ⅰ预处理在H2O2模拟的氧化应激损伤中有保护作用。研究表明,T-Ⅰ具有清除氧自由基、抗氧化作用,本实验经测量氧化应激指标证明,T-Ⅰ通过抗氧化损伤在RIRI中发挥保护作用,体内实验中,IR组SOD活性降低及MDA含量升高说明IR术后肾脏处于强烈的氧化应激状态,而与之相比IR+T-Ⅰ组SOD水平升高、MDA含量下降说明T-Ⅰ有强力的抗氧化损伤作用;体外实验通过检测细胞内活性氧水平反映细胞氧化应激水平,通过比较各组绿色荧光水平可见T-Ⅰ预处理可显著降低H2O2诱导后细胞内活性氧水平,发挥其抗氧化性。有研究表明,T-Ⅰ可以激活体内Keap1-Nrf2-ARE抗氧化信号通路发挥其作用,激活Nrf2之后,可以促进其下游抗氧化基因的表达,发挥抗氧化活性[7-8,20],我们也将对其作进一步研究。
总之,本实验证明氧化应激损伤在RIRI中发挥重要作用,T-Ⅰ通过抗氧化损伤在RIRI中起保护作用,为RIRI的治疗提供了新的方法及理论依据,也促进了祖国中医药相关学科的前沿研究,或许将来T-Ⅰ或其衍生物会用于RIRI的治疗。
[参考文献]
[1] MOSLEMI F,TAHERI P,AZIMIPOOR M,et al.Effect of angiotensin Ⅱtype 1 receptor blockade on kidney ischemia/reperfusion; a gender-related difference[J].J Renal Inj Prev,2016,5(3):140-143.
[2] LUO L N,XIE Q,ZHANG X G,et al.Osthole decreases renal ischemia-reperfusion injury by suppressing JAK2/STAT3 signaling activation[J].Exp Ther Med,2016,12(4):2009-2014.
[3] XU Y M,DING G H,HUANG J,et al.Tanshinone ⅡA pretreatment attenuates ischemia/reperfusion-induced renal injury[J].Exp Ther Med,2016,12(4):2741-2746.
aP<0.05
图6各组间细胞凋亡情况
A.各组间流式细胞仪检测结果;B.定量分析结果

aP<0.05
图7T-Ⅰ缓解H2O2诱导的HK-2内氧化应激水平
A.各组细胞内ROS水平;B.其荧光强度定量
[4] CARDEN D L,GRANGER D N.Pathophysiology of ischaemia-reperfusion injury[J].J Pathol,2000,190(3):255.
[5] ZHOU L,ZUO Z,CHOW M S.Danshen:an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use[J].J Clin Pharmacol,2005,45(12):1345-1359.
[6] TIAN X H,WU J H.Tanshinone derivatives:a patent review (January 2006-September 2012)[J].Expert Opin Ther Pat,2013,23(1):19.
[7] de OLIVEIRA M R,SCHUCK P F,BOSCO S M D.Tanshinone Ⅰ induces mitochondrial protection through an Nrf2-dependent mechanism in paraquat-treated human neuroblastoma SH-SY5Y cells[J].Mol Neurobiol,2017,54(6):4597-4608.
[8] TAO S,ZHENG Y,LAU A,et al.Tanshinone Ⅰ activates the Nrf2-dependent antioxidant response and protects against As(Ⅲ)-induced lung inflammationinvitroandinvivo[J].Antioxid Redox Signal,2013,19(14):1647-1661.
[9] JING X,WEI X,REN M,et al.Neuroprotective effects of Tanshinone Ⅰ against 6-OHDA-induced oxidative stress in cellular and mouse model of Parkinson’s disease through upregulating Nrf2[J].Neurochem Res,2016,41(4):779-786.
[10]CHEN Y T,YANG C C,ZHEN Y Y,et al.Cyclosporine-assisted adipose-derived mesenchymal stem cell therapy to mitigate acute kidney ischemia-reperfusion injury[J].Stem Cell Res Ther,2013,4(3):62.
[11]DONNAHOO K K,MELDRUM D R,SHENKAR R,et al.Early renal ischemia,with or without reperfusion,activates NFkappaB and increases TNF-alpha bioactivity in the kidney[J].J Urol,2000,163(4):1328-1332.
[12]STALLONE G,INFANTE B,GESUALDO L.Older donors and older recipients in kidney transplantation[J].J Nephrol,2010,23(Suppl 15):S98-103.
[13]KOSIERADZKI M,ROWINSKI W.Ischemia/reperfusion injury in kidney transplantation:mechanisms and prevention[J].Transplant Proc,2008,40(10):3279-3288.
[14]PERICO N,CATTANEO D,SAYEGH M H,et al.Delayed graft function in kidney transplantation[J].Lancet,2004,364(9447):1814-1827.
[15]DEVARAJAN P.Update on mechanisms of ischemic acute kidney injury[J].J Am Soc Nephrol,2006,17(6):1503-1520.
[16]QIU X F,FU K,ZHAO X Z,et al.Protective effects of astaxanthin against ischemia/reperfusion induced renal injury in mice[J].J Transl Med,2015,13:28.
[17]GUNAL O,AKTAN A O,YEGEN C,et al.Captopril prevents the oxidative damage to proteins after renal ischemia reperfusion injury:role of endothelin-1[J].Prostag Leukotr Ess,1997,56(1):23-27.
[18]ESREFOGLU M,TOK O E,AYDIN M S,et al.Effects of beta-glucan on protection of young and aged rats from renal ischemia and reperfusion injury[J].Bratisl Lek Listy,2016,117(9):530-538.
[19]LEE J C,PARK J H,PARK O K,et al.Neuroprotective effects of Tanshinone Ⅰ from Danshen extract in a mouse model of hypoxia-ischemia[J].Anat Cell Biol,2013,46(3):183.
[20]TAO S,JUSTINIANO R,ZHANG D D,et al.The Nrf2-inducers Tanshinone Ⅰ and dihydrotanshinone protect human skin cells and reconstructed human skin against solar simulated UV[J].Redox Biol,2013,1:532-541.

