血清抗苗勒管激素水平检测用于评价宫颈癌患者移位卵巢功能的价值
葛莉莉,叶春萍,余宁珠
(南京医科大学附属妇产医院 妇产科,江苏 南京 210029)
目前,宫颈癌的发病呈现出年轻化趋势,50%以上的患者发病时尚未绝经[1]。因此,如何保留患者卵巢的部分内分泌功能、提高患者生活质量具有重要意义,保留卵巢成为一部分未绝经患者的要求。宫颈癌患者卵巢的低转移率为保留卵巢功能提供了可能性,卵巢悬吊术可以尽量避免术后放疗对卵巢的损害。但受检测手段的限制,截至目前,缺乏大样本保留后卵巢功能的评估研究。
抗苗勒管激素(anti-müllerian hormone,AMH)由早卵泡期的颗粒细胞分泌,其水平在评估卵巢功能方面具有稳定性和非周期依赖性[2]。本研究通过对早期行卵巢移位的宫颈癌患者血清AMH水平检测来分析年龄、手术方式及术后辅助治疗等因素对卵巢功能的影响。
1 对象与方法
1.1 研究对象
对我院2010年10月至2015年10月收治的69例宫颈癌患者进行回顾性分析,入选标准:(1) 病理类型为鳞癌或腺癌;(2) 临床分期为ⅠB1期及ⅡA1期;(3) 入组年龄鳞癌患者<45岁,腺癌患者<40岁;(4) 月经规律,术前经卵泡雌激素(FSH)水平测定及改良Kupperman评分评定卵巢功能正常;(5) 手术方式为经腹或经腹腔镜下广泛全子宫切除加腹膜后淋巴结清扫加卵巢(双侧/单侧)移位;(6) 无重大内外科合并症,既往无妇科手术史,无盆腔放疗及全身化疗史。纳入病例共69例,年龄26~45岁,平均(37.1±6.2)岁。其中26~30者12例,31~35岁者26例,36~40岁者18例,41~45岁者13例;开腹手术28例,腹腔镜手术41例;术中行双侧卵巢悬吊48例,单侧卵巢悬吊21例;术后补充放(化)疗26例,未补充放化疗43例。分期根据国际妇产科联盟(FIGO)2009年标准来进行,病理分类依据世界卫生组织(WHO)2003年子宫颈肿瘤分类法。所有病理切片均经两位以上高年资病理医师分析阅片。临床分期ⅠB1期者42例,ⅡA1期者27例;病理分级低分化者13例,中分化者34例,高分化者22例。
1.2 方法
1.2.1 卵巢移位术 所有患者及家属在充分了解卵巢去留的风险后签署知情同意书,保留单侧或双侧卵巢,通过医院伦理委员会批准。在肉眼和活检卵巢无异常后,采取单侧或双侧结肠旁沟卵巢侧面移位术。首先切断卵巢固有韧带,游离卵巢动静脉12~14 cm,缝合固定于结肠旁沟外侧腹壁,即腹主动脉分叉水平向上2 cm以上,观察卵巢色泽,观察卵巢血管是否出现成角或扭转,并以2~4枚钛夹固定作为标记。同时行标准的广泛全子宫切除加双侧盆(腹)腔淋巴结切除术。
1.2.2 补充治疗 术后根据有无高危(淋巴结转移、宫旁转移、切缘阳性)及中危因素(淋巴脉管浸润、病灶大小、浸润深度)给予辅助放化疗。化疗方案:紫杉醇175 mg·m-2静脉滴注3 h,第1天;顺铂70 mg·m-2静脉滴注,第1天。21 d为1个疗程。放疗包括全盆腔外照射和短距离阴道内照射,根据患者病情、经济条件选择;根据CT、MRI及手术情况确定靶区;盆腔照射部位:双侧坐骨结节水平位以上、第3腰椎下缘以下,宽度至骨盆最宽处外1.5~2.0 cm;放疗总量4 800~5 000 cGy,外照射每周5次,剂量每次100~200 cGy,共28~33次。移位卵巢根据不同外照射方法使用相应遮挡技术将卵巢区域进行遮挡,以避免伤害。
1.2.3 血清AMH水平检测 采集患者术前及术后1、6、12个月外周血5 ml,室温静置30 min后3 000 r·min-1离心10 min,吸取血清2 ml待测。AMH水平测定采用LAB全自动酶免仪依照相关说明进行。
1.2.4 血清FSH水平检测 分别于术前及术后1、6、12个月抽取外周血5 ml行FSH水平检测,采用DxI800全自动化学发光免疫分析仪依照相关说明进行。评价标准:卵巢功能正常:FSH水平<10 U·L-1,患者无绝经相关症状;卵巢功能下降:10 U·L-1≤FSH水平<40 U·L-1,患者出现绝经症状;卵巢功能丧失:FSH水平≥40 U·L-1[3]。
1.2.5 改良Kupperman评分 即以症状程度乘以症状指数对性激素缺乏症状进行评分。症状指数:潮热、多汗为4分;易激动、感觉异常、性交痛、泌尿系统症状、失眠症状为2分;抑郁、疲乏、心悸、皮肤走蚁感、眩晕、骨关节肌肉痛为1分;症状程度:无症状为0,偶有症状为1,症状持续出现为2,症状影响生活为4。总分为0~63分,症状积分≤13分为轻度,症状积分14~26分为中度,症状积分≥27分为重度[1]。
1.3 统计学处理
统计软件采用SPSS 20.0,正态检验计量资料组间
比较采用采用t检验,采用非参数秩和检验和Mann-WhitneyU检验进行等级资料组间比较;采用χ2检验比较计数资料;P<0.05认为差异具有统计学意义。
2 结 果
2.1 不同年龄组术后1年的卵巢功能评估
年龄26~30岁者12例,31~35岁者26例,此两组术后1年改良Kupperman评分无差异,FSH水平测定未出现卵巢功能下降或丧失,未出现AMH测不出(P<0.01)。36~40岁患者18例,术后1年时3例患者AMH测不出(P<0.01),其中1例FSH水平为22 U·L-1,改良Kupperman评分16分,其余2例FSH及改良Kupperman评分均评定卵巢功能正常;41~45岁患者13例,术后1年时5例患者AMH测不出(P<0.01),其中1例FSH水平≥40 U·L-1,改良Kupperman评分29分,评定卵巢功能丧失,2例患者FSH水平≥40 U·L-1,但改良Kupperman评分分别为15分和24分。其余两例FSH及改良Kupperman评分均评定卵巢功能正常。其他患者术后1年时FSH及改良Kupperman评分未提示卵巢功能受损。
2.2 手术前后不同年龄组患者血清AMH水平的变化
术前及术后共4次检测患者血清中AMH水平,随着年龄的增长均呈现逐步下降的趋势,其中术前、术后6个月、术后12个月下降趋势差异有统计学意义(P<0.05)。术后1个月4组患者AMH水平均显著降低(P<0.05);术后6个月4组患者AMH水平较术后1个月上升,与术前比较,26~30岁组患者AMH水平有降低,但差异无统计学意义(P>0.05),其余3个年龄组AMH水平显著降低(P<0.05);术后12个月,4组患者AMH水平继续回升,除26~30岁组患者较术前无明显下降(P>0.05外),其他3组较术前均显著降低(P<0.05)。见表1。
表1不同年龄组患者血清AMH水平手术前后的变化
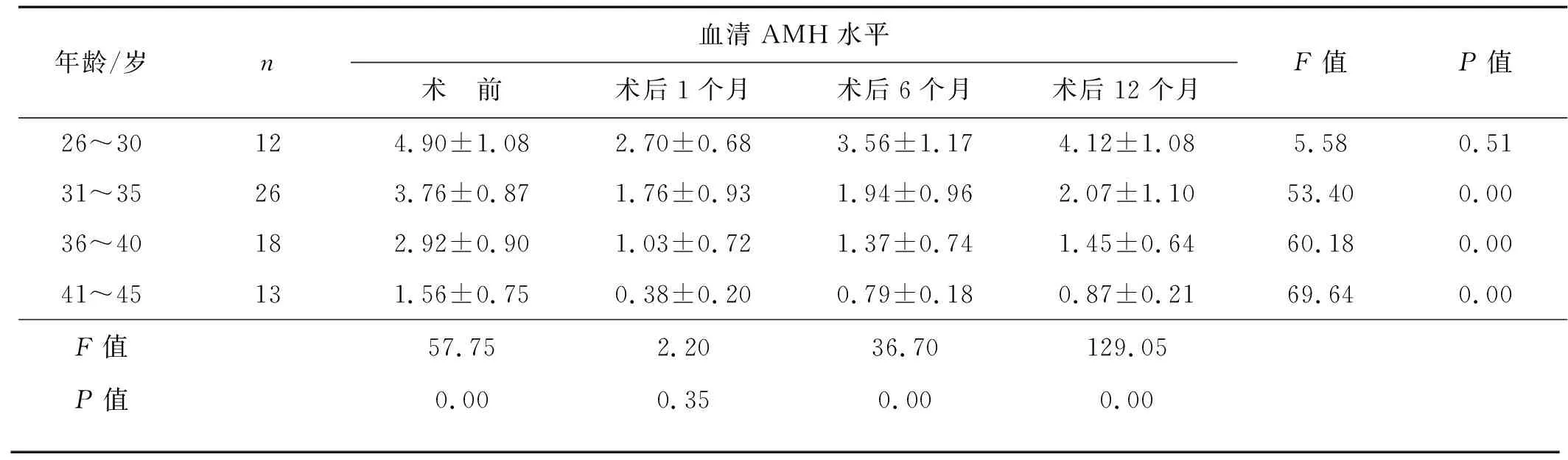
年龄/岁n血清AMH水平术 前术后1个月术后6个月术后12个月F值P值26~30124.90±1.082.70±0.683.56±1.174.12±1.085.580.5131~35263.76±0.871.76±0.931.94±0.962.07±1.1053.400.0036~40182.92±0.901.03±0.721.37±0.741.45±0.6460.180.0041~45131.56±0.750.38±0.200.79±0.180.87±0.2169.640.00F值57.752.2036.70129.05P值0.000.350.000.00
2.3 不同手术方式及术后治疗方案对患者血清AMH水平的影响
经腹与腹腔镜手术后患者血清AMH水平下降趋势差异无统计学意义(P>0.05);卵巢单侧及双侧移位者术后AMH水平下降趋势差异亦无统计学意义(P>0.05);卵巢楔形切除患者术后AMH水平下降较未行楔形切除者明显(P<0.05);行放化疗者术后AMH水平下降较未放化疗者明显(P<0.05)。见表2。
表2不同手术及辅助治疗方式患者术后血清AMH水平下降情况的比较
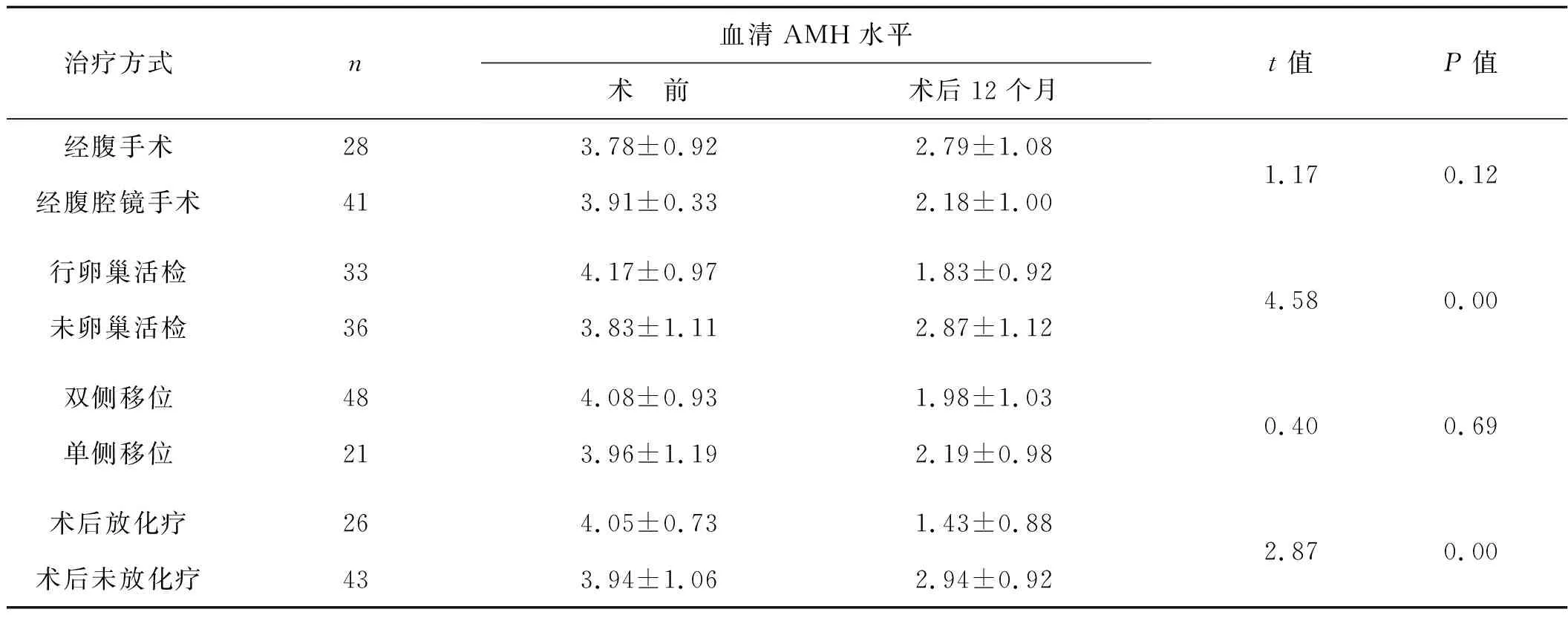
治疗方式n血清AMH水平术 前术后12个月t值P值经腹手术283.78±0.922.79±1.08经腹腔镜手术413.91±0.332.18±1.001.170.12行卵巢活检334.17±0.971.83±0.92未卵巢活检363.83±1.112.87±1.124.580.00双侧移位484.08±0.931.98±1.03单侧移位213.96±1.192.19±0.980.400.69术后放化疗264.05±0.731.43±0.88术后未放化疗433.94±1.062.94±0.922.870.00
3 讨 论
保留卵巢功能是目前早期宫颈癌患者和医师必须面对的问题,临床常用的方法是卵巢移位术。卵巢移位术后患者卵巢功能的监测,以往通常采用基础性激素及抑制素测定或B超下卵巢体积测量等,但是由于子宫切除后无月经来潮,无法选择合适的检测时机,故这些方法价值有限。血清AMH水平不受下丘脑—垂体—卵巢轴调节的影响,具有更好的特异性和敏感性[4],在卵巢的激素周期中有持续且稳定的血清水平,故可在子宫切除术后患者卵巢功能评价中发挥特殊的作用。
年龄是影响血清AMH水平高低的重要相关因素之一。血清AMH水平在不同时期表达不同,特点如下:出生时AMH水平较低,8岁前迅速升高,9~25岁AMH表达水平逐渐升高至稳定水平,至25岁后血清AMH值与被募集的原始卵泡的数量呈明显相关性,至绝经前5年检测不到。AMH这种特点恰好体现了不同年龄者的卵巢储备功能。本研究的结果显示:卵巢移位术后卵巢功能的保留率与年龄密切相关。实施同样手术的患者,年轻者的卵巢功能有更高的概率得以保存。故在早期宫颈癌患者的手术决策时,是否行卵巢移位术需重点考虑患者年龄、术前的卵巢功能状况。此次研究我们还发现,AMH可以在FSH水平发生变化及改良Kupperman评分提示卵巢功能下降之前提示卵巢功能下降。Baker[5]研究也认为,血清AMH水平能够早期准确地反映卵巢储备功能降低以及原发性卵巢功能不全和早衰,故可从侧面体现出AMH水平检测用于卵巢功能评价要优于其他传统的指标。
本研究通过分析不同手术及术后治疗方式对卵巢功能的影响发现:除了卵巢功能处于最佳状态的年轻患者之外,其他年龄患者术后均出现了卵巢功能的一过性及永久性下降,说明保留卵巢的手术并非能保存卵巢的全部功能。分析其原因可能系手术损伤了卵巢的血液供应,对术前卵巢功能较差的患者来说,手术进一步加速了卵巢的衰退,并有可能导致卵巢衰竭[6]。因此,子宫广泛切除术中子宫动脉卵巢支的离断可能是大部分患者术后AMH水平下降并不能恢复的原因之一。卵巢移位是否会因为影响卵巢的血供并进而影响卵巢的内分泌功能?既往的研究表明,卵巢移位手术本身也会影响卵巢功能[7],而本研究对比单侧卵巢移位及双侧卵巢移位术,两者术后血清AMH水平下降的差异并无统计学意义(P<0.05)。可能与随访观察时间较短有关,即双侧卵巢更好的耐受性可能还需要足够长的时间来表现出来;也可能因为本研究中患者实施卵巢移位术时移位方式对移位卵巢的血供影响较小。既往研究发现,腹腔镜下手术对血清AMH水平也有影响,其原因可能与腹腔镜手术中电凝等能量器械对卵巢组织的热损伤造成术后卵巢储备功能明显下降有关[8-9]。本研究并未发现经腹或腹腔镜下手术两种手术方式造成血清AMH水平下降存在差异,分析其原因可能因为,随着腹腔镜手术器械的改进如超声刀等低损伤能量器械的使用及腹腔镜手术技巧的进步,使得保留的卵巢组织及附属血管更完整,亦有可能因研究例数所限存在结果偏倚可能。总之腹腔镜手术中需要注意能量器械的使用,尽可能保护患者卵巢功能。本研究还观察到卵巢活检组术后AMH下降趋势较未活检组明显,其原因可能因为卵巢活检会损伤卵巢的血管及神经,出血、粘连、瘢痕纤维化等均会损伤患者卵巢功能[10]。对外观正常的卵巢进行活检是盲检,阳性率非常低,所以经术前评估及术中肉眼所见卵巢未见明显异常者,我们建议无需活检,直接保留卵巢。放化疗均能对卵巢生殖细胞造成损伤,且放疗的损伤大多不可逆。Pan等[11]研究发现,接受放化疗的卵巢移位患者仅72%卵巢功能恢复至接近正常,而未放化疗者则高达96%,同时放疗的剂量与卵巢早衰的发生密切相关。本研究观察到术后辅助放化疗患者血清AMH水平下降趋势较未放化疗者明显,表明移位后的卵巢功能仍会受放化疗的影响。所以,在放疗时要充分考虑移位卵巢部位可能受到的辐射剂量,尽量将卵巢移位至远离放射野处,以减少放疗对卵巢的损伤[12]。
综上所述,年龄、手术方式及术后辅助放化疗均是影响早期宫颈癌患者卵巢移位术后卵巢功能的因素,而血清AMH水平检测具有良好的敏感性,能较好地预测患者卵巢功能情况,是术前患者筛选、术后监测、指导临床决策的可靠指标。
[参考文献]
[1] 丁迪楠,王敏,陶陶,等.宫颈鳞癌卵巢悬吊术后辅助放化疗对卵巢功能影响研究[J].中国实用妇科与产科杂志,2015,18(5):455-459.
[2] 杨业洲.卵巢低反应及其获卵策略[J].实用妇产科杂志,2013,29(6):403-406.
[3] 张冰雅,王铁君,刘忠山,等.放射治疗对宫颈癌卵巢移位术后卵巢功能及卵巢内分泌功能的影响[J].中国妇幼保健,2016,8(32):320-331.
[4] PEIGNE M,DECANTER C.Serum AMH level as a marker of acute and long-term effects of chemotherapy on the ovarian follicular content:a systematic review[J].Reprod Biol Endocrinol,2014,26(12):261-265.
[5] BAKER V L.Primary ovarian insufficiency in the adolescent[J].Curr Opin Obstet Gynecol,2013,25(5):375-381.
[6] LEE D Y,PARK H J,KIM B G,et al.Change in the ovarian environment after hysterectomy as assessed by ovarian arterial blood flow indices and serum anti-Mullerian hormone levels[J].Eur J Obstet Gynecol Reprod Biol,2010,151(1):82-85.
[7] 李琳,毛小刚,邢辉,等.改良式卵巢移位术在子宫颈癌根治术中的应用[J].中国医药导报,2014,17(1):43-46.
[8] 徐绿妍,朱长焜,谢幸,等.子宫手术不同术式对生育期妇女卵巢功能影响的研究[J].现代妇产科进展,2015,42(7):216-219.
[9] 刘开江,崔丽青,刘青,等.腹腔镜宫颈癌术中不同止血方式对卵巢女性激素水平的影响[J].中国微创外科杂志,2011,11(1):38-41.
[10]SAITO T,TAKEHARA M,LEE R,et al.Neoadjuvantchemotherapy with cisplatin,aclacinomycinA,and mitomycin C for cervical adenocarcinomaa preliminary study[J].Int J GynecolCancer,2014,14(3):483-490.
[11]PAN Z,CHEN S.Differential gene expression identified in Uigur women cervical squamous cell carcinoma by suppression subtractivehybridization[J].Neoplasma,2010,57(2):123-128.
[12]张敏慧.抗苗勒管激素与卵巢功能[J].现代妇产科进展,2010,19(4):305-307.

