复合酶法制备化妆品用薏米提取液工艺研究
林瑞敏
(福建省轻工业研究所,福建 福州 350005)
薏米属禾本科蜀黍族薏苡属,又名薏苡仁、苡仁、薏仁米,是我国卫生部公开的药食兼用食品[1-2]。薏米在我国大部分地区均有种植,主要产于福建、河北、陕西、湖南、江苏等地。薏米的营养价值和药用价值在禾本植物中独占鳌头,因此,被誉为“世界禾本植物之王”[3]。据《中国食疗大典》记载:薏米含蛋白质14%、脂肪5%、碳水化合物65%、钙0.07%、磷0.242%、铁0.001% 。薏米中已发现的活性成分主要有薏苡多糖、薏苡酯、薏苡素、木脂素类、酚类、多种不饱和脂肪酸、苯并嗪酮、氧氮杂萘酮、三萜类开环化合物及多种氨基酸等[4]。
生物活性多糖具有许多护肤性能,包括延缓衰老、血管美容、抗粉刺、修复皮肤组织、美白和保湿作用,多糖的生物学活性和理化性质为其在化妆品中的应用提供了依据,将各种多糖应用于化妆品中,能产生保湿、稳定、改善肤色、抗衰老和抗菌等功能,且高分子多糖无毒副作用,与常用化妆品成分配伍性好[5]。
薏米是重要的中药材和化妆品添加剂。在日本,薏米一致被视为珍贵的滋补、保健、沐浴和润肤佳品[6]。现代研究表明:薏苡仁多糖主要含薏米多糖A、B、C,中兴葡聚糖1~7,酸性多糖CA-1和CA-2等多种多糖组分[7];薏米提取物可延缓皮肤衰老,具有防皱、防裂等作用,对于医治面部粉刺、痤疮、改善皮肤粗糙均有一定效果;同时,薏米提取物对紫外线有较强的吸收能力,对皮肤有防晒作用。薏米提取物已广泛应用于粉刺霜、痤疮膏、雪花膏、香波、头发营养剂、防晒化妆水、消炎性乳液及治疗皮肤病的产品生产中。
目前,对薏米的研究多集中在食品工业用和药理作用方面,对开发应用于化妆品的薏米提取液的工艺研究报道较少,本实验以薏米为原料,采用复合酶酶解薏米,通过单因素及正交试验确定酶解薏米的最佳工艺及参数,为薏米的精深加工和提高经济附加值提供技术支撑。
1 材料与方法
1.1 材料与设备
1.1.1 材料
薏米:福建省仙游县金沙食品有限公司;
中温α-淀粉酶(7000 U/g)、糖化酶(100000 U/g):江苏博立生物制品有限公司;
碘液、浓硫酸、无水乙醇、标准葡萄糖、苯酚等均为分析纯,市售。1.1.2 仪器设备
F-W-200高速万能粉碎机(北京中兴伟业仪器有限公司);
欧洲之星100数显型搅拌器(江苏省科学器材有限公司);
FY-1C旋片式真空抽滤泵(温岭市飞越机电有限公司);
723PC型可见分光光度计(上海光谱仪器有限公司);HH-6数显恒温水浴锅(国华电器有限公司);PHS-3C型酸度计(上海仪电科学仪器股份有限公司);
糖度计(泉州光学仪器有限公司);
101-1型电热鼓风恒温干燥箱(上海双彪仪器设备有限公司);
FA2004电子天平(上海舜宇恒平科学仪器有限公司);玻璃仪器等。
1.2 方法
1.2.1 提取工艺流程
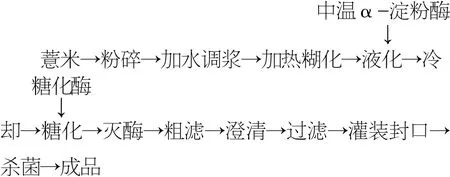
1.2.2 操作要点
1.2.2.1 粉碎:选用优质薏米,要求籽粒饱满、色泽光洁,无霉变、蛀虫,将薏米用粉碎机粉碎,过40目筛,制成薏米粉备用。
1.2.2.2 调浆:称取薏米粉,按料液比加入水浸泡,浸泡1~3 h,使薏米充分吸水后搅拌混合均匀。
1.2.2.3 糊化:将浸泡液加热至85 ℃,保温糊化30 min,糊化时为了防止底部粘度过高产生结块烧焦,应边糊化边进行搅拌。
1.2.2.4 液化:将薏米糊化液冷却至淀粉酶适宜温度(70±2)℃,加入中温α-淀粉酶25 U/g进行液化,通过碘液检测判定液化终点,确定液化时间。
1.2.2.5 糖化:酶解液降温至糖化酶适宜温度(58±2)℃,调节pH为糖化酶适宜的pH(5.0±0.2),加入糖化酶酶解,根据提取液中粗多糖含量判定糖化终点。1.2.2.6 灭酶:将糖化后的溶液加热至95 ℃,保温10 min灭酶。
1.2.2.7 筛滤:灭酶后,过100目筛,去除薏米渣,得提取液备用。
1.2.2.8 澄清:提取液加入澄清剂,搅拌均匀,静置澄清8~12 h。
1.2.2.9 过滤:吸取上清液,采用硅藻土过滤。
1.2.2.10 灌装、封口、杀菌:将澄清过滤液加热至90 ℃后趁热灌装封口,采用85 ℃、40 min进行杀菌,然后冷却至室温。
1.2.3 检测方法
1.2.3.1 液化终点的确定方法
取液化溶液1滴至瓷点滴板,加1滴碘溶液,观察反应颜色。若显蓝色,说明溶液中还有淀粉;若反应不显蓝色呈棕黄色,则说明溶液中不含淀粉,达液化终点。
1.2.3.2 粗多糖检测方法
采用苯酚-硫酸法[9]
(1)样品测定液制备:吸取薏米提取液试样15.0 mL,加入20 mL无水乙醇,同时使用涡旋振荡器,使混合均匀,于4000 r/min离心10 min,弃去上清液;不容物用10 mL乙醇溶液(80%)洗涤3次;残渣用水溶解并转至容量瓶中,加水定容至100 mL。此溶液为样品测定液。
(2)标准曲线绘制:分别吸取0、0.2、0.4、0.6、0.8、1.0 mL的标准葡萄糖工作溶液(100 mg/L)置20 mL具塞玻璃试管中,用蒸馏水补至1.0 mL向试液中加入1.0 mL苯酚溶液(5%),然后迅速加入5.0 mL硫酸,静置10 min;使用涡旋振荡器使反应液充分混合,然后将试管置于30 ℃水浴反应中反应20 min,490 nm处测吸光度。以葡萄糖质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。回归方程为Y=9.9286x+0.0126,标准曲线见图1。
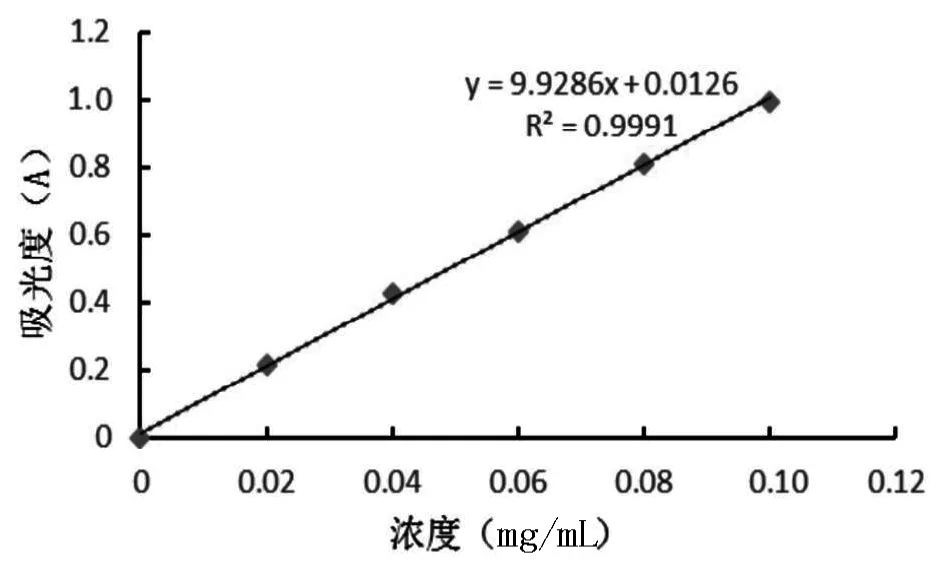
图1 葡萄糖标准回归曲线
(3)多糖含量测定:吸取1.0 mL样品测定液,置于20 mL具塞试管中,按(2)步骤操作,测定吸光度,同时做空白试验。若测得的吸光度超出所得的葡萄糖回归曲线的范围,则应相应的减少或增加吸取试剂量,保证读数在回归曲线范围内。做平行试验3次,取平均值,然后从标准曲线中求出被测液中葡萄糖的浓度,再换算成一定质量薏米多糖得率。多糖得率=(提取多糖的质量/薏米样品质量)×100%
1.2.4 实验方法
因各种酶制剂具有其最适作用pH、温度,液化酶的用量取决于底物中淀粉的含量,因此本研究中液化酶添加量、液化温度、液化pH及糖化温度、糖化pH根据原料说明书提供的适宜条件执行。影响薏米粗多糖得率的主要因素为:料液比、液化时间、糖化酶添加量和糖化时间。
1.2.4.1 不同料液比对多糖得率的影响
采用不同料液比进行调浆,85 ℃糊化30 min后冷却至(70±2)℃,按底物中淀粉含量计算加入中温α-淀粉酶进行液化,液化完全后,降温至(58±2)℃,调节pH(5.0±0.2),按100 U/g原料加入糖化酶,糖化60 min后过滤得提取液,测定提取液中粗多糖含量,以粗多糖得率为评价指标,确定最佳料液比。
1.2.4.2 液化时间的确定
采用最佳料液比进行调浆,85 ℃糊化30 min后冷却至(70±2)℃,按底物中淀粉含量分别加入中温α-淀粉酶进行液化试验,分别液化20、30、40、50、60 min,采用碘液检测判定是否通过液化终点,以确定最佳液化时间。
1.2.4.3 不同糖化酶添加量对多糖得率的影响
采用上述最佳料液比调浆,经糊化、完全液化后降温至(58±2)℃,调节pH(5.0±0.2),分别按50、75、100、125、150 U/g原料加入糖化酶进行试验,糖化60 min后过滤得提取液,测定提取液中粗多糖含量,以粗多糖得率为评价指标,确定最佳糖化酶添加量。
1.2.4.4 不同糖化时间对多糖得率的影响
采用上述最佳料液比调浆,经糊化、完全液化后降温至(58±2)℃,调节pH(5.0±0.2),按上述糖化酶最佳添加量进行糖化试验。糖化时间分别取30、45、60、75、90 min进行试验,糖化后灭酶、过滤得提取液,测定提取液中粗多糖含量,以粗多糖得率为评价指标,确定最佳糖化时间。
1.2.4.5 正交试验
在单因素实验的基础上,选择料水比、糖化酶添加量、糖化时间作为考察因素,以提取液中粗多糖得率作为考察指标,进行正交试验确定最佳糖化工艺条件。
1.2.4.6 验证实验
采用最佳的糖化工艺条件,以500 g薏米投料量进行3批次验证实验,通过对提取液中粗多糖得率的测定结果分析,验证最佳糖化工艺条件。
1.2.5 数据统计方法
实验所得数据采用SPSS和Excel软件统计分析。
2 结果与分析
2.1 不同料液比对粗多糖得率的影响
称取50 g薏米粉,分别采用1∶10、1∶15、1∶20、1∶25、1∶30料液比进行调浆,85 ℃糊化30 min后冷却至(70±2)℃,按25 U/g原料加入中温α-淀粉酶,液化完全后,降温至(58±2)℃,调节pH(5.0±0.2),按100 U/g原料加入糖化酶,糖化60 min后灭酶、过滤得薏米提取液,测定提取液中粗多糖含量,结果如图1示:
由图1可知,随着加水比的增加,提取液中粗多糖得率逐渐增加,当料液比为大于1∶20后,粗多糖得率增加不显著。因酶解液含水量过少,不足以溶解所有多糖,增加加水比后,多糖溶解量增大,当加水量到一定程度后,溶解的多糖量不再提高,从实际生产操作和成本考虑,加水量不宜过大,故确定最佳料液比为1∶20。

图1 料液比对粗多糖得率的影响
2.2 最佳液化时间的确定
称取50 g薏米粉,采用1∶20料液比进行调浆,85 ℃糊化30 min后冷却至(70±2)℃,加入中温α-淀粉酶25 U/g原料进行液化试验,分别于20、30、40、50、60 min采用碘液检测,以酶解液变色情况判定是否通过液化终点,结果如表1:
由表1可看出:随着液化时间的增加,酶解液遇碘变色逐渐变淡,当液化时间超过40 min时,酶解液遇碘呈淡棕黄色,表明已达液化终点。故确定最佳液化时间为40 min。
2.3 不同糖化酶添加量对粗多糖得率的影响
采用1∶20料液比调浆,85 ℃糊化30 min后冷却至(70±2)℃,加入中温α-淀粉酶25 U/g原料液化40 min后降温至(58±2)℃,调节pH(5.0±0.2),分别按50、75、100、125、150 U/g原料加入糖化酶进行试验,糖化60 min后灭酶、过滤得薏米提取液,测定提取液中粗多糖含量,结果如图2所示:
由图2可知,随着糖化酶添加量的增加,粗多糖得率逐渐增加,当糖化酶添加量超过100 U/g时,粗多糖得率增加不显著。在酶促反应中,当底物浓度为固定值时,随着酶添加量的增加,生成物越多;当底物全部被酶分解,酶用量继续增加,生成物不再变化。故确定最佳糖化酶添加量为100 U/g原料。

表1 酶解液变色情况表

图2 糖化酶添加量对粗多糖得率的影响
2.4 不同糖化时间对多糖得率的影响
称取50 g薏米粉,采用1∶20料液比调浆,85 ℃糊化30 min后冷却至(70±2)℃,加入中温α-淀粉酶25 U/g原料液化40 min后降温至(58±2)℃,调节pH(5.0±0.2),糖化酶添加量为100 U/g原料进行糖化试验。糖化时间分别取30、45、60、75、90 min进行提取试验,灭酶、过滤得薏米提取液,测定提取液中粗多糖含量,结果如图3所示:
由图3可知,随着糖化时间的增加,粗多糖得率逐渐增加,当糖化时间超过60 min时,粗多糖得率增加不显著。这说明产物溶解受时间的影响,时间过短粗多糖溶出量少,时间过长又容易引起粗多糖分解,故确定最佳糖化时间为60 min。
2.2 正交试验优化酶解工艺
在上述单因素实验的基础上,选择料水比、糖化酶添加量、糖化时间作为考察因素,以粗多糖得率作为考察指标,进行正交试验确定最佳酶解工艺条件。选用L9(33)正交表进行实验分析,结果见表2、表3。
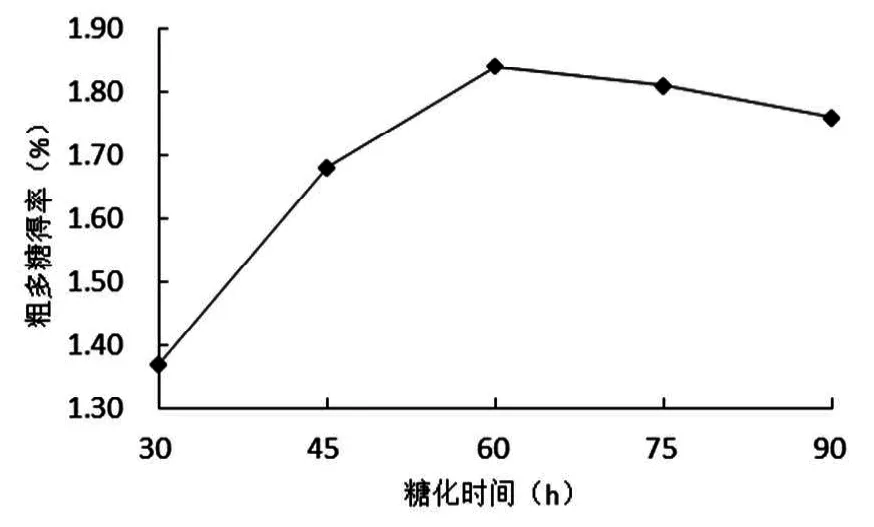
图3 糖化时间对多糖得率的影响
通过正交分析,由表3可看出:极差RB>RC>RA,说明糖化酶添加量对薏米提取液中粗多糖得率的影响最大,其次是糖化时间,料液比对薏米提取液中粗多糖得率的影响最小,即影响粗多糖得率的各因素主次顺序为B>C>A,且较优方案为A2B2C2。即:料液比1∶20、糖化酶添加量100 U/g原料、糖化时间60 min。

表2 正交试验因素水平表

表3 正交试验表
2.3 验证实验
采用正交试验优化的最佳工艺,以500 g投料量进行3批次验证实验,对中试成品粗多糖含量进行检测,3批次实验成品的粗多糖得率分别为1.92%、1.97%、1.95%,平均值为1.95%;结果表明:3批次的多糖得率与正交试验优化结果基本相符。
3 结论
采用以薏米为原料,糊化后经中温α-淀粉酶液化完全、采用糖化酶酶解提取制备化妆品用薏米提取液,其工艺合理可行。最佳工艺为:以薏米为原料,料液比为1∶20、85 ℃糊化30 min、淀粉酶用量25 U/g原料、液化温度(70±2)℃、液化时间40 min;糖化酶用量100 U/g原料、糖化pH(5.0±0.2)、糖化温度(58±2)℃、糖化时间60 min;糖化结束后加热至95 ℃灭酶10 min,经过滤、澄清,取上清液经硅藻土、膜过滤,加热至90 ℃灌装封口,后经85 ℃杀菌40 min、冷却至室温得薏米提取液成品。产品呈无色清亮透明,粗多糖得率达1.92%以上。
[1] 陈建白.薏米的开发利用[J].云南热作科技,1999(02):13-14.
[2] 赵晓红.薏米的营养、医学价值及制作饮料的发展前景[J].饮食与健康,2002(03):35-36.
[3] 汪开治.国外科技简讯[J].植物杂志,2004(01):48.
[4] 党娟.萌芽薏米营养生化特性及产品延伸研究[D].贵阳:贵州大学,2015.
[5] 王兆梅,李琳,郭祀远,等.生物活性多糖在化妆品中的应用[J].日用化学工业,2004(04):245-248.
[6] 王振鸿.薏苡的药用价值[J].医药保健,2004(03):56-57.
[7] 邢真.薏米中生物活性物质的提取及应用研究[D].济南:山东轻工业学院食品与生物工程学院,2009.
[8] 钱学射,秉文.薏苡仁在化妆品中的应用[J].中国化妆品,1995(04):28.
[9] 中华人民共和国农业部.食用菌中粗多糖含量的测定:NY/T 1676-2008[S].北京:中国农业出版社,2008:10.

