菌根真菌协同死谷芽孢杆菌抑制棉花黄萎病
张国漪,程 林,黄立莹,钱琪卉,关琳琳,叶文玲,鲁洪娟,冉 炜,章力干,*
(1.安徽农业大学 资源与环境学院,安徽省农田生态保育与污染防控重点实验室,安徽 合肥 230001;2.南京农业大学 资源与环境科学学院,江苏 南京 210095)
菌根真菌协同死谷芽孢杆菌抑制棉花黄萎病
张国漪1,程 林1,黄立莹1,钱琪卉1,关琳琳1,叶文玲1,鲁洪娟1,冉 炜2,章力干1,*
(1.安徽农业大学 资源与环境学院,安徽省农田生态保育与污染防控重点实验室,安徽 合肥 230001;2.南京农业大学 资源与环境科学学院,江苏 南京 210095)
摘 要:利用温室盆钵实验,双接种丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)地表球囊霉(Glomusversiforme)和死谷芽孢杆菌(Bacillusvallismortis,HJ-5),研究AMF协同HJ-5控制棉花黄萎病的效果,并通过液相色谱法、馏分平板对峙法探析协同抗病的原因。结果表明:与对照相比,AMF和HJ-5在控制棉花黄萎病方面具有协同增效的作用,发病率下降50.82%,地下部干重增加125.00%,根际HJ-5数量增加23.80%。液相色谱分析表明,HJ-5分泌伊枯草菌素(iturin A)和表面活性素(surfactin)2种抗病性脂肽类物质。双接种AMF、HJ-5,棉花根际伊枯草菌素和表面活性素含量分别比HJ-5单处理增加13.38%和11.27%。接种AMF促进了植株地下部生长和HJ-5在棉花根际的定殖,并分泌更多的抗病类物质,是AMF与HJ-5协同抗棉花枯萎病的重要机理。
关键词:植物病害;经济作物;伊枯草菌素;表面活性素
黄萎病在世界各棉产区普遍发生,被称作棉花的“癌症”,是制约棉花生产最主要的障碍。化学肥料和农药的使用虽然对棉花黄萎病的发生有一定的防控作用,但严重破坏生态环境,影响农产品安全,危害人类健康。生物防治不但能促进植物的生长,防治病害,并且绿色无污染,被认为是最具发展潜力的防治方法[1]。
丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)与土壤中80%的植物形成共生体,改变植物根系形态,增加根系吸收面积,提高根表面积[2-3]。研究表明,AMF中的地表球囊霉(Glomusversiforme)对棉花黄萎病的防治效果显著[4]。大量研究显示,AMF和拮抗菌共同施用与拮抗菌单独接种相比,能显著降低各类病害的发生:AMF与枯草芽孢杆菌(Bacillussubtilis)双接种能有效抑制番茄枯萎病的发生[5];AMF和凝结芽孢杆菌(Bacilluscoagulans)双接种能显著降低根结线虫的发病率,并显著提高植株的生物量[6];AMF与荧光假单胞菌(Pseudomonasfluorescens)双接种能有效抑制麦类立枯病[7]。
研究发现,芽孢杆菌产生的脂肽类物质,如伊枯草菌素(iturin A)和表面活性素(surfactin)等,对病原真菌具有显著的抑制效果,是拮抗菌抑制病害的主要原因之一[8-9]。伊枯草菌素对丝状真菌具有强烈的拮抗作用[10]。Ongena等[11]发现,表面活性素与伊枯草菌素等共同作用能够显著增强芽孢杆菌的抑菌活性。
近年来有关生物防治病害的报道越来越多,但关于死谷芽孢杆菌和AMF进行双接种,从脂肽类物质的角度研究协同抑病的报道较少。张慧等[12]从棉花根际分离了一株能有效抑制黄萎病的死谷芽孢杆菌(Bacillusvallismortis)菌株HJ-5。本实验通过根际接种地表球囊霉和HJ-5,研究二者协同对棉花黄萎病的作用及机理,为棉花黄萎病的生物防治提供一定的科学依据。
1 材料与方法
1.1 供试材料
棉花品种,新陆早八号。
土壤样本,采自江苏省盐城市,全氮1.30g·kg-1,速效磷12.35mg·kg-1,速效钾190.12mg·kg-1,有机质10.16g·kg-1。每隔2d高压灭菌一次供试土壤(115℃,30min),共灭菌3次,备用。
地表球囊霉(Glomusversiforme),由中国农业科学院提供。以玉米和三叶草为宿主,扩大繁殖3个月,得到含侵染根段、菌丝、根外菌丝的土沙混合物用于实验,其平均孢子数量为65个·g-1土。
病原菌(Verticilliumdahliae)来自中国普通微生物菌种保藏管理中心(CGMCC),编号3.3758。V.dahliae孢子悬液的制备。将V.dahliae接种于液体PDA培养基(马铃薯20g,蔗糖20g,蒸馏水1000mL,100 kPa灭菌30min),30℃、170r·min-1振荡培养7d,菌悬液经5层纱布过滤,得到5× 105mL-1孢子悬液。
死谷芽孢杆菌(B.vallismortis)HJ-5菌株,来自CGMCC,编号1.3488。
HJ-5菌悬液的制备。接种 HJ-5于牛肉膏液体培养基(牛肉膏3g,蛋白胨10g,NaCl 5g,蒸馏水1000mL,用稀酸或稀碱调pH至7.0~7.2,100 kPa灭菌30min),30℃、170r·min-1振荡培养48h,9000r·min-1离心15min,去离子水悬浮沉淀稀释至7.0× 109cfu·mL-1。
1.2 实验设计
采用温室盆栽实验,设4个处理:对照(CK),单接种菌根真菌(AMF),单接种死谷芽孢杆菌(HJ-5),双接种菌根真菌和死谷芽孢杆菌(AMF+HJ-5)。每处理重复5次,生长8周后收苗,实验重复3次,取平均值。
棉花种子用30%(体积分数)H2O2灭菌30min,去离子水冲洗干净,用吸水纸覆盖,放入28℃的光照培养箱中培养至露白,转至营养钵育苗。采用盆底内径6.0cm、高9.0cm的营养钵,每钵装灭菌土400g,距土表2.0cm的土层按5%(质量分数)的比例加入AMF 20 g。对照接种等量高温灭菌菌剂,并接种10mL无AMF菌种滤液,以保证处理和对照棉花根际具有相同的微生物区系。每个营养钵加入2粒棉花种子,培养2周后间苗至1棵,并将整个营养钵连土转至5 kg对应灭菌处理的棉花连作土壤中,接种1.0×105g-1土的V.dahliae菌悬液,混合均匀,再接种1.0×108mL·g-1HJ-5菌悬液至对应处理盆中。
1.3 样品采集和分析
1.3.1 植株生物量
棉花生长90d后测定棉花地下部干重(105℃杀青30min,75℃烘干至质量恒定)。
1.3.2 病情指数
发病级数分为5级[13]:0级,单株未发病;1级,单株病叶发病率<25%;2级,单株病叶发病率为25%~50%;3级,单株病叶发病率50%~75%;4级,单株病叶发病率75%~100%。
(1)
式(1)中:D为病情指数;ai、Ni分别表示发病级数和相应的发病株数;amax表示最高发病级数;N表示总株数。
1.3.3 AMF侵染
AMF侵染率的计算采用曲利苯蓝染色法[14]。将洗净的棉花根系放入10%(质量分数)KOH溶液中保温5~6h,用去离子水小心冲洗干净,将根样浸没于1%(质量分数)HCl 1~2min,再次用去离子水洗净,剪至1~2cm长片断,放在1%(质量分数)的曲利苯蓝中充分染色,用去离子水充分洗净,在显微镜下观察并记录每条根的浸染情况。
染色根系均匀平铺于底部划出0.5cm×0.5cm方格的培养皿中,在解剖镜下计算出与格子相交(水平、竖直)的总根数中被侵染(有泡囊或丛枝)的根数,侵染形态不明显的根系制备水片到100~400倍显微镜下观察,通过MYCOCALC软件计算侵染率[15]。
1.3.4 根际微生物数量
采用半选择性培养基(326mL V8果蔬汁,33 g氯化钠,0.8 g葡萄糖,蒸馏水490mL,pH值5.2)测定HJ-5的数量。每1000mL融化培养基倒皿前加抗菌素液67.5mg(含多黏菌素22.5mg和环己酰胺45mg),采用稀释平板计数法计数[16-17]。根际土壤中V.dahliae菌核数的测定采用选择性培养基[18]:土壤浸提液25mL,K2HPO44g,KH2PO41.5g,山梨糖1g,半乳糖醛酸钠1g,尿酸钠0.2g,Dox盐2mL,无氯硝基苯(PCNB)0.1g,壬基酚聚氯乙烯醚(tergitolNP-10)1 ml,琼脂17g,蒸馏水1000mL,pH6.4~6.7。每1000mL融化培养基倒皿前加抗菌素液50mL(含氯霉素0.05g、链霉素0.05g、青霉素-G盐0.05g)。采用稀释平板计数法计数根际土壤微生物数量。
1.3.5 脂肽类物质提取
HJ-5接种于改良的Landy培养液中(葡萄糖20.0g,L-谷氨酸5.0g,KH2PO41.0g,KCl 0.5g,MgSO40.5g,MnSO45.0mg,CuSO40.16mg,FeSO40.15mg,蒸馏水1000mL,pH7.0),30℃、170r·min-1振荡培养48h后,10000r·min-14℃离心15min。上清液加12mol·L-1的盐酸调pH至2.0,4℃静置7h,12000r·min-14℃离心10min,去上清,沉淀用甲醇溶解,过0.22μm的滤膜,置-70℃冰箱待用。
1.3.6 脂肽类物质纯化、收集
利用HPLC Agilent 1200 系列的反相液相色谱柱(ZORBAX,SB-C18,9.6mm×150mm,5μm,美国)。流动相A为0.05%(质量分数)甲酸,流动相B为100%乙腈,表面活性素的流动相A、B体积比为70∶30,伊枯草菌素的流动相A、B体积比为40∶60,柱温30℃,进样量10μL,流速1.0mL·min-1,检测波长254 nm,按“峰”收集馏分。收集到的馏分冷冻干燥,加2mL色谱甲醇溶解,过0.22μm的有机滤膜,置-70℃冰箱中保存待用。
1.3.7 脂肽类物质对V.dahliae的抑制作用
将V.dahliae接种至PDA平板中央,30℃培养5d。在距中心点约2cm的平板四角分别用打孔器打孔,并加HJ-5馏分10μL,28℃培养7d,测量菌落直径,计算各馏分的抑菌能力。
1.3.8 根际伊枯草菌素和表面活性素的含量
分别将表面活性素和伊枯草菌素标准物溶于色谱甲醇中,稀释成不同浓度梯度的溶液,经HPLC测定制作标准曲线。根据峰面积,分别计算得出伊枯草菌素在3.3、6.6、8.8、9.2min相应峰,和表面活性素在3.1min所出峰的标准曲线。根际样品中抗菌脂肽的测定采用Kinsella等[16]的方法。取5.0 g根(连同黏附在根表的土)样品放入50mL乙腈-0.1%(质量分数)甲酸体积比9∶1的萃取液中,超声萃取10min,过滤,滤液冷冻干燥,干燥所得物溶入甲醇,过0.22μm滤膜,-20℃冰箱保存,HPLC法测定。与标准曲线相比,计算得出含量。根际土壤伊枯草菌素含量为3.3、6.6、8.8、9.2min所出峰相对应的含量之和。
1.4 数据处理
在SPSS 11.5软件平台上对数据进行单因素方差分析(ANOVA),并运用最小显著极差法(LSD)进行显著性检验。
2 结果与分析
2.1 各处理对菌种和病情的影响
从表1可以看出,AMF在根际土壤中具有较高的侵染率,达到50%以上。虽然双接种HJ-5后,AMF侵染率略有下降,但差异不显著(P>0.05),表明HJ-5不会对AMF侵染造成显著影响。HJ-5接种土壤后大部分存活,具有很好的定殖能力,且接种AMF显著(P<0.05)提高了根际土壤HJ-5定殖数量,与单接种HJ-5处理相比,定殖率增加23.80%。
根际土壤V.dahliae数量和棉花病情指数均随HJ-5或AMF接种而显著(P<0.05)降低。与对照相比:单接种HJ-5处理V.dahliae数量、棉花病情指数分别下降56.29%、28.73%;双接种处理的V.dahliae数量、棉花病情指数分别下降83.71%、50.82%。表明AMF协同HJ-5能够更好地抑制棉花黄萎病发生。
2.2 各处理对棉花生物量的影响
从表2可以看出,与对照相比,单接种HJ-5棉花地下部干重增加33.33%,双接种处理棉花地下部干重提高125.00%,表明AMF协同HJ-5可显著促进棉花根部生长。
2.3 HJ-5产伊枯草菌素和表面活性素物质的能力
从图1可以看出,HJ-5分泌脂肽类物质伊枯草菌素和表面活性素。在本实验液相条件下,伊枯草菌素标准样品检测到4个峰,出峰时间分别为3.3、6.6、8.8、9.2min,HJ-5脂肽粗提物与伊枯草菌素标准样品比较,在3.3,6.6,8.8、9.2min均有峰出现;表面活性素标准样品在本实验液相条件检测到3个峰,出峰时间分别为3.1、3.5、4.1min,HJ-5脂肽粗提物与表面活性素标准样品相比较,仅在3.1min有峰出现。
2.4 伊枯草菌素和表面活性素馏分收集物对V.dahliae的抑制作用
表1各处理对菌根真菌侵染率、死谷芽孢杆菌数量、病原菌菌核数和病情指数的影响
Table1Effect of different treatments on AMF colonization rate,number of HJ-5 and sclerotia ofV.dahliaein rhizosphere soil,and cotton disease index

处理TreatmentAMF侵染率AMF colonization rate/%HJ-5数量Number of HJ-5/(106 cfu·g-1)V. dahliae菌核数量Number of V. dahliae sclerotia/(103 g-1)病情指数Disease index/%CK——45.00±2.00 a75.22±12.96 aAMF59.13±5.10 a—22.01±5.29 b60.97±1.67 bHJ-5—35.00±2.01 b19.67±0.57 b53.61±6.25 bAMF+HJ-553.91±5.86 a43.33±1.57 a7.33±2.08 c36.99±2.52 c
同列数据后无相同小写字母的表示差异显著(P<0.05)。
Data followed by no same letters within the same column indicated significant difference atP<0.05.

表2 各处理对棉花地下部生物量的影响
将图1中检测到的5个脂肽类物质出峰时间点分别按“峰”进行馏分收集,将得到的馏分样品与V.dahliae进行平板对峙实验(图2)。与对照相比,收集到的不同时间点脂肽类物质对V.dahliae的抑制率达30%以上(表3),尤其以9.2min收集的伊枯草菌素对V.dahliae抑制效果最强,抑制率达42.67%。
2.5 各处理对根际脂肽类物质含量的影响
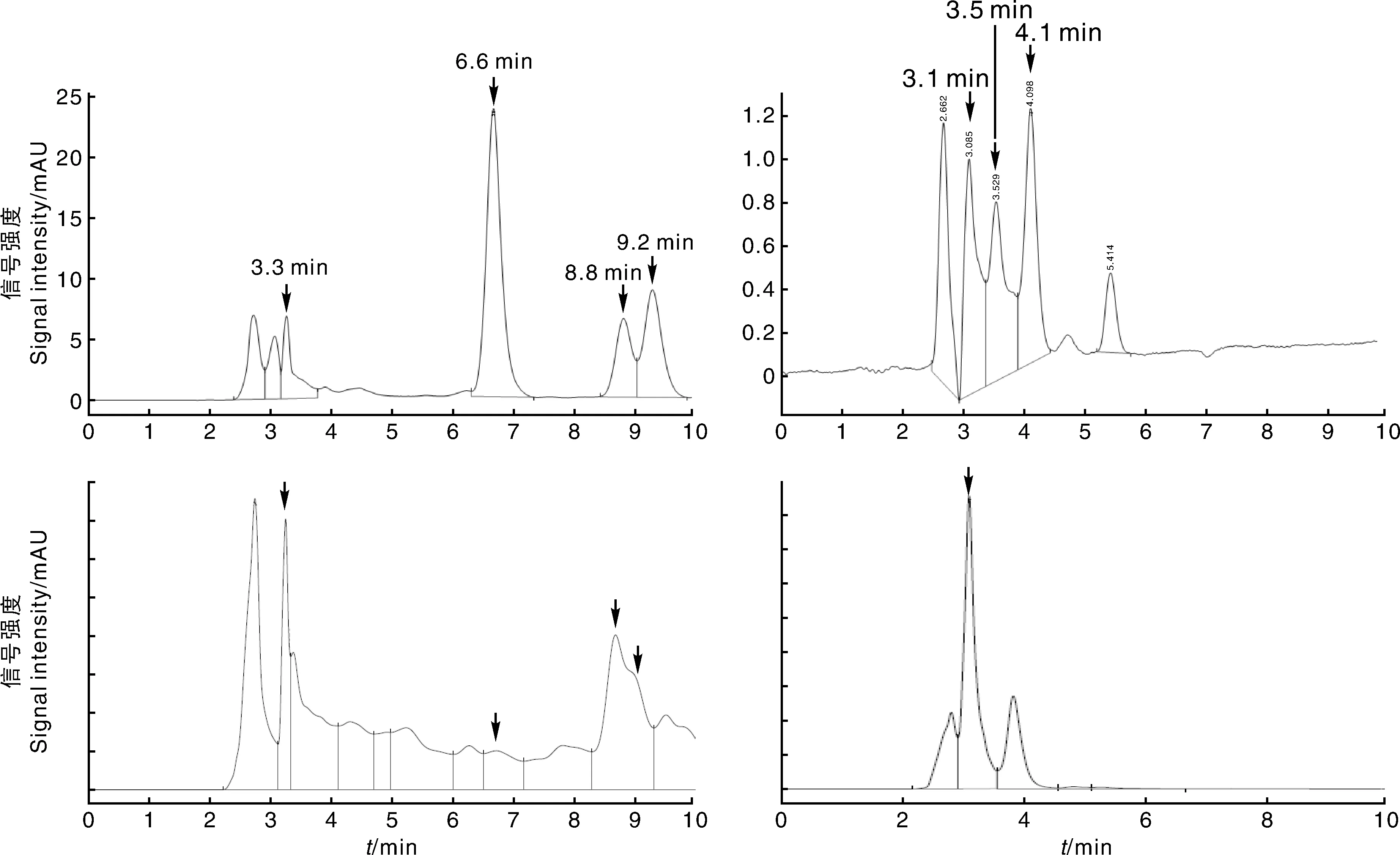
第一行为标准品,第二行为HJ-5产物。Images were standard substances in the first row,and were yield of HJ-5 in the second row.图1 伊枯草菌素(左)和表面活性素(右)的HPLC图谱Fig.1 Chromatogram of iturin A(left) and surfactin(right)

A,纯甲醇对照;B~E,3.3、6.6、8.8、9.2min出峰的伊枯草菌素物质;F,3.1min出峰的表面活性素物质。A,Pure methanol;B-E,Iturin A of 3.3,6.6,8.8,9.2min,respectively;F,Surfactin of 3.1min.图2 HJ-5产伊枯草菌素和表面活性素对棉花大丽轮枝菌的平板抑制效果Fig.2 Inhibition effect of metabolized iturin A and surfactin of HJ-5 against V.dahliae on plates

表3 HJ-5产伊枯草菌素和表面活性素对大丽轮枝菌生长的抑制效果

柱上无相同字母的表示处理间差异显著(P<0.05)。Bars markted without the same letters indicated significant difference at P<0.05.图3 各处理对根际土壤中伊枯草菌素和表面活性素含量的影响Fig.3 Effect of different treatments on concentration of iturin A and surfacing in cotton rhizosphere soil
从图3可以看出,土壤自身伊枯草菌素、表面活性素物质含量很低。接种HJ-5后,根际土壤伊枯草菌素、表面活性素含量显著(P<0.05)增加,且HJ-5和AMF双接种时,伊枯草菌素、表面活性素根际含量最高。HJ-5单接种处理的伊枯草菌素、表面活性素含量分别是对照的307.70倍和20.32倍,双接种处理的伊枯草菌素、表面活性素含量分别是对照的349.00倍和22.72倍。AMF、HJ-5双接种与HJ-5单接种处理相比,根际土壤中伊枯草菌素和表面活性素含量分别增加13.38%和11.27%,且伊枯草菌素含量差异显著(P<0.05)。表明AMF协同HJ-5在棉花根际产生了更多的脂肽类物质。
3 讨论
本研究将B.vallismortis和AMF双接种,首次从脂肽类物质的角度揭示协同抗病增效的原因。结果显示,HJ-5、AMF双接种与单接种相比,根际土壤V.dahliae菌核数量和棉花黄萎病发病指数显著降低,说明AMF能够协同HJ-5更好地抑制病害,这与前人研究结果一致[5-7]。
本研究发现,接种HJ-5对AMF的侵染没有显著影响,但接种AMF显著促进了HJ-5的定殖,且棉花地下部生物量显著增加。原因可能是AMF在根际形成密集的菌丝,提高了植株对营养物质的吸收[19-20],促进了棉花根部的生长,为HJ-5提供了更多的定殖位点[21-22],因而提高了根际HJ-5的定殖数量,增加了根际脂肽类物质的含量。
本研究显示,AMF与HJ-5双接种条件下,棉花黄萎病的发病指数最低。原因可能是HJ-5在生长代谢过程中产生多种脂肽类物质,导致病原菌菌丝畸形、病原菌数量下降。张荣胜等[23]研究发现,B.subtilis菌株H-74所产生的表面活性素能有效抑制水稻纹枯病菌的生长,具有抗真菌能力;顾真荣等[10]研究认为,B.subtilisG3所产生的脂肽类物质能够抑制病原菌孢子的萌发,且能长久地抑制萌发孢子芽管伸长,表现出间接的抗真菌能力。Zhao等[24]发现,甜瓜根际接种拮抗菌,伊枯草菌素含量增加,是枯萎病发病率显著降低的重要原因。本研究表明,HJ-5分泌的伊枯草菌素和表面活性素物质对V.dahliae均具有显著的抑制效果,且AMF协同HJ-5条件下,伊枯草菌素含量显著增加。表面活性素含量增加不显著,可能是由于HJ-5分泌的各种脂肽类物质浓度不同所致[25]。赵青云等[25]研究表明,伊枯草菌素含量越高,抑制病原菌的效果越好。
本实验表明,根际接种AMF促进了植株地下部的生长,增加了棉花根际HJ-5的定殖,刺激了HJ-5分泌更多的伊枯草菌素和表面活性素等抑菌物质,有效抑制了棉花黄萎病的发生,促进了棉花的生长。综上,单一接种AMF或HJ-5对作物连作病害的防治效果有限,而AMF协同HJ-5能通过提高根际脂肽类物质含量,有效抑制病害的发生,为土传病害的防治找到了新的方向。
:
[1] YUAN Y,FENG H,WANG L,et al.Potential of endophytic fungi isolated from cotton roots for biological control against Verticillium wilt disease[J].PloSOne,2017,12(1):e0170557.
[2] HORN S,HEMPEL S,VERBRUGGEN E,et al.Linking the community structure of arbuscular mycorrhizal fungi and plants:a story of interdependence?[J].TheISMEJournal,2017,11(6):1400-1411.
[3] ZHAO R X,GUO W,BI N,et al.Arbuscular mycorrhizal fungi affect the growth,nutrient uptake and water status of maize(ZeamaysL.) grown in two types of coal mine spoils under drought stress[J].AppliedSoilEcology,2015,88:41-49.
[4] LIU R J.Effect of vesicular-arbuscular mycorrhizal fungi on Verticillium wilt of cotton[J].Mycorrhiza,1995,5(4):293-297.
[5] ABO-GHALIA H H.Effect of arbuscular mycorrhizal fungusGlomusmosseaeandBacillussubtilison the infection of tomato roots byFusariumoxysporum[J].EgyptianJournalofMicrobiology,2007,42(1):29-49.
[6] TIWARI S,PANDEY S,CHAUHAN P S,et al.Biocontrol agents in co-inoculation manages root knot nematode [Meloidogyneincognita(Kofoid &White) Chitwood] and enhances essential oil content inOcimumbasilicumL.[J].IndustrialCropsandProducts,2017,97:292-301.
[7] SIASOU E,STANDING D,KILLHAM K,et al.Mycorrhizal fungi increase biocontrol potential ofPseudomonasfluorescens[J].SoilBiologyandBiochemistry,2009,41(6):1341-1343.
[8] TORRES M J,BRANDAN C P,SABATÉ D C,et al.Biological activity of the lipopeptide-producingBacillusamyloliquefaciensPGPBacCA1 on common beanPhaseolusvulgarisL.pathogens[J].BiologicalControl,2017,105:93-99.
[9] VERAS F F,CORREA A P F,WELKE J E,et al.Inhibition of mycotoxin-producing fungi byBacillusstrains isolated from fish intestines[J].InternationalJournalofFoodMicrobiology.2016,238:23-32.
[10] 顾真荣,吴畏,高新华,等.枯草芽孢杆菌G3菌株的抗菌物质及其特性[J].植物病理学报,2004,34(2):166-172.
GU Z R,WU W,GAO X H,et al.Antifungal substance ofBacillussubtilisstrain G3 and their properties[J].ActaPhytopathologicaSinica,2004,34(2):166-172.(in Chinese with English abstract)
[11] ONGENA M,JACQUES P,TOURÉ Y,et al.Involvement of fengycin-type lipopeptides in the multifaceted biocontrol potential ofBacillussubtilis[J].AppliedMicrobiologyandBiotechnology,2005,69(1):29-38.
[12] 张慧,杨兴明,冉炜,等.土传棉花黄萎病拮抗菌的筛选及其生物效应[J].土壤学报,2008,45(6):1095-1101.
ZHANG H,YANG X M,RAN W,et al.Screening of bacteria antagonistic against soil-borne cotton Verticillium wilt and their biological effects on the soil-cotton system[J].ActaPedologicaSinica,2008,45(6):1095-1101.(in Chinese with English abstract)
[13] 李社增,马平,刘杏忠,等.利用拮抗细菌防治棉花黄萎病[J].华中农业大学学报,2001,20(5):422-425.
LI S Z,MA P,LIU X Z,et al.Biological control of cotton Verticillium wilt by antagonistic bacteria[J].JournalofHuazhongAgriculturalUniversity,2001,20(5):422-425.(in Chinese with English abstract)
[14] 赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002:213-214.
[15] TROUVELOT A,KOUGH J L,CIANIAZZI-PEARSON V.Physiological and genetical aspects of mycorrhizae[M].INRA Press,1986:217-221.
[16] KINSELLA K,SCHULTHESS C P,MORRIS T F,et al.Rapid quantification ofBacillussubtilisantibiotics in the rhizosphere[J].SoilBiologyandBiochemistry,2009,41(2):374-379.
[17] TURNER J T,BACKMAN P A.Factors relating to peanut yield increases after seed treatment withBacillussubtilis[J].PlantDisease,1991,75(4):347-353.
[18] AUSHER R,KATAN J,OVADIA S.An improved selective medium for the isolation ofVerticilliumdahliae[J].Phytoparasitica,1975,3(2):133-137.
[19] BAUM C,EL-TOHAMYB W,GRUDA N.Increasing the productivity and product quality of vegetable crops using arbuscular mycorrhizal fungi:a review[J].ScientiaHorticulturae,2015,187:131-141.
[20] BARRETT G,CAMPBELL C D,HODGE A.The direct response of the external mycelium of arbuscular mycorrhizal fungi to temperature and the implications for nutrient transfer[J].SoilBiologyandBiochemistry,2014,78:109-117.
[21] 张国漪,丁传雨,任丽轩,等.菌根真菌和死谷芽孢杆菌生物有机肥对连作棉花黄萎病的协同抑制[J].南京农业大学学报.2012,35(6):68-74.
ZHANG G Y,DING C Y,REN L X,et al.The synergetic inhibition effect of arbuscular mycorrhizal fungi cooperatedBacillusvallismortisorganic fertilizer on cotton Verticillium wilt[J].JournalofNanjingAgriculturalUniversity,2012,35(6):68-74.(in Chinese with English abstract)
[22] ZHANG G Y,RAZA W,WANG X H,et al.Systemic modification of cotton root exudates induced by arbuscular mycorrhizal fungi andBacillusvallismortisHJ-5 and their effects on Verticillium wilt disease[J].AppliedSoilEcology,2013,61:85-91.
[23] 张荣胜,刘永锋,刘邮洲,等.枯草芽孢杆菌离子突变菌株H-74脂肽类抗菌物质对水稻抗性诱导作用[J].西南农业学报,2009,22(5) :1322-1325.
ZHANG R S,LIU Y F,LIU Y Z,et al.Effect of antibacterial lipopeptide fromBacillussubtilisH-74 on resistance induction of rice[J].SouthwestChinaJournalofAgriculturalSciences.2009,22(5):1322-1325.(in Chinese with English abstract)
[24] ZHAO Q,RAN W,WANG H,et al.Biocontrol of Fusarium wilt disease in muskmelon withBacillussubtilisY-IVI[J].BioControl,2013,58(2):283-292.
[25] 赵青云.抗甜瓜枯萎病生防菌及其生物有机肥的生防机理研究[D].南京:南京农业大学,2011.
ZHAO Q Y.Mechanisms of biocontrol of muskmelon Fusarium wilt disease and plant growth enhancement by application of bio-organic fertilizer[D].Nanjing:Nanjing Agriculture University,2011.(in Chinese with English abstract)
SynergeticinhibitionagainstcottonVerticilliumwiltdiseaseofarbuscularmycorrhizalfungicooperatedwithBacillusvallismortis
ZHANG Guoyi1,CHENG Lin1,HUANG Liying1,QIAN Qihui1,GUAN Linlin1,YE Wenling1,LU Hongjuan1,RAN Wei2,ZHANG Ligan1,*
(1.SchoolofResourcesandEnvironment,AnhuiProvincialKeyLaboratoryofFarmlandEcologicalConservationandPollutionPreventionandControl,AnhuiAgriculturalUniversity,Hefei230001,China;2.CollegeofResourcesandEnvironmentalSciences,NanjingAgriculturalUniversity,Nanjing210095,China)
Abstract:In the present study,the cooperative effect of arbuscular mycorrhiza fungi(AMF)GlomusversiformeandBacillusvallismortisHJ-5 against cotton Verticillium wilt disease was explored by greenhouse pot experiment,and the possible underlying mechanisms was revealed by high performance liquid chromatography(HPLC) and tablet test.As compared with control,AMF and HJ-5 showed synergistic inhibition against Verticillium wilt disease,as the disease index was reduced by 50.82%,root weight was increased by 125.00%,and the colonization of HJ-5 in rhizosphere was enhanced by 23.80%.HPLC analysis showed that HJ-5 could produce antifungal substances,i.e.iturin A and surfactin.Dual inoculation significantly increased the concentration of iturin A and surfactin in rhizosphere than single inoculation of HJ-5 by 13.38% and 11.27%,respectively.It was hypothesized that the main mechanism of synergetic inhibition was that AMF promoted cotton root growth,helped HJ-5 colonized in rhizosphere,and produce more antifungal lipopeptides.
Key words:plant disease;economic crop;iturin A;surfactin
中图分类号:S435.621
A
文章编号:1004-1524(2018)06-1008-08
收稿日期:2017-06-05
基金项目:“十三五”国家重点研发计划(2016YFD0200402);国家重点实验室项目;安徽省大学生创新训练计划(201610364025)
作者简介:张国漪(1984—),女,安徽合肥人,博士,讲师,主要从事土传病害相关研究。E-mail:zhangguoyi840307@163.com
,章力干,E-mail:liganzhang@ahau.edu.cn
10.3969/j.issn.1004-1524.2018.06.17
(责任编辑高 峻)

