马铃薯StDWF1基因克隆及表达分析
唐 晓,邓孟胜,邹 雪,李立芹,3,祝渊智,3,王西瑶,3,*
(1.四川农业大学 农学院马铃薯研究与开发中心,四川 成都 611130;2.绵阳市农业科学院,四川 绵阳 621000;3.作物科学国家级实验教学示范中心(四川农业大学),四川 成都 611130)
马铃薯StDWF1基因克隆及表达分析
唐 晓1,邓孟胜1,邹 雪2,李立芹1,3,祝渊智1,3,王西瑶1,3,*
(1.四川农业大学 农学院马铃薯研究与开发中心,四川 成都 611130;2.绵阳市农业科学院,四川 绵阳 621000;3.作物科学国家级实验教学示范中心(四川农业大学),四川 成都 611130)
摘 要:DWF1是油菜素内酯(BR)生物合成途径中的关键基因。为探索StDWF1在马铃薯生长发育中的功能,本实验以马铃薯品种费乌瑞它(Favorita)试管苗为材料,克隆StDWF1基因全长序列,开放阅读框(ORF)为1 704bp,编码567个氨基酸,蛋白质相对分子质量为66.08ku,理论等电点为7.96。利用农杆菌介导法在烟草中瞬时表达StDWF1,共聚焦显微镜观察显示StDWF1定位于细胞质。荧光定量分析表明,嫩叶中StDWF1表达量最高,其次是老叶、匍匐茎、主根、茎、块茎。对马铃薯生育期叶片StDWF1表达量进行分析,结果表明在出苗期表达量最高。本实验结果为进一步阐释BR对马铃薯生长发育的调控机制奠定理论基础。
关键词:马铃薯;StDWF1;基因克隆;表达分析;亚细胞定位
马铃薯是我国第四大粮食作物,具有生育期短、适应性强、营养丰富等特点,对于保障粮食安全、促进区域经济发展和推动现代化农业建设具有重要的现实意义[1]。而马铃薯植株的正常生长对块茎的形成和干物质合成具有重要作用,良好的植株长势是合理增加块茎产量、提升品质的有效途径,其品质和产量均影响着马铃薯保障粮食安全和农业结构性调整[2]。因此,分析马铃薯生长特点及调控机制是马铃薯生长发育研究的重要课题。
油菜素内酯(brassinosteroids,BR)是一类调控植物生长的固醇类激素,参与多种生理过程,如促进植株生长、影响呼吸和生殖器官的发育、提高植株抗逆性[3-6]。拟南芥中DWF1/DIM是一个双功能蛋白,催化24-亚甲基胆甾醇合成油菜甾醇,其表达高低直接影响内源BR含量水平,最终调控植株后续生理[7]。而其dwf1/dim突变体中,油菜素甾醇合成受阻,BR的水平大量降低[8],植株表现矮化[9]。在DWF1蛋白序列中存在与FAD结合结构域,被认为对氧化还原酶的活性具有重要的影响,并通过Southern杂交分析得到DWF1基因是单拷贝基因[10-11]。对棉花中的DWF1进行克隆及表达分析,结果发现GhDWF1能够促进纤维及胚珠发育[12]。在玉米中,对DWF1进行RNAi干扰,BR合成受阻,导致转基因植株矮化[13]。综上,DWF1在调控植物生长发育方面具有重要作用。
本实验室研究发现,BR合成及信号转导在马铃薯休眠与萌芽状态转变中发挥重要作用,其合成关键基因DWF1在萌芽时表达量显著高于休眠时期[14],进一步利用500 nmol·L-124-eBL处理休眠期马铃薯块茎,证明500 nmol·L-124-eBL可有效促进马铃薯萌芽生长,并且经BL处理种薯,其植株抗性明显增强、产量显著提高,因此DWF1可能通过促进BR的合成在马铃薯生长发育中发挥重要作用[15]。
本研究从马铃薯品种费乌瑞它中克隆到StDWF1基因全长CDS序列,利用生物信息学对StDWF1蛋白进行理化性、同源性等分析,通过亚细胞定位明确StDWF1蛋白作用区域,结合qRT-PCR分析StDWF1基因在马铃薯各组织表达特异性,并测定不同生育期中StDWF1表达差异,最终为StDWF1的功能机制研究奠定基础。
1 材料与方法
1.1 实验材料
马铃薯品种费乌瑞它试管苗,由四川农业大学农学院马铃薯研究与开发中心提供。大肠埃希菌感受态DH5α购自Vazyme Biotech公司,RNA提取试剂盒、DNA凝胶纯化回收试剂盒购自天根公司,高保真Pfu酶、限制性内切酶、SYBR Green Master mix、DNA Ligation Kit 2.0、克隆载体pMDTM19-T Simple Vector购自TaKaRa公司。引物合成与测序由成都擎科梓熙生物技术有限公司完成。
1.2 方法
1.2.1 马铃薯StDWF1基因克隆
根据拟南芥材料DWF1基因序列,在NCBI同源比对到马铃薯BR合成关键基因StDWF1。用天根公司的植物总RNA提取试剂盒提取费乌瑞它试管苗叶片RNA。RNA电泳检测采用1%的琼脂凝胶电泳。根据StDWF1开放阅读框序列设计克隆全长引物,由成都擎科梓熙生物技术有限公司合成,StDWF1 F:5′-ATGGCAGATGTTCAGGCTCC-3′;StDWF1 R:5′-CTAATCTTCAGGCTCATCAA-3′。按TakaRa公司的cDNA合成试剂盒使用说明进行反转录。PCR扩增反应条件:95℃预变性 3min;95℃变性30s,58℃退火30s,72℃延伸60s,30个循环;72℃延长10min。产物于1%琼脂糖凝胶电泳检测。胶回收的PCR产物重组到克隆载体pMD19-T上,然后转化至大肠埃希菌DH5α感受态中,Ampr抗性筛选,并在LB培养基上加4μL IPTG(200mg·mL-1)、40μL X-gal(20mg·mL-1)与转化产物一起涂布涂匀,37℃培养12h,通过蓝白斑筛选,菌液PCR检测鉴定后送成都擎科梓熙生物技术有限公司测序。
1.2.2 StDWF1蛋白的生物信息学分析
引物序列设计均使用Primer 5.0软件;将测得的序列拼接后通过NCBI的BLAST比对同源序列(http://blast.Ncbi.Nlm.nih.gov/);利用在线ProtParam预测(http://web.expasy.org/cgi-bin/protparam/protparam)程序预测氨基酸序列分子量和理论等电点(pI) 、不稳定系数等;通过SOPMA在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构,运用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive)和BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分别预测结构域三维建模和蛋白质保守域;使用在线工具PSORT(http://psort.hgc.jp/form.html)预测StDWF1的亚细胞定位;通过DNAMAN软件进行同源序列比对,并通过氨基酸序列构建系统进化树。
1.2.3 qRT-PCR分析
提取费乌瑞它成熟期不同组织(根、匍匐茎、老叶、嫩叶、茎及块茎)和不同生育时期(出苗期、块茎膨大期、淀粉累积累期、成熟期)的叶片(播种后2周开始取样,取样周期为1周)的总RNA,以Oligo(dT)为引物,按照First Strand cDNA Synthesis Kit逆转录试剂盒合成cDNA。根据马铃薯基因组数据库设计内参EF1αL引物,即EF1αL F: 5′-CTTGTACACCACGCTAAGGAG-3′;EF1αL R:5′-GTCAATGCAAACCATTCCTTG-3′。依据全长cDNA序列设计StDWF1定量引物DWF1-P1: 5′-AGTTGGTGGACTTTCTTCTTTC-3′;DWF1-P2:5′-TTCTGCATTCCTCTGTTCAAG-3′。定量PCR反应体系为:4.5μL cDNA,上下游引物(10μmol·L-1)各0.25μL,2×Ssofast Eva Green 5μL,ddH2O补足10μL。反应程序为95℃ 30 s;95℃ 5s,55℃ 5s,39个循环;95℃ 10s,65~95℃做熔解曲线,各温度以0.5℃上升,并停5 s。每个试验样品设置3个重复,基因表达量用2-△△Ct方法在Bio-Rad CFX Manager V软件上进行分析,测定StDWF1在马铃薯不同组织部位和叶片不同生育时期的表达量。
1.2.4 亚细胞定位
根据StDWF1的全长CDS序列设计带BsaⅠ和Eco31Ⅰ酶切位点引物,DWF(+):5′-CAGTCGTCTCACAACATGGCAGATGTTCAGGCTCC-3′;DWF1(-):5′-CAGTCGTCTCATACAATCTTCAGGCTCATCAACTT-3′,对全长cDNA序列进行扩增,并对PCR产物和pBWA(V)HS-ccdb-Glosgfp载体进行双酶切,经连接转化大肠埃希菌DH5α感受态细胞,鉴定后提取重组质粒。将构建完成的pBWA(V)HS-DWF1-Glosgfp通过农杆菌浸染法[16]转化至农杆菌GV3101,对本氏烟草进行浸染,弱光培养2d后,在激光共聚焦显微镜下观察荧光融合蛋白表达部位。
2 结果与分析
2.1 StDWF1基因克隆
总RNA电泳检测表明18S和28S条带清晰,分光光度计测定D260/D280和D260/D230均为2.0,RNA质量良好。以总RNA反转录合成cDNA为模板进行PCR扩增,电泳结果在约1 700bp位置有清晰条带(图1)。将该条带回收纯化后与pMD19-T载体连接后,转化大肠埃希菌。采用菌落PCR方法鉴定阳性克隆,随机挑选3个重组质粒至成都擎科梓熙生物技术有限公司进行测序,结果表明目的片段大小为1 704bp(图2)。
2.2 StDWF1蛋白的生物信息学分析
2.2.1 氨基酸序列分析
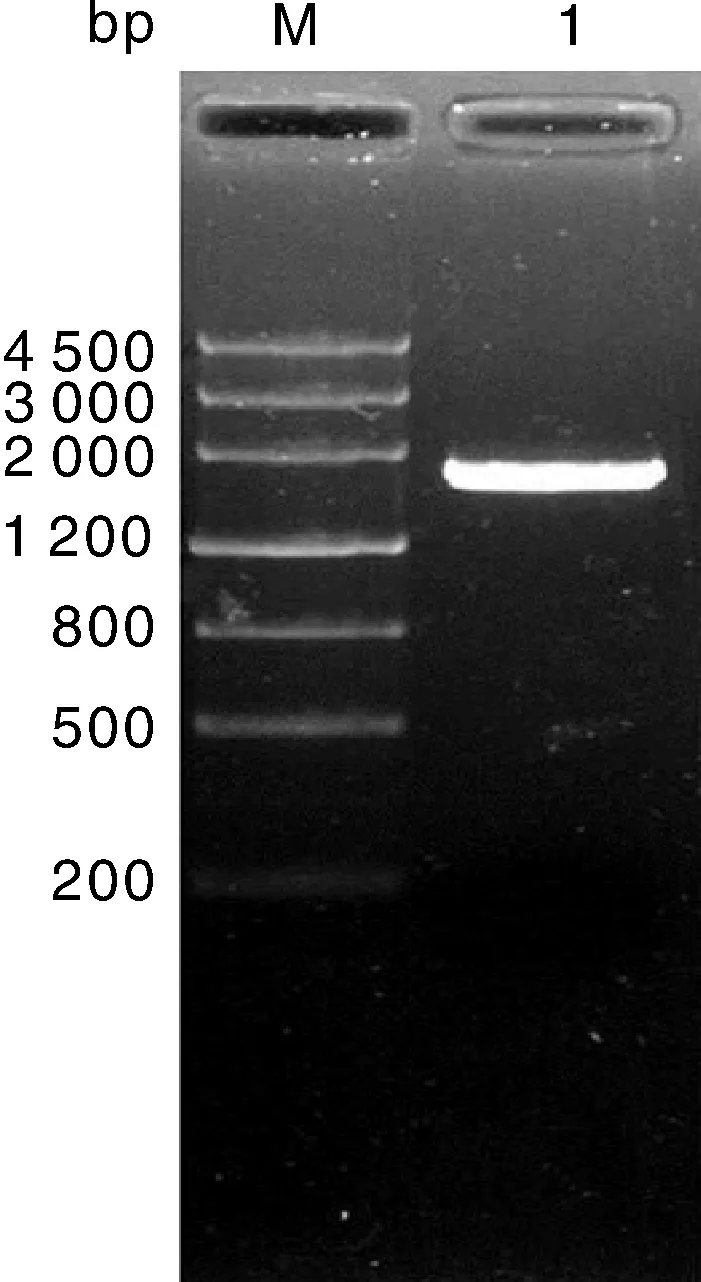
M,Marker 4500bp;1,StDWF1基因。M,Marker 4500bp;1,StDWF1 gene PCR product.图1 StDWF1的克隆Fig.1 Cloning of StDWF1
将StDWF1与其他物种DWF1进行BLAST比对,结果显示与番茄同源性高达98%,其次是旋蒴苣苔85%和柑橘85%。使用DNAMAN软件对番茄(NP_001234550.1)、旋蒴苣苔(KZV24322.1)以及柑橘(XP_006437509.1)等进行多序列对比(图3),结果表明马铃薯StDWF1序列与其他DWF1家族基因具有较高同源性。将StDWF1序列BLAST分析其保守区域,结果显示StDWF1具有FAD结合结构域保守区域,位于第48~231位氨基酸。同时该序列还具有3个可以作为跨多个结构域的模型结构域,它们没有被分配到任何结构域家族,分别为GlcD、FAD_lactone_ox和PLN02805。
2.2.2 StDWF1的理化性质分析
通过ProtParam软件在线预测分析StDWF1蛋白理化性质,分析结果表明,蛋白(C3018H4623N783O844S22)由567个氨基酸组成,总相对分子质量为66.08ku,其中负电荷氨基酸75个,正电荷氨基酸77个,蛋白质理论等电点为7.96,不稳定系数为36.66,该蛋白可能是一个稳定的弱碱性蛋白。总平均亲水系数为-0.404,预测该蛋白属于亲水性蛋白。
2.2.3 蛋白质结构分析
DWF家族是由FAD作为辅基时发生氧化还原反应所对应的酶构成的,因此所克隆的基因正确。在SOPMA在线软件上分析蛋白质二级结构主要以α-螺旋和无规则卷曲为主,分别占到39.15%、29.28%,其次为23.81%β-折叠和7.76%β-转角(图4)。通过SWISS-MODEL在线分析建立三维结构模型图(图5),并将结果与二级结构预测相对比,结果较为统一。
2.2.4 StDWF1序列对比和进化树分析
为确立StDWF1在不同物种间的进化关系,用氨基酸序列在NCBI与其他物种序列比对,大部分为双子叶植物。利用进化树分析物种间亲缘关系(图6),同属于茄科植物的马铃薯、番茄、辣椒和烟草属于同一分支,同属于蔷薇科的苹果和梨在同一分支,同属于豆科的绿豆、红小豆、菜豆、大豆以及木豆也在同一分支,其他科、属的植物也按此聚类,与现有分类系统相符。
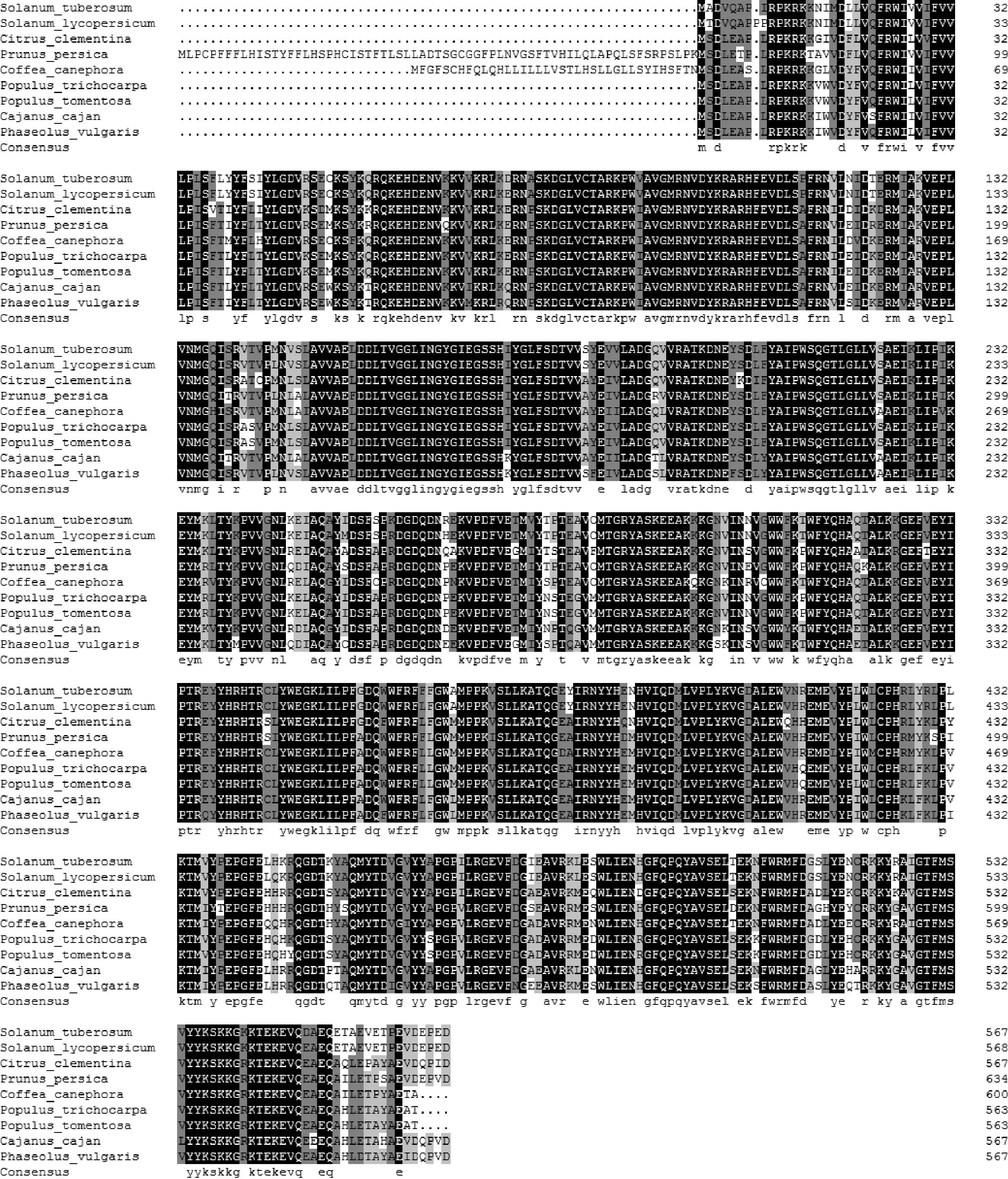
图3 StDWF1序列与其他DWF1氨基酸多重序列对比Fig.3 Multiple alignment of DWF1 amino acids sequence

图4 StDWF1蛋白二级结构预测Fig.4 Prediction of secondary structure of StDWF1

图5 StDWF1蛋白三级结构预测Fig.5 Predicted tertiary structure of StDWF1
2.3 亚细胞定位
以总RNA为模板,通过DWF(+)和DWF(-)引物扩增目的片段,酶切后与pBWA(V)HS-ccdb-Glosgfp连接,扩大培养后提取质粒酶切鉴定,并送测序,序列BLAST后证明重组质粒构建成功。将鉴定后的重组质粒转化入GC3101中,对幼嫩烟草进行融合蛋白瞬时表达,观察发现空载荧光信号粗细不一且有原点,说明其可能遍布细胞核、细胞质、细胞膜(图7-A),而含有目的基因的荧光信号呈不均匀线状,说明StDWF1被定位于细胞质(图7)。
2.4 StDWF1基因组织表达分析
实时荧光定量分析马铃薯根、匍匐茎、块茎、茎、老叶及嫩叶StDWF1基因表达(图8)。结果显示,在5种组织中均有表达。经显著性分析(P≤0.05),StDWF1基因在嫩叶、老叶和匍匐茎中表达量显著高于其他组织部位,其次是块茎、根、茎。表明StDWF1主要在费乌瑞它嫩叶、老叶和匍匐茎中表达,其各组织表达存在显著差异。
2.5 马铃薯生长不同时期叶片中StDWF1的表达分析
对叶片每个时期进行定量分析,发现StDWF1基因在各生长阶段均有表达,利用显著性分析(P≤0.05)将整个生育期分为3个阶段:第一阶段(0~14d)为马铃薯出苗期,叶片中StDWF1基因表达量最高,其高量的表达快速催化合成BR等生长类物质,促进幼苗营养生长;第二阶段(21~28d)为幼苗期与块茎形成期,植株生长处于平稳,大量叶片StDWF1稳定催化合成BR等生长物质,用于植株生长,此时叶片中StDWF1表达量较出苗期降低;第三阶段(35~56d)包括马铃薯块茎增长期与淀粉积累期,此时整个叶片生长趋于稳定,StDWF1表达下降至最低,对BR等促生长物质需求量减少,而主要依靠光合作用向块茎大量输送物质,促进块茎淀粉合成与积累(图9)。

图6 StDWF1的系统进化分析Fig.6 Phylogenetic analysis of StDWF1

A,空载荧光信号;B,目的基因荧光信号。A,Contrast fluorescence signal;B,Fluorescent signal of target gene.图7 StDWF1-GFP在烟草中的瞬时表达Fig.7 Transient expression of StDWF1-GFP in tobacco

不同柱形上没有相同字母表示差异显著(P<0.05)。下同。The bars without the same letters showed the significant difference(P<0.05).The same as below.图8 马铃薯不同组织部位中StDWF1基因的表达分析Fig.8 Analysis of relative expression of StDWF1 in different tissues of potato

图9 StDWF1基因在马铃薯叶片不同时期表达分析Fig.9 Analysis of relative expression of StDWF1 in different periods of potato
3 讨论
DWF1基因多步催化BR合成,是调节BR合成的关键基因。而BR为植物中第六大激素,调控植株生长、种子萌发以及抗性胁迫等重要生长发育过程,前期研究表明BR相关基因SMT1[17]、BRI[18]、BIN2[19]等均通过调节BR合成与信号影响植物生长发育。本实验克隆BR合成的重要基因StDWF1,并对其进行蛋白质二级结构、三级结构以及进化关系分析,再进一步研究了该蛋白的表达定位和基因在马铃薯各组织中的表达特异性以及在马铃薯植株各生育期的表达变化,研究StDWF1表达在调控马铃薯生长发育中的重要作用。
本实验从费乌瑞它叶片中克隆了StDWF1全长编码序列1 704bp,与前期马铃薯全基因组和转录组研究结果一致。氨基酸同源序列比对和保守域分析,发现StDWF1蛋白包含高度保守的FAD结合结构域[10],是催化氧化还原反应的重要功能域[8],前期结果表明FAD结合结构域由α+β两个子域构成[13],经预测分析表明马铃薯FAD同样由以上两个子域构成,证实StDWF1与拟南芥、水稻、玉米等植物中DWF1功能存在高度同源性,在催化BR合成上具有重要的作用。进一步运用邻比法分析StDWF1在植物进化中的亲缘关系,结果表明StDWF1与同科植物番茄、烟草亲缘关系最近,与番茄StDWF1序列同源性高达98%,而与杨树、绿豆等植物亲缘关系最远,符合植物各科属在进化中的关系,而其亲缘关系的远近程度也体现了各同源蛋白与StDWF1蛋白的功能相似性,与同科植物番茄、烟草DWF1相比,三者间DWF1的功能相似性更高,为以后StDWF1功能的研究奠定了理论基础。
前期研究表明,催化植物甾醇最后阶段合成酶主要分布在内质网膜上,对拟南芥和玉米的DWF1进行GFP-DWF1/DIM融合蛋白烟草瞬时表达,结果均表明DWF1定位于细胞质内质网膜[7,13],进一步研究发现玉米DWF1蛋白精确定位在光面内质网上。而本实验利用PSORT生物信息软件分析发现马铃薯StDWF1亚细胞定位于微体上,与前期DWF1亚细胞定位结果存在明显差异,进一步在烟草叶片中瞬时表达StDWF1-GFP融合蛋白,共聚焦显微镜观察发现StDWF1大量分布于边缘细胞质中,而微体也主要分布在细胞质边缘,包含多种催化氧化还原的酶体,烟草亚细胞定位结果与预测定位于微体结果一致,但具体定位仍需深入分析,而与玉米DWF1定位于光面内质网存在一定差异,表明各物种间DWF1虽均能催化氧化还原反应,但其蛋白功能定位也存在差异。
组织表达分析发现,StDWF1在马铃薯各个组织部位均有表达,并在幼嫩部位表达量较高,与DWF1在玉米、豌豆和棉花中的表达模式一致[12,20-22]。研究证明,BR合成酶主要集中在叶片表皮组织,参与叶片内囊体中光合链的电子传递[10,23-24],因此本实验发现,StDWF1在叶片中的表达量明显高于根、茎等其他组织。另外,对马铃薯匍匐茎分析发现,其表达均高于根、茎等组织,体现了DWF1在马铃薯植株中表达的特殊性,匍匐茎需大量合成BR等生长物质,促进块茎的形成与膨大以及后期的干物质积累。为明确StDWF1在马铃薯生长发育中的作用,利用qRT-PCR分析不同发育时期叶片中基因表达量,结果发现,出苗期StDWF1的表达水平最高,证明StDWF1催化BR等相关生长物质的合成,促进马铃薯幼苗的快速营养生长,故该时期基因表达旺盛,这与玉米、棉花中发育旺盛时期的表达趋势一致[19,23],均表明了DWF1对植株生长发育的重要调控作用。而随着马铃薯的生长,该基因在叶片中的表达量逐步下降,维持相对稳定的水平,主要是维持叶片中正常的新陈代谢[25-26];另一方面,叶片中DWF1表达的下降,可能通过其他部位合成弥补叶片合成减少,可见,BR在马铃薯各组织中的合成是不断变化的,且有可能BR不存在各组织间长距离运输情况[13]。
:
[1] 杨帅,闵凡祥,高云飞,等.新世纪中国马铃薯产业发展现状及存在问题[J].中国马铃薯,2014,28(5):311-316.
YANG S,MIN F X,GAO Y F,et al.Status quo and challenges of China potato industry of the 21st century[J].ChinesePotatoJournal,2014,28(5):311-316.(in Chinese with English abstract)
[2] 庞昭进,郭安强,杨建忠,等.关于马铃薯主食化的思考[J].河北农业科学,2017,21(5):91-93.
PANG Z J,GUO A Q,YANG J Z,et al.Thinking about potato as staple food grain in China[J].JournalofHebeiAgriculturalSciences,2017,21(5):91-93.(in Chinese with English abstract)
[3] 何宇炯,徐如涓,赵毓橘.表油菜素内酯对油菜幼苗生长及其可溶性糖和蛋白质含量的影响[J].植物生理学通讯,1995,31(1):37-39.
HE Y J,XU R J,ZHAO Y J.Effect of ESBR on the growth and content of soluble saccharide and proteins ofBrassicacampestrisseedlings[J].PlantPhysiologyCommunication,1995,31(1):37-39.(in Chinese with English abstract)
[4] MARTINE F D,WANG Q Y,SOFIA B T.Invitrostem elongation of sweet pepper inmedia containing 24-epi-brassinolide[J].PlantCellTissueandOrganCulture,1998,53(2):79-84.
[5] BEST N B,HARTWIG T,BUDKA J,et al.Nana plant2 encodes a maize ortholog of theArabidopsisbrassinosteroid biosynthesis geneDWARF1,identifying developmental interactions between brassinosteroids and gibberellins[J].PlantPhysiology,2016,171(4):2633-2647.
[6] 贾洪涛,张立富.油菜素内酯提高小麦萌发期间抗盐性机理初探[J].临沂师范学院学报,2001,23(4):58-59.
JIA H T,ZHANG L F.The initial study of salt tolerance mechanism increased by seed soaking of brassinolide during the germination of maize[J].JournalofLinyiTeachers’College,2001,23(4):58-59.(in Chinese with English abstract)
[7] KLAHRE U,NOGUEHI T,FUJIOKA S,et al.The aarbidopsisDIMINUTO/DWARF1 gene eneodes a portein involved in steroid synthesis[J].PlantCell,1998,10(10):1677-1690.
[8] CHOE S,DILKES B P,GREGORY B D,et al.Thearabidopsisdwarf1 mutant is defective in the conversion of 24-methylenecholesterol to campesterol in brassinosteroid biosynthesis[J].PlantPhysiology,1999,119(3):897-907.
[9] KAUSCHMANN A,JESSOP A,KONCZ C,et al.Genetic evidence for an essential role of brassinosteroids in plant development[J].PlantJournal,2003,9(5):701-713.
[10] MUSHEGIAN A R,KOONIN E V.A putative FAD-binding domain in a distinct group of oxidases including a protein involved in plant development[J].ProteinScience,1995,4(6):1243-1244.
[11] SAWAI S,OHYAMA K,YASUMOTO S,et al. Sterol side chain reductase 2 is a key enzyme in the biosynthesis of cholesterol,the common precursor of toxic steroidal glycoalkaloids in potato[J].PlantCell,2014,26(9):3763-3774.
[12] 罗明,周建平,肖月华,等.棉花油菜素类固醇合成酶基因GhDWF1的克隆和表达分析[J].中国农业科学,2007,40(7):1337-1344.
LUO M,ZHOU J P,XIAO Y H,et al.Cloning and expression analysis of a brassinosteroid biosynthetic enzyme gene,GhDWF1,from cotton(GossypiumhirsuturmL.)[J].ScientiaAgriculturaSinica,2007,40(7):1337-1344.(in Chinese with English abstract)
[13] 陶亚忠.玉米与油菜素类固醇生物合成相关的基因ZmDWF1的克隆及其功能分析[D].北京:中国农业大学,2004.
TAO Y Z.Cloning and functional analysis ofZmDWF1,a gene related toBrassicasteroid biosynthesis [D].Beijing:China Agricultural University,2004.(in Chinese with English abstract)
[14] LI L Q,ZOU X,DENG M S,et al.Comparative morphology,transcription,and proteomics study revealing the key molecular mechanism of camphor on the potato tuber sprouting effect[J].InternationalJournalofMolecularSciences,2017,18(11):2280.
[15] 邹雪,邓孟胜,李立芹,等.油菜素内酯合成和信号转导基因在马铃薯块茎贮藏期间的表达变化及对萌芽的影响[J].作物学报,2017,43(6):811-820.
ZOU X,DENG M S,LI L Q,et al.Expression changes of genes related to brassinosteroid biosynthesis and signal transduction during potato storage and its effect on tuber sprouting[J].ActaAgronomicaSinica,2017,43(6):811-820.(in Chinese with English abstract)
[16] 邹雪.StGAPC和AtGAPC2基因的克隆以及对马铃薯的转化[D].雅安:四川农业大学,2011.
ZOU X.Cloning ofStGAPCandAtGAPC2 genes and transformation of potato[D].Ya’an:Sichuan Agricultural University,2011.(in Chinese with English abstract)
[17] TABATA S,KANEKO T,NAKAMURA Y,et al.Sequence and analysis of chromosome 5 of the plantArabidopsisthaliana[J].Nature,2000,408(6814):816-820.
[18] MONTOYA T,NOMURA T,FARRAR K,et al.Cloning the tomato Curl3 gene highlights the putative dual role of the leucine-rich repeat receptor kinase tBRI1/SR160 in plant steroid hormone and peptide hormone signaling[J].PlantCell,2002,14(12):3163-3176.
[19] LI J,NAM K H.Regulation of brassinosteroid signaling by a GSK3/SHAGGY-like kinase[J].Science,2002,295(5558):1299-1301.
[20] NOMURA T,KITASAKA Y,TAKATSUTO S,et al.Brassinosteroid/sterol synthesis and plant growth as affected by lka and lkb mutations of pea[J].PlantPhysiology,1999,119(4):1517-1526.
[21] SCHULTZ L,KERCKHOFFS L H J,KLAHRE U,et al.Molecular characterization of the brassinosteroid-deficient lkb mutant in pea[J].PlantMolecularBiology,2001,47(4):491-498.
[22] TAO T,ZHENG J,XU Z,et al.Functional analysis ofZmDWF1,a maize homolog of theArabidopsisbrassinosteroidsDWF1/DIMgene[J].PlantScience,2004,167(4):743-751.
[23] TAKAHASHI T,GASCH A,NISHIZAWA N,et al.TheDIMINUTOgene ofArabidopsisis involved in regulating cell elongation[J].Genes&Development,1995,9(1):97.
[24] SAVALDIGOLDSTEIN S,PETO C,CHORY J.The epidermis both drives and restricts plant shoot growth[J].Nature,2007,446(7132):199-202.
[25] PENG L,KAWAGOE Y,HOGAN P,et al.Sitosterol-beta-glucoside as primer for cellulose synthesis in plants[J].Science,2002,295(5552):147-150.
[26] FUJIOKA S,YOKOTA T.Biosynthesis and metabolism of brassinosteroids[J].PhysiologiaPlantarum,2010,100(3):710-715.
CloningandexpressionanalysisofStDWF1inSolanumtuberosum
TANG Xiao1,DENG Mengsheng1,ZOU Xue2,Li Liqin1,3,ZHU Yuanzhi1,3,WANG Xiyao1,3,*
(1.PotatoResearchandDevelopmentCenter,CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu611130,China;2.MianyangAcademyofAgriculturalSciences,Mianyang621000,China;3.NationalDemonstrationCenterforExperimentalCropScienceEducation(SichuanAgriculturalUniversity),Chengdu611130,China)
Abstract:TheDWF1 is a key gene in brassinosteroid(BR) biosynthesis pathway.To explore the function ofStDWF1 in the growth and development of potato,this experiment was based on the potato variety Favorita test-tube plantlets,and we cloned the full-length sequence ofStDWF1 gene.The open reading frame(ORF) ofStDWF1 gene was 1 704bp,and encoded 567 amino acids.The molecular weight of protein was 66.08ku,and the isoelectric point(pI) was 7.96.Agrobacteriumtumefaciens-mediated transient expression was carried out in tobacco,and laser scanning confocal microscopy showed that potato StDWF1 was located in cytoplasm.Fluorescence quantitative analysis showedStDWF1 expression quantity was the highest in new leaves,followed by old leaves,stolon,roots,stems and tubers.We analyzed the expression ofStDWF1 in potato leaves at the growth period,and the results showed that the highest expression quantity was in potato seedling stage.The results of this experiment laid the theoretical foundation for further interpreting the regulation mechanism of BR in the potato growth and development.
Key words:potato;DWF1;gene cloning;expression analysis;subcellular localization
中图分类号:S532
A
文章编号:1004-1524(2018)06-0909-09
收稿日期:2018-01-04
基金项目:四川省学术和技术带头人培养经费(03120233);四川农业大学大学生科研兴趣培养计划(ky2016247)
作者简介:唐晓(1992—),男,四川成都人,硕士研究生,研究方向为马铃薯分子生物学。E-mail:354550329@qq.com
,王西瑶,E-mail:1357664714@qq.com
10.3969/j.issn.1004-1524.2018.06.04
(责任编辑张 韵)

