响应面法优化马铃薯茎段高效再生体系
江林娟,邹 雪,黄雪丽,倪 苏,李立芹,杨世民,2,*
(1.四川农业大学 农学院,四川 成都 611130;2.四川农业大学 作物科学国家级实验教学示范中心,四川 成都 611130)
响应面法优化马铃薯茎段高效再生体系
江林娟1,邹 雪1,黄雪丽1,倪 苏1,李立芹1,杨世民1,2,*
(1.四川农业大学 农学院,四川 成都 611130;2.四川农业大学 作物科学国家级实验教学示范中心,四川 成都 611130)
摘 要:为了探讨马铃薯茎段愈伤组织高效再生的最佳激素浓度配比,建立马铃薯组织培养和快速繁殖技术新体系,以马铃薯品种川芋10号茎段为外植体诱导的愈伤组织为材料,通过采用响应面方法(RSM)中的Box-Behnken设计方法,研究TDZ、2,4-D、GA3浓度对马铃薯茎段愈伤组织芽分化的影响,优化马铃薯愈伤组织芽分化的最佳激素配比。结果表明,从响应面法优化所得模型可知,培养基中的激素浓度变化对马铃薯愈伤组织出芽敏感性TDZ>GA3>2,4-D;所得模型的决定系数R2为0.9921,确定了川芋10号茎段愈伤组织芽分化最佳培养基为MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3,在此条件下,实际测得的平均出芽率与预测值基本一致,证实了该模型的有效性。
关键词:马铃薯;愈伤组织;响应面法;培养基
马铃薯(SolariumtuberosumL.)是世界四大粮食作物之一,属粮菜兼用型作物,也是植物组织培养和细胞培养的模式作物。目前,马铃薯愈伤组织再生体系的研究较多,普遍采用正交试验设计不同激素配比归纳出最优组合[1-2],但无法确定整个区域上因素的最优条件与响应值。响应面法在试验条件优化过程中可以连续地对试验因素的各个水平进行分析,克服了正交试验只能对一个个孤立的试验点进行分析和不能给出直观图形的缺陷[3]。笔者采用响应面法优化马铃薯茎段愈伤组织再生体系,为提高马铃薯愈伤组织再生效率,缩短培养时间,寻找更优的试验设计方法。
响应面分析法(response surface methodology,RSM)是近几年来国外工作者常用的实验设计和优化法,使用方便,优选条件预测性好[4-5],已在植物愈伤组织研究中广泛应用。Abbasi等[6]通过运用响应面法获得诱导和分化大豆愈伤组织的最佳培养基激素配比。Bagherieh等[7]运用响应面法设计研究滇紫草愈伤组织继代培养基体系。川芋10号具有单株产量高,生育期短,植株健壮,不易倒伏,鲜薯品质优,块茎休眠期较长,较耐贮,淀粉含量高等优点[8-9]。本研究应用响应面法中的Box-Behnken设计方法对影响川芋10号马铃薯愈伤组织芽分化的激素配比的培养条件进行优化,建立川芋10号马铃薯组织培养的技术体系,以期为其他植物再生体系的构建提供一定借鉴。
1 材料与方法
1.1 材料
1.1.1 供试苗
马铃薯品种川芋10号脱毒试管苗,由四川农业大学农学院马铃薯研究开发中心提供。
1.1.2 试剂
所用植物生长调节剂(plant growth regulator,PGR)包括:6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)、噻苯隆(thidiazuron,TDZ)、赤霉素(gibberellin acid A3,GA3)等购自Sigma公司,萘乙酸(1-naphthaleneacetic acid,NAA)、2,4-二氯苯氧基乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)和MS培养基(含3%蔗糖,0.6%琼脂),各成分均为国产分析纯。
1.2 方法
1.2.1 培养条件
以MS为基本培养基(pH5.8),培养温度为(22±2)℃,光照条件为日光灯光强1500~2000μmol·m-2·s-1,光照时间14h·d-1,黑暗10h·d-1。
1.2.2 愈伤组织的诱导
挑选生长健壮,长势相当的20d左右脱毒马铃薯品种试管苗,取不带侧芽的茎段0.5cm左右,接种于愈伤组织诱导培养基MS+1.5mg·L-16-BA+0.4mg·L-1NAA+0.2mg·L-12,4-D,以平铺方式培养,每瓶接种10个茎段,接种150瓶,暗培养7d后见光培养。茎段诱导培养3、7、14d观察记录愈伤组织生长情况。根据愈伤组织形成情况,分别于7、14d考察愈伤组织数量、长势、颜色与状态,并统计愈伤组织诱导率、愈伤组织鲜质量增长率。
1.2.3 不同激素配比对愈伤组织芽分化的影响
采用响应面方法中的Box-Behnken设计,对影响马铃薯茎段愈伤组织再生体系的关键因素进行研究和探索,以获得芽分化最佳的条件参数。基于前期单因素预试验,得知影响马铃薯茎段愈伤组织芽分化率的激素有TDZ、2,4-D、GA3。本研究采用三因素三水平的响应面分析方法进行试验,以TDZ、2,4-D、GA3的3种激素的浓度为3个因素,以愈伤组织出芽率为响应值(表1),根据中心组合(Box-Behnken)试验设计原理,确定愈伤组织分化培养中激素组合的最佳配比。挑选生长旺盛、结构疏松的新鲜愈伤组织转移到不同激素配比的分化培养基上,每个处理接种8瓶,每瓶8个外植体,见光培养。分化培养30d后观察记录愈伤组织生长情况,以芽长度大于0.5cm的愈伤组织数量来统计不同培养基愈伤组织出芽率,讨论这3种激素不同浓度组合对愈伤组织分化的影响。

表1 Box-Behnken设计因素与水平
1.2.4 最佳激素的配比及验证
为进一步确定最佳的激素浓度,在模型浓度范围内选择出发点,按照模型使用快速上升法优化,可得愈伤组织芽分化的最佳激素配比。用模型的最佳激素配比培养愈伤组织,来验证该模型的有效性。分化培养20d愈伤组织于OLYMPUS SZX7体视显微镜(目镜10倍,物镜5.6倍)下观察,OLYMPUS DP26成像系统拍照,ACDSee 3.1软件获取图片。
1.2.5 再生植株的生根培养
待愈伤组织上的不定芽长到1~2cm时,将其剪下,置于MS培养基中生根培养,14d后观察植株生长情况。
2 结果与分析
2.1 愈伤组织诱导及生长状况
试验结果显示,接种茎段2~3d后,茎段两端切口处便明显膨大,可见到有淡黄色愈伤组织出现,其后愈伤组织沿维管束向茎段中间生长,7d左右的愈伤组织即可长满茎段表面,诱导率高达90.55%;14d左右的愈伤组织从外观上出现了较大的变化,颜色由淡黄色变成黄绿色,且生长旺盛,愈伤组织增重率高达500.56%(图1)。
2.2 响应面法分析不同激素浓度配比对愈伤组织分化的影响
2.2.1 不同激素浓度配比对愈伤组织分化的影响结果及方差分析
利用响应面法对影响马铃薯愈伤组织芽分化率的主要激素参数条件进行优化,采用Design-Expert.V8.0.6.1统计软件进行试验设计与回归分析,结果见表2、表3。从方差分析结果可以看出,TDZ对出芽率的影响最为显著,其次是GA3,而2,4-D影响较小。
2.2.2 模型拟合与优化

图1 茎段愈伤组织Fig.1 Stem callus tissues
表2Box-Behnken试验设计与结果
Table2Box-Behnken design and results
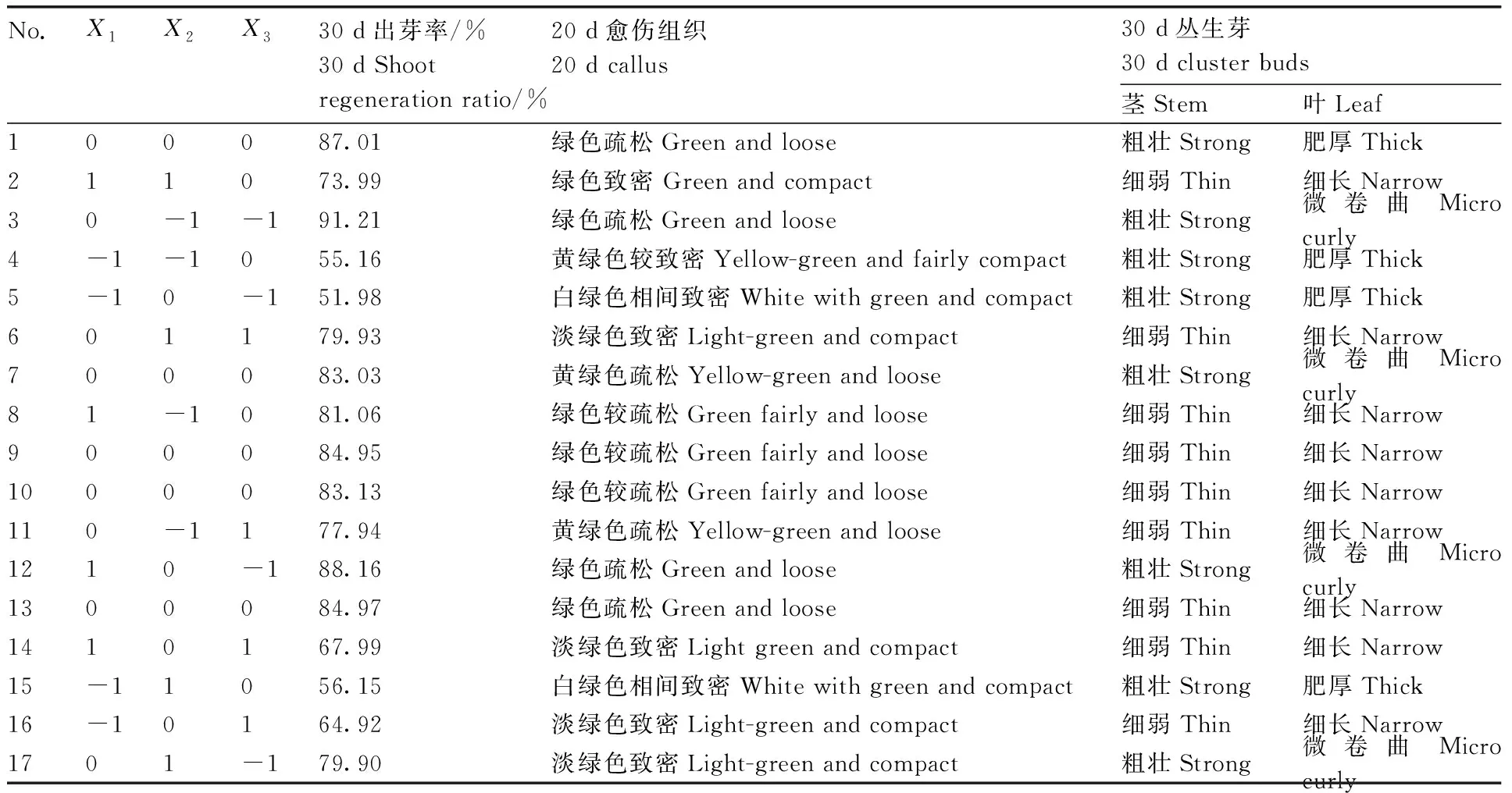
No.X1X2X330 d出芽率/%30 d Shootregeneration ratio/%20 d愈伤组织20 d callus30 d丛生芽30 d cluster buds茎Stem叶Leaf100087.01绿色疏松Green and loose粗壮Strong肥厚Thick211073.99绿色致密 Green and compact细弱Thin细长Narrow30-1-191.21绿色疏松Green and loose粗壮Strong微卷曲Micro curly4-1-1055.16黄绿色较致密Yellow-green and fairly compact粗壮Strong肥厚Thick5-10-151.98白绿色相间致密White with green and compact粗壮Strong肥厚Thick601179.93淡绿色致密Light-green and compact细弱Thin细长Narrow700083.03黄绿色疏松Yellow-green and loose粗壮Strong微卷曲Micro curly81-1081.06绿色较疏松Green fairly and loose细弱Thin细长Narrow900084.95绿色较疏松Green fairly and loose细弱Thin细长Narrow1000083.13绿色较疏松Green fairly and loose细弱Thin细长Narrow110-1177.94黄绿色疏松Yellow-green and loose细弱Thin细长Narrow1210-188.16绿色疏松Green and loose粗壮Strong微卷曲Micro curly1300084.97绿色疏松Green and loose细弱Thin细长Narrow1410167.99淡绿色致密Light green and compact细弱Thin细长Narrow15-11056.15白绿色相间致密White with green and compact粗壮Strong肥厚Thick16-10164.92淡绿色致密Light-green and compact细弱Thin细长Narrow1701-179.90淡绿色致密Light-green and compact粗壮Strong微卷曲Micro curly
表3回归模型各项的方差分析
Table3Variance analysis of regression equation
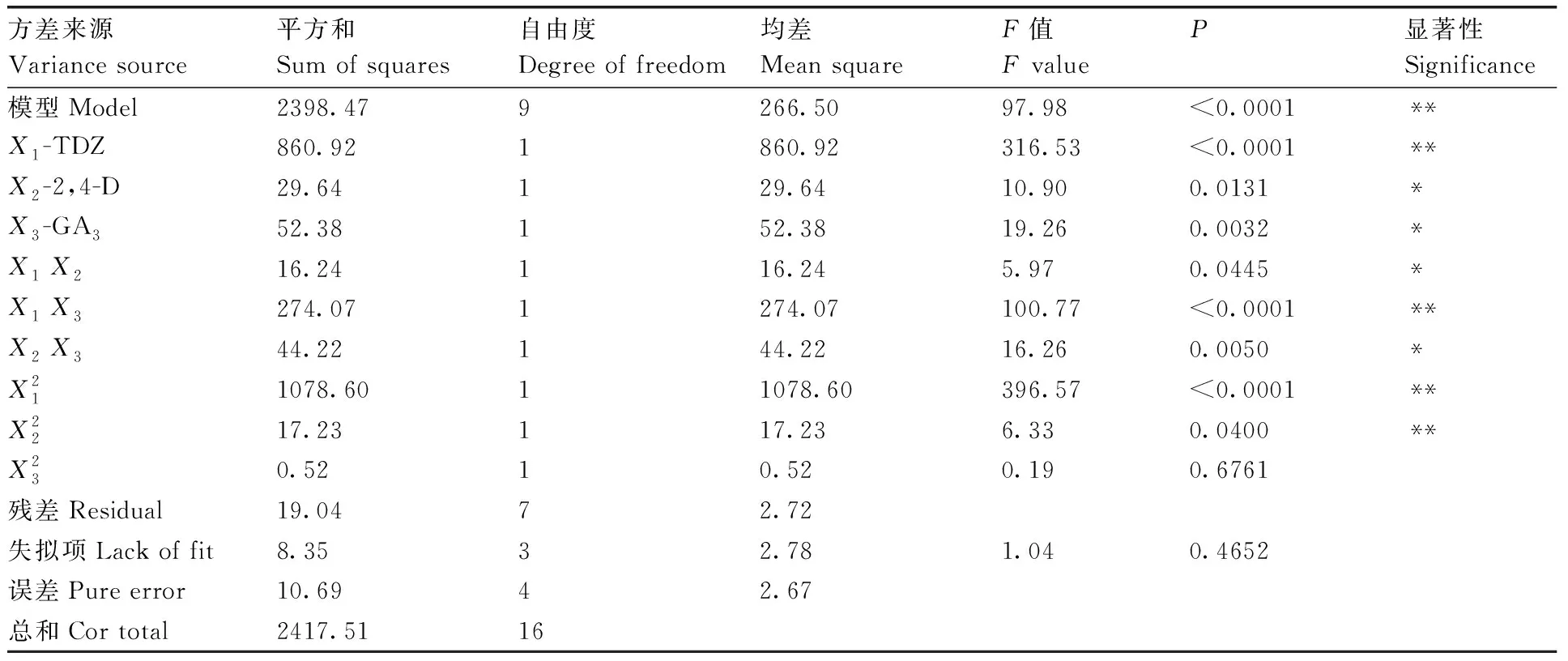
方差来源Variance source平方和Sum of squares自由度Degree of freedom均差Mean squareF值F valueP显著性Significance模型Model2398.479266.5097.98<0.0001**X1-TDZ860.921860.92316.53<0.0001**X2-2,4-D29.64129.6410.900.0131*X3-GA352.38152.3819.260.0032*X1 X216.24116.245.970.0445*X1 X3274.071274.07100.77<0.0001**X2 X344.22144.2216.260.0050*X211078.6011078.60396.57<0.0001**X2217.23117.236.330.0400**X230.5210.520.190.6761残差Residual19.0472.72失拟项Lack of fit8.3532.781.040.4652误差Pure error10.6942.67总和Cor total2417.5116
*和**分别表示显著(P<0.05)、极显著(P<0.01)水平。
* and **represented significance at the level of 0.05 and 0.01,respectively.

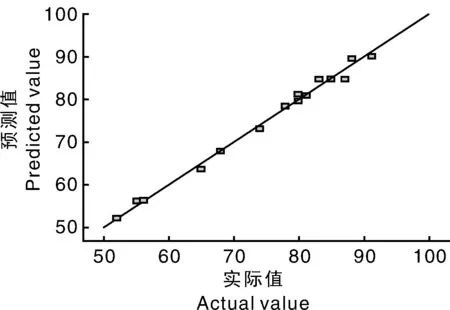
图2 测量与预测的出芽率之间的线性相关图Fig.2 Linear correlation plot between shoot regeneration ratio of measured value vs.predicted value
2.2.3 响应面和等高线
为了分析TDZ、2,4-D、GA3对马铃薯茎段愈伤组织再生出芽效率的影响,根据回归方程做出各因素对Y的响应面和等高线,考察拟合响应曲面的形状(图4)。从响应面的坡度变化及等高线的形状可分析各因素的交互作用:若等高线的形状为椭圆形表示因素间交互作用显著,圆形则表示因素间交互作用可忽略不计[10],同时响应面坡度相对平缓表示响应值不敏感;反之,则敏感。

图3 TDZ、2,4-D、GA3三者与愈伤组织出芽率的摄动关系图Fig.3 Perturbation of TDZ(X1),2,4-D(X2) and GA3(X3) on callus shoot regeneration ratio
由图4可以看出,TDZ和2,4-D,TDZ和GA3的交互作用显著,2,4-D和GA3交互作用较小。因此,TDZ在培养基中的浓度变化对马铃薯愈伤组织出芽很敏感,而2,4-D、GA3相对不敏感,其敏感性TDZ>GA3>2,4-D。
2.2.4 最佳激素浓度配比及验证
在MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3最佳激素配比下,马铃薯茎段愈伤组织的理论出芽率为91.52%。在此激素条件下,实际测得的平均出芽率为91.50%,与预测值基本一致,证实了该模型的有效性。分化培养14d左右,其中一些愈伤组织表面出现瘤状颗粒,结构松散、质地紧密,20d在OLYMPUS SZX7体视显微镜下观察,可以看到愈伤组织瘤状突起处有胚芽形成,30d肉眼可观察到明显的丛生芽,40d芽越来越多,60d丛生芽生长旺盛。
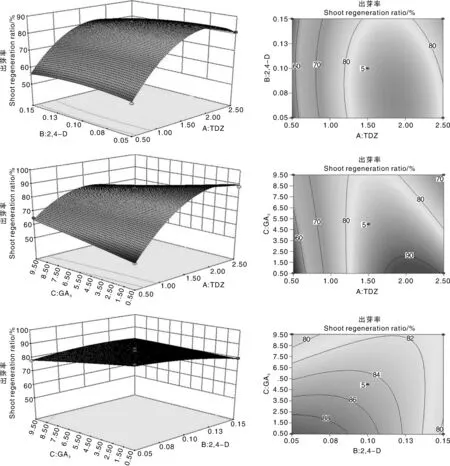
图4 愈伤组织出芽率随TDZ(A)、2,4-D(B)和GA3(C)变化的响应面图及对应的等高线图Fig.4 Response surface and contour map for effects of TDZ(A),2,4-D(B) and GA3(C) on callus shoot regeneration ratio
接于MS上的芽,14d再生植株生长良好,根系粗壮(图5)。

图5 丛生芽诱导(A-F)与再生植株的生根培养(G-I)Fig.5 Multiple-shoot inducement(A-F) and regeneration rooting culture plants(G-I)
3 讨论
响应面分析法是一种试验次数少、周期短、回归方程精度高,能研究几种因素间交互作用的回归分析方法[11]。相对于传统的数理统计方法,响应面分析法求得的各参数组合更加精确,可以大大降低生产实践过程中造成的原料浪费。愈伤组织分化培养的效果,需要综合考虑多方面因素,诸如生长情况,是否出现退化、变色、硬化、出芽等问题。由于在进行响应面法设计时,需要以定量值作为衡量指标,定性指标的标准不好确定,因此,以出芽长度>0.5cm的愈伤组织数统计出芽率,作为响应值。
从响应面和等高线可以看出,不同浓度TDZ、2,4-D、GA3对愈伤组织出芽率的影响不同,敏感性TDZ>GA3>2,4-D。研究不同浓度的激素组合对愈伤组织丛生芽诱导率的影响,以往在马铃薯组织培养中的芽诱导主要应用的细胞分裂素是6-BA[1]、玉米素(trans-zeatin)[12]、激动素(kinetin,KT)[2]。在葱[13]、土党参[14]等植物愈伤组织再生体系中运用TDZ效果显著,因此本实验中引用了TDZ代替6-BA。TDZ是一类人工合成的苯基脲衍生物,具有强烈的细胞活性,其活性远远超过玉米素、6-BA、激动素KT和异戊烯腺嘌呤(Zip),能诱导外植体从愈伤组织形成到体细胞胚胎发生的一系列过程,具有生长素和细胞分裂素双重作用的特殊功能[15-16]。Elaleem等[17]研究马铃薯愈伤芽分化时认为MS+5.00mg·L-1TDZ出芽率高达81%。而本研究结果表明,使用较高浓度的TDZ对丛生芽诱导时间、丛生芽诱导率、出芽数均有较为显著的作用,而当TDZ浓度超过2.02mg·L-1后,随着TDZ使用浓度的增加,愈伤组织的丛生芽诱导率及出芽数降低。这表明对TDZ形成具再生能力的致密型愈伤组织影响最大,当超过一定浓度后,TDZ的添加量与指标体系之间存在负相关性。可能由于马铃薯品种的基因型不同,其内源激素有差异,导致本研究中的TDZ最佳浓度有别于前人的研究结果。
GA3能刺激细胞分裂和伸长,对芽的分化有明显促进作用[18]。研究结果表明,GA3在马铃薯茎段愈伤不定芽分化中均具有一定的影响,这与Ghosh等[19]在马铃薯叶片愈伤不定芽分化中的研究结果一致。Kumlay等[20]研究认为,低浓度的GA3有利于马铃薯愈伤组织芽分化。在本研究中GA3浓度较高,但当浓度大于5mg·L-1时,会导致芽茎杆细,移植的苗不健壮,且不容易成活。2,4-D是诱导马铃薯愈伤组织的关键激素之一,在一定浓度范围内,浓度的增加对诱导大部分植物的胚性愈伤具有良好效果[21],但过高或过低的2,4-D浓度均不利于胚性愈伤组织的形成和分化[22]。本研究发现,2,4-D对芽的分化有抑制作用,且愈伤组织出芽率随着2,4-D浓度的增加而逐渐降低。浓度过高会产生白色愈伤组织,质地紧致且芽分化困难,这与大多数人研究认为高浓度2,4-D能诱导生长势旺盛的愈伤组织,但不定芽的分化率相对较低的结果相似。
马铃薯愈伤组织表面形状与颜色、质地疏松与否,与其形态器官的再生能力有明显关系。本研究表明,只有颜色呈绿色或黄绿色、表面凹凸明显、结构疏松的马铃薯茎段愈伤组织,才具有较强形态器官的再分化能力与较强的植株再生能力。TDZ对马铃薯愈伤组织芽分化起着关键作用,与Dokhaniyeh等[23]研究结果相一致。本实验中马铃薯茎段愈伤组织脱分化后形成的愈伤组织在相对低浓度的2,4-D(0.08mg·L-1)与相对高浓度的TDZ(2.02mg·L-1)及GA3(2.25mg·L-1)作用下,再分化芽能力最强,平均出芽率与模型预测值基本一致。表明在生长素的添加量适宜的前提下,适当提高细胞分裂素和赤霉素的添加量有利于组培苗形态器官的再分化。后期实验将进一步研究响应法运用应综合考虑衡量愈伤组织生长好坏的其他指标。
:
[1] 黄萍,马朝宏,颜谦.特色马铃薯品种红宝石再生系统的筛选[J].天津农业科学,2017,23(2):16-19.
HUANG P,MA C H,YAN Q.Screening of regenerated system of characteristic potato variety ‘Hongbaoshi’[J].TianjinAgriculturalSciences,2017,23(2):16-19.(in Chinese with English abstract)
[2] 陈晓艳,孟亚雄,贾小霞,等.马铃薯品种‘陇薯11号’再生体系的构建[J].中国马铃薯,2016,30(2):65-69.
CHEN X Y,MENG Y X,JIA X X,et al.Construction of regeneration system for potato variety ‘Longshu 11’[J].JournalofChinesePotato,2016,30(2):65-69.(in Chinese with English abstract)
[3] 许俊洁,卢金清,万丽娟,等.响应面法优化罗麦颗粒成型工艺的研究[J].中国药师.2016,19(9):1665-1669.
XU J J,LU J Q,WAN L J,et al.Optimization of forming process of luomai granules by response surface methodology[J].ChinaPharmacist,2016,19(9):1665-1669.(in Chinese with English abstract)
[4] NEKOUEI F,NEKOUEI S.Comparative study of photocatalytic activities of Zn5(OH)8Cl2·H2O and ZnO nanostructures in ciprofloxacin degradation:response surface methodology and kinetic studies[J].ScienceoftheTotalEnvironment,2017,601/602:508-517.
[5] BEN A A,MOKNI A,YAICH H,et al.Technological properties of milk gels produced by chymosin and wild cardoon rennet optimized by response surface methodology[J].FoodChemistry,2017,237:150-158.
[6] ABBASI Z,HOOSHYAR S,BAGHERIEH N M B.Improvement of callus production and shoot regeneration using various organs of soybean(GlycinemaxL.Merr) by response surface methodology[J].InVitroCellular&DevelopmentalBiology-Plant,2016,52(5):537-545.
[7] BAGHERIEH N M B,NEZAMDOOST T.Optimization of shikonin production inOnosmadichroanthacallus using response surface methodology[J].PlantCell,TissueandOrganCulture,2016,126(3):399-409.
[8] 汤云川,陈涛,梁远发,等.成都平原马铃薯品种比较试验[J].四川农业科技,2017(6):10-13.
TANG Y C,CHEN T,LIANG Y F,et al.Comparison test of potato varieties in Chengdu plain[J].SichuanAgriculturalScienceandTechnology,2017(6):10-13.(in Chinese)
[9] 梁远发,倪苏,蒋馨,等.高干中早熟马铃薯新品种“川芋10号”的创新培育[J].中国马铃薯,2008,22(1):63.
LIANG Y F,NI S,JIANG X,et al.Innovative cultivation of the new potato variety Chuanyu No.10 in the political precocious[J].JournalofChinesePotato,2008,22(1):63.(in Chinese)
[10] 黄玉兰,殷奎德,岳才军.黄瓜愈伤组织继代培养中激素浓度组合的优化[J].激光生物学报,2014,23(1):83-89.
HUANG Y L,YIN K D,YUE C J.Optimum combination of hormone concentration during callus subculture of cucumber[J].ActaLaserBiologySinica,2014,23(1):83-89.(in Chinese with English abstract)
[11] OBEROI D P S,SOQI D S.Utilization of watermelon pulp for lycopene extraction by response surface methodology[J].FoodChemistry,2017,232:316-321.
[12] ABBASI A Z,BILAL M,HUSSAIN J,et al.Robust regeneration protocol for theAgrobacteriumtumefaciensmediated transformation ofSolanumtuberosum[J].PakistanJournalofBotany,2016,48(2):707-712.
[13] FARHADI N,PANAHANDEH J,AZAR A M,et al.Effects of explant type,growth regulators and light intensity on callus induction and plant regeneration in four ecotypes of Persian shallot(Alliumhirtifolium)[J].ScientiaHorticulturae,2017,218:80-86.
[14] 戚甫友,范伟军,胡秀,等.土党参茎段的愈伤组织诱导与植株再生[J].浙江农业学报.2017,29(8):1313-1320.
QI F Y,FAN W J,HU X,et al.Callus induction and plant regeneration from stem explants ofCampanumoeajavanicaB1[J].ActaAgriculturaeZhejiangensis,2017,29(8):1313-1320.(in Chinese with English abstract)
[15] 徐晓峰,黄学林.TDZ:一种有效的植物生长调节剂[J].植物学通报,2003,20(2):227-237.
XU X F,HUANG X L.TDZ:an efficacious plant growth regulator[J].ChineseBulletinofBotany,2003,20(2):227-237.(in Chinese with English abstract)
[16] 崔海兰,朱延明,齐洋.Thidiazuron等植物生长调节剂对水稻(OryzasativaL.) 愈伤组织不定芽分化的影响[J].东北农业大学学报,2003,34(1):72-76.
CUI H L,ZHU Y M,QI Y.Effect of Thidiazuron on rice(OryzasativaL.) callus organogenesis[J].JournalofNortheastAgriculturalUniversity,2003,34(1):72-76.(in Chinese with English abstract)
[17] ELALEEM K G A,MODAWI R S,KHALAFALLA M M.Effect of plant growth regulators on callus induction and plant regeneration in tuber segment culture of potato(SolanumtuberosumL.) cultivar Diamant[J].AfricanJournalofBiotechnology,2009,8(11):2529-2534.
[18] 方贯娜,庞淑敏.马铃薯愈伤组织再生体系的研究进展[J].中国马铃薯,2012(5):307-310.
FANG G N,PANG S M.Research progress on callus regeneration system of potato[J].JournalofChinesePotato,2012(5):307-310.(in Chinese)
[19] GHOSH S,MAJUMDAR S,SARKAR D,et al.An efficient adventitious shoot regeneration system for potato(SolanumtuberosumL.) using leaf discs[J].JournalofPlantBiochemistry&Biotechnology,2015,24(3):298-304.
[20] KUMLAY A M,ERCISLI S.Callus induction,shoot proliferation and root regeneration of potato(SolanumtuberosumL.) stem node and leaf explants under long-day conditions[J].Biotechnology&BiotechnologicalEquipment,2015,29(6):1075-1084.
[21] 袁雪,钟雄辉,李晓昕,等.铁炮百合的胚性愈伤组织诱导和植株再生[J].核农学报,2012,26(3):454-460.
YUAN X,ZHONG X H,LI X X,et al.Embryonic callus induction and plant regeneration ofLiliumlongiflorum[J].JournalofNuclearAgriculturalSciences,2012,26(3):454-460.(in Chinese with English abstract)
[22] 苗博瑛,刘艳军,杨静慧.黑莓松散型胚性愈伤组织的诱导[J].山西农业科学,2014,42(3):209-212.
MIAO B Y,LIU Y J,YANG J H.Study on the induction method of blackberry friable embryogenic callus[J].JournalofShanxiAgriculturalSciences,2014,42(3):209-212.(in Chinese with English abstract)
[23] DOKHANIYEH A Y,KOHNEHROUZ B B,MOUSAVI A,et al.Rapid and high efficiency regeneration from potato(SolanumtuberosumL.) using thidiazuron as cytokinin source[J].JournalofFoodAgriculture&Environment,2011,9(3):613-617.
Optimizationofefficientregenerationsysteminstemofpotatousingresponsesurfacemethodology
JIANG Linjuan1,ZOU Xue1,HUANG Xueli1,NI Su1,LI Liqin1,YANG Shimin1,2,*
(1.CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu611130,China;2.NationalDemonstrationCenterforExperimentalCropScienceEducation,SichuanAgriculturalUniversity,Chengdu611130,China)
Abstract:To establish the optimal hormone concentrations of culture medium for efficient regeneration of potato stem callus tissue,as well as build a new system for tissue culture and rapid propagation technology,stem of Chuanyu No.10 was employed as explants to induce callus tissue,and the Box-Behnken design method of response surface methodology(RSM) was used to research the effect of TDZ,2,4-D and GA3on the differentiation of potato callus.Meanwhile,the hormone concentrations were optimized.The results showed that the sensitivity of the hormone concentrations in culture medium to potato callus budding from the response surface method optimization model is TDZ>GA3>2,4-D.The determination conefficientR2of the model was 0.992 1,the optimal medium for adventitious bud differentiation from stem callus of Chuanyu No.10 was MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3.In this condition,the budding rate was actual measured,which was consistent with the predicted values.That confirmed the validity of the model.
Key words:potato;callus;response surface method;medium
中图分类号:S532
A
文章编号:1004-1524(2018)06-0918-08
收稿日期:2017-09-04
基金项目:四川省科技创新苗子工程(2015120);国家重点研发计划子课题(2016YFD0300908-03)
作者简介:江林娟(1985—),女,浙江嘉善人,硕士研究生,主要从事植物组织培养及遗传育种研究。E-mail:juan498@163.com
,杨世民,E-mail:yangshimin1@163.com
10.3969/j.issn.1004-1524.2018.06.05
(责任编辑张 韵)

