CYP3A5通过影响cyclin D1蛋白表达水平促进胰腺癌细胞增殖
朱建伟 孔祥毓 孔凡扬 朱惠云 安薇 吴洪玉 李兆申 金震东
细胞色素450(cytochrome 450,CYP450)是一大类广泛存在的含有一个铁原卟啉Ⅸ血红素的蛋白,与化疗药物耐药及肿瘤的发生发展相关[1]。CYP3A5是CYP450酶超家族中的一员,多篇研究发现CYP3A5多态性与肿瘤易感性及药物代谢相关[2-4],然而对于CYP3A5在肿瘤发生发展中的作用及其机制研究较少。此外,CYP3A5在不同肿瘤中的作用也不同,它在前列腺癌中表现为癌基因,促进肿瘤细胞增殖[5];在肝癌细胞中则表现为抑癌基因,抑制肝癌细胞的转移[6];在胰腺癌中可诱导胰腺癌细胞耐药[7]。本课题组通过对Oncomine数据库检索,发现CYP3A5在胰腺导管腺癌组织中表达增高,提示其可能为癌基因,为此本研究观察CYP3A5基因表达量的变化对胰腺癌细胞增殖的影响,探讨其潜在机制。
材料与方法
一、细胞培养及选择
胰腺癌细胞系BxPC-3、FG、MDA28、8902、PANC1均购于中国医学科学院上海细胞所,常规培养、传代。采用蛋白质印迹法检测5株胰腺癌细胞系CYP3A5蛋白表达量,选取CYP3A5表达较高及较低的2株细胞系用于后续的实验研究。
二、靶向CYP3A5的过表达质粒或siRNA转染及验证
取对数生长期细胞接种于6孔板,使细胞铺满各孔面积的50%,置培养箱中培养24 h,采用Lipofectamine2000转染试剂将靶向CYP3A5的过表达质粒(pLenti-h-CYP3A5-V5-Blast)转染PANC1细胞,以空载质粒(pLenti-CMV-V5-Blast)转染作为对照,质粒购于上海亚载生物公司。将3条靶向CYP3A5的siRNA(siRNA-CYP3A5)转染BxPC-3细胞,以转染不针对任何靶基因的非特异性siRNA(siRNA-NC)作为对照。3条siRNA-CYP3A5购自Sigma公司,序列分别为5′-CCUUGAAAUUAGACACGCATT-3′、 5′-GAGUUAUUCUAAGGAUUUCUACUTT-3′、5′-GGAAGAGAAUACGGUCAUUTT-3′。siRNA-NC序列为5′-UUCUCACCGCGAAUGUCGUTT-3′。以抑制效率最佳的siRNA用于后续实验。
三、胰腺癌细胞增殖能力的检测
1.增殖实验:分别取对数生长期转染CYP3A5过表达质粒、空载质粒的PANC1细胞以及转染siRNA-CYP3A5、siRNA-NC的BxPC-3细胞(2 000个/100 μl)接种96孔板,培养12 h待细胞贴壁后分别培养24、48、72 h,每个时间点设5个复孔。培养到时间点时每孔加入10 μl CCK-8继续培养1 h,上酶标仪测定各孔在波长为450 nm处的吸光度值(A450值),取均值。
2.克隆形成实验:取上述各组对数生长期细胞接种于6孔板,每孔2 ml培养液,500个细胞,置培养箱培养2周,每隔3 d换培养液,培养结束后加入甲醇固定细胞30 min,加入2 ml 0.1%的结晶紫染色1 h,吸出结晶紫,空气干燥后用肉眼计数细胞克隆数,计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
四、胰腺癌细胞CYP3A5、cyclin D1、Bcl-2及cyclin E的蛋白表达检测
使用RIPA缓冲液提取细胞总蛋白,BCA法定量蛋白后常规行蛋白质印迹法检测蛋白表达,以α-tublin、actin作为内参。兔抗人CYP3A5、cyclin D1、Bcl-2抗体均以1∶1 000稀释,羊抗兔二抗1∶2 000稀释,鼠抗人cyclin E 1∶1 000稀释,羊抗鼠二抗1∶2 000稀释。最后使用ECL显示免疫反应性条带,应用Image J软件扫描。以目的条带与内参条带灰度值比表示蛋白相对表达量,且将空载质粒转染或siRNA-NC转染细胞的蛋白相对表达量标化为1。CYP3A5抗体购于Proteintech公司,cyclin D1抗体购于Cell signaling technology公司,Bcl-2及cyclin E抗体购于Santa cruze公司。二抗购于西塘生物有限公司。
五、胰腺癌细胞cyclin D1 mRNA表达量检测
采用Trizol试剂(Invitrogen公司)提取细胞总RNA。使用反转录试剂盒反转录成cDNA,上SYBR Green仪行实时定量PCR。PCR反应条件:94℃ 2 min,94℃ 30 s、50℃ 30 s、72℃ 30 s,40个循环,以GAPDH作为内参。cyclin D1正义序列为5′-CCG-CCTCACACGCTTCCTCTC-3′,反义序列为5′-TCC-TCCTCGGCGGCCTTGGGG-3′;GAPDH正义序列为5′-TGCACCACCAACTGCTTA-3′,反义序列为5′-GGCATGGACTGTGGTCATGAC-3′。引物由捷瑞公司合成。经PCR仪自带软件获取产物Ct值,通过2-ΔΔCT公式计算mRNA相对表达量,且将空载质粒转染或siRNA-NC转染细胞的mRNA表达量标化为1。
六、统计学处理
结 果
一、实验细胞株的筛选及鉴定
BxPC-3、FG、MDA28、8902、PANC1 5株胰腺癌细胞的CYP3A5蛋白表达量分别为0.90、0.72、0.74、0.56、0.52,BxPC-3细胞的CYP3A5蛋白表达量最高,PANC1细胞的表达量最低(图1),因此选取上述2株细胞系行下一步实验研究。
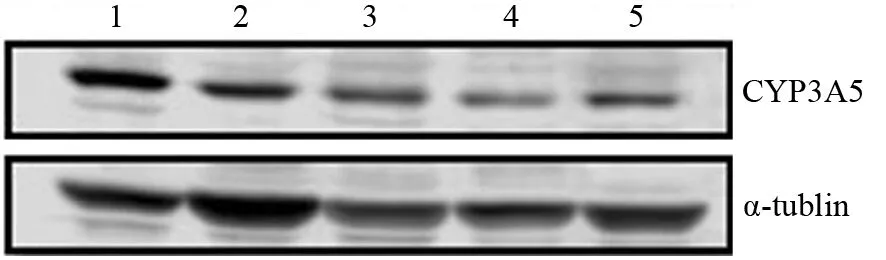
图1 胰腺癌细胞株BxPC-3(1)、FG(2)、MDA28(3)、8902(4)、PANC1(5)的CYP3A5蛋白表达
CYP3A5过表达组、空载质粒组PANC1细胞的CYP3A5蛋白表达量分别为1.66±0.14、1.00,过表达组显著高于空载质粒组,差异有统计学意义(t=7.1,P=0.0021,图2)。
3个siRNA-CYP3A5转染组的BxPC-3细胞CYP3A5蛋白表达量分别为0.44±0.032、0.38±0.037、0.18±0.02,较siRNA-NC转染组的1.00显著下调,差异均有统计学意义(t值分别为15.64、16.62、24.05,P值均<0.0001)。因siRNA3-CYP3A5的抑制效率最佳,因此选取siRNA3用于后续研究(图2)。
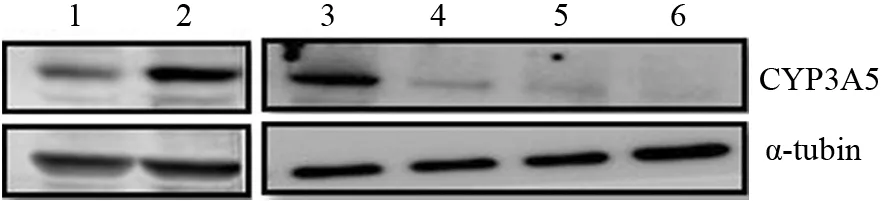
图2 空载质粒组(1)、CYP3A5过表达组(2)PANC1细胞及siRNA-NC组(3)、3个siRNA-CYP3A5组(4~6)BxPC-3细胞的CYP3A5蛋白表达
二、上调CYP3A5表达促进胰腺癌细胞增殖
CYP3A5过表达组与空载质粒组PANC1细胞培养24、48、72 h的A450值分别为0.73±0.05与0.71±0.05、1.36±0.05与1.15±0.03、2.10±0.09与1.42±0.03,过表达组48、72 h时的A450值显著高于空载质粒组,差异均有统计学意义(t=3.62,P=0.0067;t=6.92,P=0.0001)。
siRNA-CYP3A5转染组与siRNA-NC转染组BxPC-3细胞培养24、48、72 h 的A450值比较分别为0.44±0.03比0.45±0.02、0.62±0.01比0.77±0.03、0.83±0.01比1.18±0.02,siRNA-CYP3A5转染组48、72 h时的A450值显著低于siRNA-NC转染组,差异均有统计学意义(t=3.5,P=0.0085;t=14.54,P<0.0001)。
过表达组PANC1细胞克隆形成率为(19.33±0.58)%,显著高于空载质粒组的(9.67±0.63)%,差异有统计学意义(t=11.22,P=0.0004);CYP3A5-siRNA组克隆形成率为(8.5±0.8)%,显著低于siRNA-NC组的(16.0±0.6)%,差异有统计学意义(t=7.35,P=0.0018,图3)。
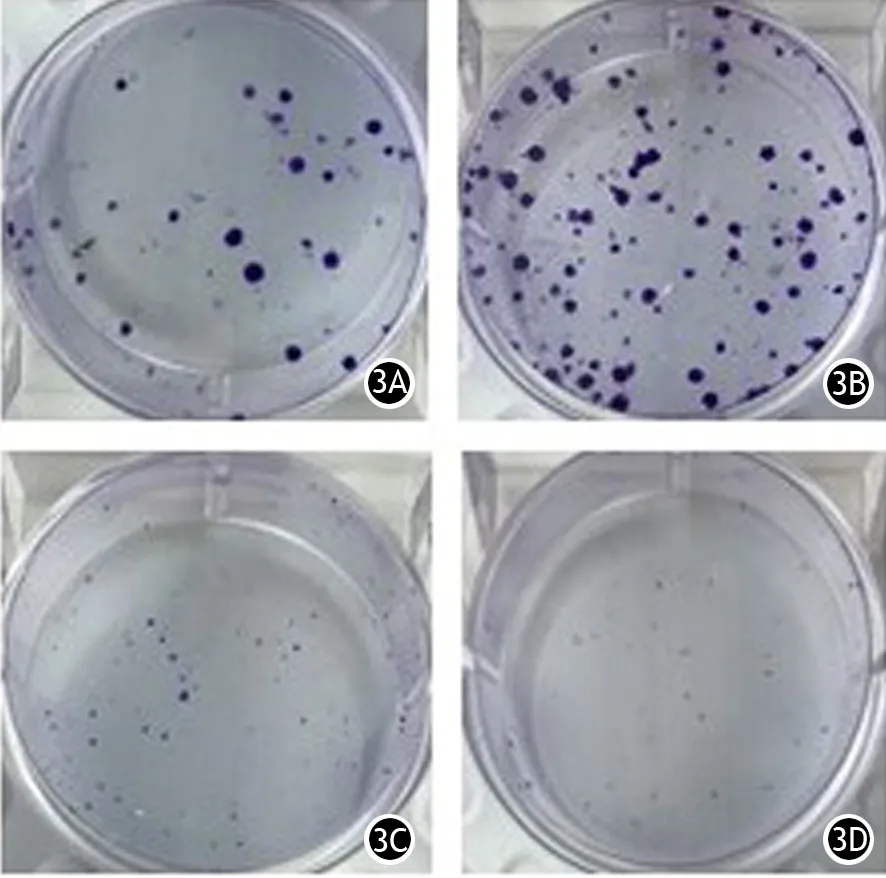
图3 空载质粒组(3A)、CYP3A5过表达组(3B)PANC1细胞及siRNA-NC组(3C)、siRNA-CYP3A5组(3D)BxPC-3细胞的克隆形成
三、CYP3A5通过上调cyclin D1蛋白表达促进胰腺癌细胞增殖
过表达组PANC1细胞cyclin D1蛋白表达量为2.00±0.11,显著高于空载质粒组的1.00,差异有统计学意义(t=8.043,P=0.0013),而cyclin D1 mRNA表达量为1.06±0.01,与空载质粒组的差异无统计学意义;siRNA-CYP3A5组BxPC-3细胞cyclin D1蛋白表达为0.45±0.04,显著低于siRNA-NC组的1.00,差异有统计学意义(t=11.95,P=0.0003),而cyclin D1 mRNA表达量为1.09±0.03,与siRNA-NC组的差异无统计学意义(图4)。此外,过表达组PANC1细胞或siRNA-CYP3A5转染组BxPC-3细胞的cyclin E及Bcl-2蛋白及mRNA表达量与各自对照组的差异无统计学意义。提示上调或抑制CYP3A5表达仅在蛋白层面调节cyclin D1基因,进而促进胰腺癌细胞的增殖。
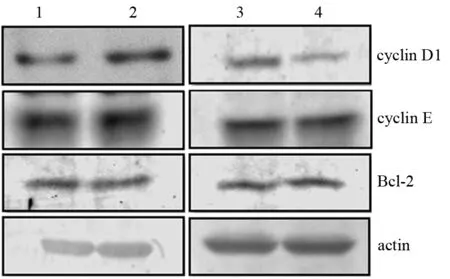
图4 空载质粒组(1)、CYP3A5过表达组(2)PANC1细胞及siRNA-NC组(3)、siRNA-CYP3A5组(4)BxPC-3细胞cyclin D1、cyclin E及Bcl-2蛋白的表达
讨 论
前期对CYP3A5的研究主要集中于该基因与获得性耐药、基因多态性、外源性或内源性基因的代谢及致癌物代谢之间的关系,表明CYP3A5的多态性与癌症风险或肿瘤获得性耐药相关。
本课题组通过生物信息学方法对Oncomine数据库中的数据进行统计学分析,发现胰腺癌组织CYP3A5 mRNA表达量上调,提示CYP3A5在胰腺癌中可能发挥促进肿瘤发生发展的作用。为了进一步明确其作用,本研究通过RNA干扰技术对高表达CYP3A5的BxPC-3进行siRNA转染以抑制CYP3A5表达,而通过CYP3A5过表达质粒对低表达CYP3A5的PANC1细胞进行转染以过表达CYP3A5。通过CCK-8法及克隆形成实验观察胰腺癌细胞的增殖。结果显示,抑制CYP3A5表达能抑制胰腺癌细胞的增殖,CYP3A5过表达能加快胰腺癌的增殖,表明CYP3A5作为癌基因在胰腺癌中发挥促进肿瘤细胞增殖的作用。
肿瘤细胞增殖加快主要表现在其细胞周期失调和凋亡减少。cyclin D1是细胞周期G1期重要的正向调控基因,在多种肿瘤细胞高表达,参与肿瘤的发生及发展,且其过表达与肿瘤转移及患者生存期缩短密切相关[8-10]。本研究结果显示,过表达CYP3A5蛋白可上调cyclin D1蛋白表达,而抑制CYP3A5蛋白表达可下调cyclin D1蛋白表达,但均不影响CYP3A5 mRNA 的表达,推测CYP3A5蛋白是在转录后层面影响cyclin D1蛋白表达,进而促进胰腺癌细胞的增殖。
参 考 文 献
[1] Bruno RD, Njar VC. Targeting cytochrome P450 enzymes: a new approach in anti-cancer drug development[J]. Bioorg Med Chem, 2007, 15(15): 5047-5060. DOI:10.1016/j.bmc.2007.05.046.
[2] Diekstra MH, Swen JJ, Boven E, et al. CYP3A5 and ABCB1 polymorphisms as predictors for sunitinib outcome in metastatic renal cell carcinoma[J]. Eur Urol, 2015, 68(4): 621-629. DOI: 10.1016/j.eururo.
[3] Yeh KT, Chen JC, Chen CM, et al. CYP3A5*1 is an inhibitory factor for lung cancer in Taiwanese[J]. Kaohsiung J Med Sci, 2003, 19(5): 201-207.DOI:10.1016/S1607-551X(09)70425-5.
[4] Zhenhua L, Tsuchiya N, Narita S, et al. CYP3A5 gene polymorphism and risk of prostate cancer in a Japanese population[J]. Cancer Lett, 2005, 225(2): 237-243.DOI:10.1016/j.canlet.2005.03.009.
[5] Mitra R, Goodman OB, Jr. CYP3A5 regulates prostate cancer cell growth by facilitating nuclear translocation of AR[J]. Prostate, 2015, 75(5): 527-538. DOI: 10.1002/pros.22940.
[6] Jiang F, Chen L, Yang YC, et al. CYP3A5 functions as a tumor suppressor in hepatocellular carcinoma by regulating mTORC2/Akt signaling[J]. Cancer Res, 2015, 75(7): 1470-1481. DOI: 10.1158/0008-5472.
[7] Noll EM, Eisen C, Stenzinger A, et al. CYP3A5 mediates basal and acquired therapy resistance in different subtypes of pancreatic ductal adenocarcinoma[J]. Nat Med, 2016,22(3):278-287. DOI: 10.1038/nm.4038.
[8] Diehl JA. Cycling to cancer with cyclin D1[J]. Cancer Biol Ther, 2002, 1(3): 226-231.
[9] Jares P, Colomer D, Campo E. Genetic and molecular pathogenesis of mantle cell lymphoma: perspectives for new targeted therapeutics[J]. Nat Rev Cancer, 2007, 7(10): 750-762.
[10] Thomas GR, Nadiminti H, Regalado J. Molecular predictors of clinical outcome in patients with head and neck squamous cell carcinoma[J]. Int J Exp Pathol, 2005, 86(6): 347-363.DOI:10.1111/j.0959-9673.2005.00447.x.
——一道江苏高考题的奥秘解读和拓展

