实时超声造影术鉴别诊断胰腺局灶性病变的临床价值及其血流动力学特征
胡琴 董磊 沈晓青 樊胜华
胰腺局灶性病变是临床常见的疾病,但影像学检查难以发现直径2 cm以下病灶,且恶性病发展迅速,预后较差[1]。胰腺局灶性病变的常规检查手段包括超声、CT、MRI等,但敏感性较低,且对病变性质的鉴别有一定难度,往往需依靠手术或病理学检查确诊[2]。近年来实时灰阶超声造影(conrust-enhanced ultrasound, CEUS)愈发受到临床重视,它能够实时、连续、动态地观察病灶的血流灌注情况,反映组织器官的微循环,对胰腺局灶性病变具有一定的鉴别诊断能力[3-4]。本研究回顾性分析胰腺局灶性病变的CEUS及常规超声图像特征,探讨CEUS对胰腺局灶性病变性质鉴别价值及其血流动力学特征。
一、资料与方法
1.一般资料:回顾性分析2013年1月至2017年1月间浙江省绍兴市中医院收治的62例胰腺局灶性病变患者的临床资料。入组标准:(1)影像学检查均显示局灶性占位性病变,并经手术病理确诊;(2)年龄18~70岁;(3)排除严重出血,严重心、肝、肾功能障碍及无法耐受检查者。62例患者中男性37例,女性25例;年龄26~75岁,平均(47±5)岁。病灶部位:胰头35例,胰体9例,胰尾18例;病灶直径1.8~8.6 cm,平均(4.5±1.7)cm;良性病变30例(胰腺假性囊肿17例、囊腺瘤13例),恶性病变(胰腺癌)32例。
2.检查方法:采用GE Logiq E9型超声诊断仪,检查前禁食8 h以上。先行常规二维超声全面扫查胰腺,记录病灶的部位、大小、边界、形态、回声、血供及与周围组织的关系,再切换为实时灰阶造影成像模式,造影切面以病灶显示完全且不影响呼吸运动时为宜。将超声造影剂Sono Vue(Bracco公司,意大利)加入5 ml生理盐水充分振荡混匀,经肘前静脉快速团注,2.4 ml/次,再用5 ml生理盐水冲管,记录病灶及毗邻胰腺实质动态全程图像。胰腺CEUS增强时相分为3期,注入造影剂后0~30 s为血管期(VP),31~60 s为实质灌注早期(EPPP),61~120 s为实质灌注晚期(DPPP)。所有图像由两位富有经验的高年资超声科医师进行诊断。利用时间-强度曲线(TIC)软件获取不同病变性质的血流灌注参数,包括病灶始增时间、达峰时间、始减时间及峰值强度,并计算第一帧到最后一帧之间的区域曲线下面积。

二、 结果
1.胰腺局灶性病变的CEUS表现:良性病变CEUS表现为与周围胰腺组织均匀增强,增强程度与胰腺实质接近,边界清,外形规则,造影剂消退与胰腺实质同步。恶性病变CEUS表现为与周围胰腺组织不均匀增强,实质早期增强程度低于胰腺实质,囊壁可见乳头状增强灶,增强与消退较快,病灶形态不规则,边界不清。
2.不同病变性质病灶的血流动力学特征:与良性局灶性病变比较,恶性局灶性病变的CEUS始增时间、达峰时间显著延长,始减时间显著缩短,峰值强度及曲线下面积显著减小,差异均有统计学意义(P值均<0.05,表1)。
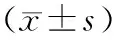
表1 良、恶性局灶性病变的血流动力学特征
3.常规超声和CEUS对局灶性病变性质的鉴别诊断价值: CEUS鉴别诊断胰腺局灶性病变性质的敏感性、特异性、准确性分别为84.4%(27/32)、100.0%(30/30)、91.9%(57/62),常规超声分别为56.3%(18/32)、100.0%(30/30)、77.4%(48/62)。CEUS的诊断敏感性及准确性均显著高于常规超声,差异均有统计学意义(χ2=6.06,P=0.014;χ2=5.03,P=0.025)。
讨论由于不同性质的胰腺肿瘤具有不同的组织学特点、恶变潜能及生物学行为,早期准确鉴别病变的良恶性是改善患者预后的唯一途径[5]。常规超声以其无创、无放射性、可重复、费用低廉等优势已成为胰腺病变首选的初筛手段,但受到胰腺位置、胃肠气体的影响,对较小的局灶性病灶可能无法显示,且只能获得胰腺形态结构方面的信息,而对胰腺及病灶的血流分布显示不清。近年来CEUS诊断胰腺疾病的相关报道已较多,但其对胰腺局灶性病变性质的鉴别诊断价值尚不十分明确[6-7]。
胰腺具有丰富的血液供应,各动脉间相互交错吻合形成众多微血管网,CEUS可清晰显示胰腺及肿瘤的微血管灌注,从而准确反映病灶性质。Hocke等[8]报道,胰腺恶性囊性病变的CEUS图像多表现为增强强度低于胰腺实质,增强时间晚于胰腺实质,强度分布不均匀,边界不清,形态不规则,造影剂消退时间早于胰腺实质,其主要原因是肿瘤组织的微血管少于正常胰腺组织,且血管紊乱,结构异常,致使造影剂分布不均、程度不一,易形成动静脉短路。胰腺良性病变多为不同程度的炎症递质浸润及间质纤维化,组织内部微血管分布与正常胰腺实质基本一致, CEUS多表现为接近于胰腺实质的等增强灶,造影剂消退亦与胰腺实质同步。此外,研究表明CEUS可显示直径<70 μm血管内的血流信号,提高低速、低流量的微血管检出率从而弥补常规超声的不足[9];CEUS可实现对造影剂进出病灶的全过程的实时观察,从而提供病灶内血流灌注的特征[10]。
本研究结果显示,胰腺良恶性局灶性病变CEUS的造影增强时相、增强模式及达峰速度等方面存在差异,恶性病变始增时间晚于胰腺实质,始减时间则提前,据此可作为诊断和鉴别诊断病变性质的客观依据,对胰腺良恶性病变诊断的敏感性、准确性均显著高于常规超声,说明CEUS鉴别诊断胰腺局灶性病变性质的能力较常规超声更具有优势。
参 考 文 献
[1] 郝冬兰,门永忠,刘伟,等.实时超声造影技术诊断胰腺局灶性病变的临床价值[J].中国超声医学杂志,2014,30(9):811-813.DOI:10.3969/j.issn.1002-0101.2014.09.016.
[2] 王燕,杨磊,候新华,等.胰腺局灶性病变超声造影表现[J].临床超声医学杂志,2015,17(5):323-325.
[3] 韩洁,吕珂,姜玉新.超声造影在胰腺疾病诊断中的应用现状与进展[J].中华医学超声杂志(电子版),2014,11(11):866-868.
[4] 安利香,韩洁,任彦斌,等.超声造影在胰腺疾病诊断中的应用[J].中国医药导报,2014,11(10):160-163.DOI:10.3877/cma.j.issn.1672-6448.2014.11.003.
[5] 陈艳春,黄丽萍,刘大铭,等.超声造影对胰腺癌诊断价值分析[J].医学信息,2015,12(12):156-156.DOI:10.3969/j.issn.1006-1959.2015.12.225.
[6] Kersting S,Roth J,Bunk A.Transabdominal contrast-enhanced ultrasonography of pancreatic cancer[J].Pancreatology,2011,11(Suppl 2): 20-27.DOI: 10.1159/000323480.
[7] 李雪晶,张睿,张修莉,等.超声造影在胰腺实质性病变诊断中的价值[J].齐齐哈尔医学院学报,2013,34(4):545-546.DOI:10.3969/j.issn.1002-1256.2013.04.053.
[8] Hocke M, Cui XW, Domagk D, et al. Pancreatic cystic lesions: The value of contrast-enhanced endoscopic ultrasound to influence the clinical pathway[J].Endosc Ultrasound, 2014, 3(2): 123-130.DOI: 10.4103/2303-9027.131040.
[9] Säftoiu A, Vilmann P, Bhutani MS, et al. The role of contrast-enhanced endoscopic ultrasound in pancreatic adenocarcinoma[J].Endosc Ultrasound,2016,5(6): 368-372.DOI: 10.4103/2303-9027.190932.
[10] 刘品兰,唐少珊.超声造影和增强CT诊断胰腺局灶性病变的Meta分析[J].中国医学影像技术,2011,27(11):2265-2269.

