34例胰腺导管内乳头状黏液性肿瘤临床病理特征分析
刘俊 张浩 徐鹿平 沈玉钰 谢琦 浒刘 周俊 王清清 俞清江
1982年日本学者Ohhashi等[1]首先报道了胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)。IPMN为起源于主胰管或分支胰管的上皮性肿瘤,可产生黏液导致胰管扩张。根据受累胰管的部位分为主胰管型、分支胰管型及混合型;根据肿瘤恶性程度分为低度、中度、高度异型增生及浸润性癌[2]。有研究指出[3-6],肿瘤大小、主胰管直径、血清肿瘤标志物水平、Ki67指数等与IPMN的良恶性有关。IPMN的恶性率为25.2%~46.5%[7-9]。鉴于良恶性IPMN的治疗原则及预后均不相同[10-12],术前良恶性的评估对IPMN的治疗具有重要意义。本研究分析34例IPMN的生物学特征及恶性危险因素,寻找术前预测IPMN良恶性及术后预测患者预后的指标,以期提高对该病的认识。
一、资料与方法
1.一般资料:收集嘉兴市第一医院及嘉兴市第二医院2013年1月至2016年12月间收治的经手术切除且病理证实的34例IPMN患者的临床病理资料,其中男性24例,女性10例;年龄35~84岁,中位年龄68岁。经病理科医师按WHO 1996年公布的IPMN诊断标准再次核实,分成主胰管型、分支胰管型和混合型3种病理类型;将高度异型增生及浸润性癌归为恶性组,低-中度异型增生归为良性组,排除既往或目前合并其他肿瘤者、术前接受过任何形式的抗肿瘤治疗者及临床病理资料不全者。
2.影像学指标:患者术前均行CT、MR、MRCP中的一种或两种以上检查(德国西门子64排螺旋CT,美国GE 3.0T或1.5T超导MR仪)。影像学指标包括肿瘤大小、主胰管直径及受累胰管分型。主胰管直径取最大径,肿瘤大小取单个肿瘤最大径。由两名医师分别读片及测量,取均值。
3.血清肿瘤标志物检测:采集术前空腹静脉血。肿瘤标志物(CA24-2、CA19-9、CEA)测定试剂盒购自德国罗氏公司,应用罗氏Cobas e601型全自动电化学发光免疫分析系统进行检测。
4.Ki67检测:Ki67表达检测采用免疫组织化学法。鼠抗人Ki67抗体(MIB-1)购自丹麦Dako公司。以PBS代替一抗作阴性对照,以已知阳性标本作阳性对照。Ki67阳性染色定位于细胞核,随机计数5个高倍视野,Ki67指数以阳性细胞数占总细胞数的百分比表示,取均值。

二、结果
1.良、恶性IPMN的临床病理特征:34例IPMN中肿瘤位于胰头15例,体尾部17例,全胰受累2例;低-中度异型增生18例,高度异型增生7例,浸润性癌9例;主胰管型12例,分支胰管型18例,混合型4例。良性组18例,恶性组16例,两组IPMN的主胰管直径、血清CA19-9水平及Ki67指数的差异有统计学意义(P值均<0.05),而年龄、性别、肿瘤大小、受累胰管分型、血清CA24-2及CEA水平差异无统计学意义(表1,图1、2)。
2.主胰管直径、血清CA19-9水平、 Ki67指数的ROC曲线:恶性组主胰管直径为(7.8±3.3)mm,良性组为(4.7±2.0)mm。ROC曲线(图3A)的AUC为0.807,最佳临界点为7.3 mm,鉴别良恶性的敏感性为56.3%,特异性为88.9%。
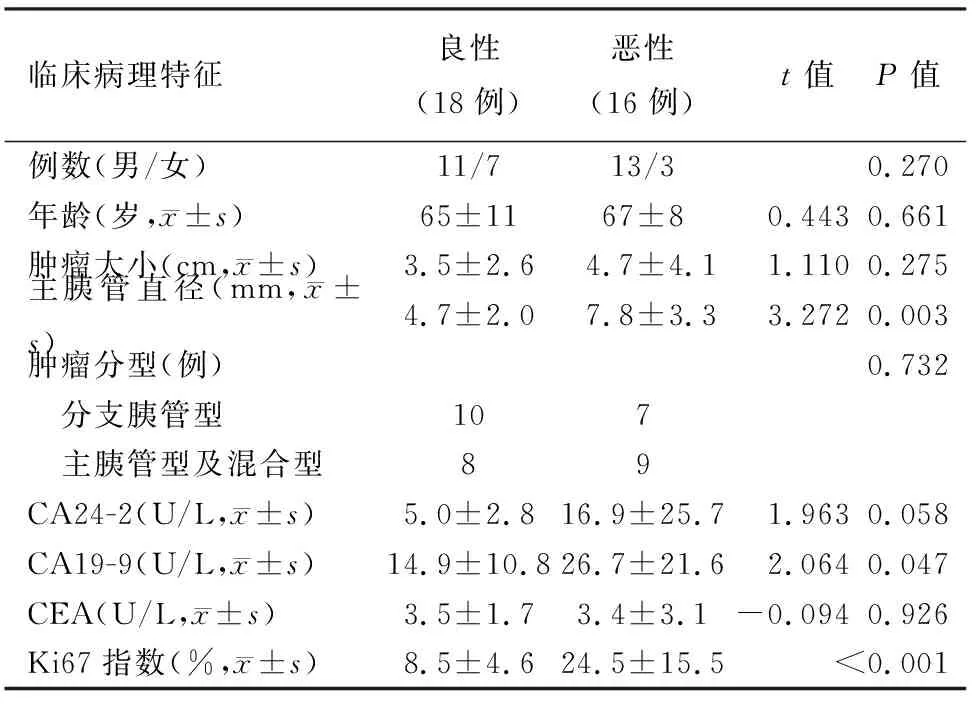
表1 34例IPMN患者临床病理特征与良恶性的关系
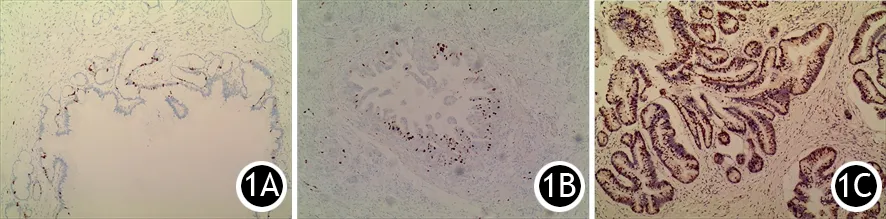
图1 低-中度异型增生(1A)、高度异型增生(1B)及浸润性癌(1C)的Ki67表达(免疫组化 ×100)
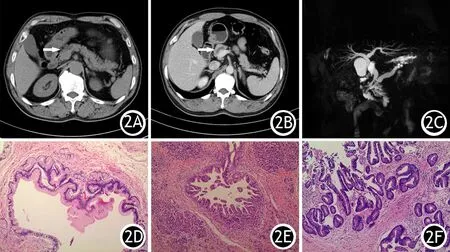
图2 3例IPMN患者的CT征象(2A~2C)及相应的病理变化(2D~2F,HE ×100)
恶性组血清CA19-9为(26.7±21.6)U/L,良性组为(14.9±10.8)U/L。ROC曲线(图3B)的AUC为0.672,最佳临界点为23.7 U/L,鉴别良恶性的敏感性为50%,特异性为88.9%。
恶性组Ki67指数为(24.5±15.5)%,良性组为(8.5±4.6)%。ROC曲线(图3C)的AUC为0.906,最佳临界点为12.2%,鉴别良恶性的敏感性为81.3%,特异性为83.3%。
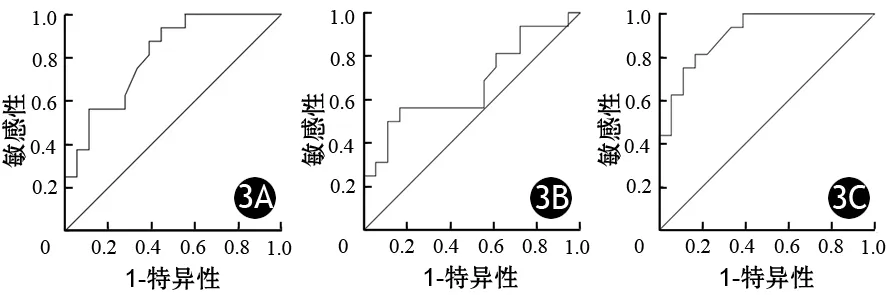
图3 主胰管直径(3A)、血清CA19-9水平(3B)及Ki67指数(3C)鉴别IPMN良恶性的ROC曲线
讨论近年来随着诊断技术及对IPMN认识的不断提高,有关IPMN的报道呈上升趋势。影像学技术为术前诊断IPMN的主要手段。2012年的福冈指南[10]推荐,对影像学检查怀疑IPMN的患者应进一步明确其是否符合“高风险因素”或“风险因素”的标准。“高风险因素”为恶性的参考指标,“风险因素”为可能恶性的参考指标,并以此指导临床治疗方案的选择。该指南将肿瘤直径≥3 cm、主胰管直径5~9 mm定为“风险因素”。 Crippa等[7]分析了389例IPMN患者的临床病理资料,结果显示主胰管型及混合型的恶性率高于分支胰管型。本研究结果显示主胰管直径≥7.3 mm对IPMN的良恶性鉴别有价值,而肿瘤直径及受累胰管分型对良恶性鉴别无统计学意义。内镜超声引导下细针穿刺细胞学检查(EUS-FNA)为近年来兴起的诊断方法,Suzuki等[13]报道,EUS-FNA对恶性IPMN诊断的敏感性和特异性分别为64.8%及90.6%,但具有可引起恶性肿瘤播散和不易推广等缺点。
本研究结果显示,鉴别良恶性IPMN的CA19-9最佳临界点为23.65 U/L,与You等[5]、Kim等[14]的结果一致。Ki67指数的高低被认为与多种肿瘤的分化程度、浸润、转移及预后密切相关。Takeshita等[6]、Mizumoto等[15]研究表明随着IPMN异型程度的增加,Ki67指数亦随之升高。Shimura等[16]将53例IPMN患者分为浸润性癌组及非浸润性癌组(低-高度异型增生),指出以Ki67指数15.5%为界,二组间的差异有统计学意义。本研究将低-中度异型增生归为良性组,高度异型增生归为恶性组,结果显示,以12.2%为界,Ki67指数对IPMN良恶性的鉴别有价值。Takeshita等[6]研究同时显示,低-中度异型增生、高度异型增生及浸润性癌患者术后5年生存率分别为100%、83.3%及53.8%,认为Ki67指数可作为术后预测IPMN患者预后的指标。本研究因部分患者术后随访时间过短,未做相关术后生存率分析。
参 考 文 献
[1] Ohashi K, Murakami Y, Maruyama M. Four cases of “mucin-producing” cancer of the pancreas on specific findings of the papilla of Vater[J]. Prog Dig Endosc, 1982, 20: 348-351.
[2] 李增山,李青.2010年版消化系统肿瘤WHO分类解读[J]. 中华病理学杂志,2011, 40(5): 351-354.
[3] Sultana A, Jackson R, Tim G, et al. What is the best way to identify malignant transformation within pancreatic IPMN: a systematic review and meta-analyses[J]. Clin Transl Gastroenterol, 2015, 6: e130.DOI:10.1038/ctg.2015.60.
[4] Mimura T, Masuda A, Matsumoto I, et al. Predictors of malignant intraductal papillary mucinous neoplasm of the pancreas[J]. J Clin Gastroenterol, 2010, 44(9): e224-e229.DOI:10.1097/MCG.0b013e3181d8fb91.
[5] You L, Ma L, Zhao WJ, et al. Emerging role of tumor markers and biochemistry in the preoperative invasive assessment of intraductal papillary mucinous neoplasm of the pancreas[J]. Clin Chim Acta, 2016, 454: 89-93.DOI:10.1016/j.cca.2015.12.036.
[6] Takeshita A, Kimura W, Hirai I, et al. Clinicopathologic study of the MIB-1 labeling index (Ki67) and postoperative prognosis for intraductal papillary mucinous neoplasms and ordinary ductal adenocarcinoma[J]. Pancreas, 2012, 41(1): 114-120.DOI:10.1097/MPA.0b013e318220c1fa.
[7] Crippa S, Fernandez-Del Castillo C, Salvia R, et al. Mucin-producing neoplasms of the pancreas: an analysis of distinguishing clinical and epidemiologic characteristics[J]. Clin Gastroenterol Hepatol, 2010, 8(2): 213-219.DOI:10.1016/j.cgh.2009.10.001.
[8] Baiocchi GL, Portolani N, Missale G, et al. Intraductal papillary mucinous neoplasm of the pancreas (IPMN): clinico-pathological correlations and surgical indications[J]. World J Surg Oncol, 2010, 8: 25.DOI:10.1186/1477-7819-8-25.
[9] Hwang DW, Jang JY, Lee SE, et al. Clinicopathologic analysis of surgically proven intraductal papillary mucinous neoplasms of the pancreas in SNUH: a 15-year experience at a single academic institution[J]. Langenbecks Arch Surg, 2012, 397(1): 93-102.DOI:10.1007/s00423-010-0674-6.
[10] Tanaka M, Fernandez-del Castillo C, Adsay V, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J]. Pancreatology, 2012, 12(3): 183-197.DOI:10.1016/j.pan.2012.04.004.
[11] Nagai K, Doi R, Kida A, et al. Intraductal papillary mucinous neoplasms of the pancreas: clinicopathologic characteristics and long-term follow-up after resection[J]. World J Surg, 2008, 32(2): 271-278.DOI:10.1007/s00268-007-9281-2.
[12] 李森,朱中飞,马洪运,等.胰腺实性-假乳头瘤51例外科诊治分析[J].第二军医大学学报,2016,37(11):1366-1372.DOI:10.16781/j.0258-879x.2016.11.1366.
[13] Suzuki R, Thosani N, Annangi S, et al. Diagnostic yield of EUS-FNA-based cytology distinguishing malignant and benign IPMNs: a systematic review and meta-analysis[J]. Pancreatology, 2014, 14(5): 380-384.DOI:10.1016/j.pan.2014.07.006.
[14] Kim JR, Jang JY, Kang MJ, et al. Clinical implication of serum carcinoembryonic antigen and carbohydrate antigen 19-9 for the prediction of malignancy in intraductal papillary mucinous neoplasm of pancreas[J]. J Hepatobiliary Pancreat Sci, 2015, 22(9): 699-707.DOI:10.1002/jhbp.275.
[15] Mizumoto M, Honjo G, Kobashi Y, et al. Molecular profile of apomucin and p53 protein as predictors of malignancy in intraductal papillary mucinous neoplasms of the pancreas[J]. Hepatogastroenterology, 2011, 58(110-111): 1791-1795.DOI:10.5754/hge09195.
[16] Shimura T, Kofunato Y, Okada R, et al. MIB-1 labeling index, Ki-67, is an indicator of invasive intraductal papillary mucinous neoplasm[J]. Mol Clin Oncol, 2016, 5(2): 317-322.DOI:10.3892/mco.2016.908.

