精液中白细胞异常增高对精液质量的影响及其与男性生育力的相关性*
蒋 敏,岳焕勋,李福平,蒋小辉,李定明,余 林,吴应碧
四川大学华西第二医院人类精子库·出生缺陷与相关妇儿疾病教育部重点实验室 (成都 610041)
我国已婚夫妇中不孕不育的发病率逐年增加,男性因素所致不育占40%,其中,4%~10%的男性不育患者有生殖道感染,白细胞精子症是男性生殖道感染的重要表现[1]。目前,关于生殖道感染后,精液中白细胞异常增高是否会影响精液质量,引起男性精液质量降低、精子运动能力发生改变而导致不育的观点仍存在分歧。本研究对四川大学华西第二医院接诊的男性不育患者精液中的白细胞水平、精液质量及精子运动参数进行分析,以探求精液中白细胞异常增高与男性精液质量、精子运动能力的相关性,现报道如下。
1 资料与方法
1.1 临床资料
选取2016年1月至2017年12月于四川大学华西第二医院男科门诊就诊的男性不育患者8 714例为研究对象,年龄21~55(31.06±6.28)岁。纳入标准:婚后正常性生活未采取避孕措施,1年以上不育,体格检查未见睾丸、附睾及输精管异常,无外伤、无性功能障碍史及遗传性疾病家族史;女方经检查排除器质性病变者。排除标准:女方因素所致不孕;女方1年内有妊娠史;近期接触过放射线、肿瘤放化疗等影响精液质量的因素者。按照患者精液中白细胞浓度的高低分为两组:非炎症组,白细胞浓度<1×106/mL,共7 106例;炎症组,白细胞浓度≥1×106/mL,共1 608例。非炎症组患者年龄21~55(32.14±6.58)岁;不育年限1~8年;炎症组患者年龄21~55为(31.68±5.26)岁;不育年限1~9年。两组患者年龄、身高、体质量和不育年限等一般资料比较,差异无统计学意义(P>0.05),具有可比性(表1)。
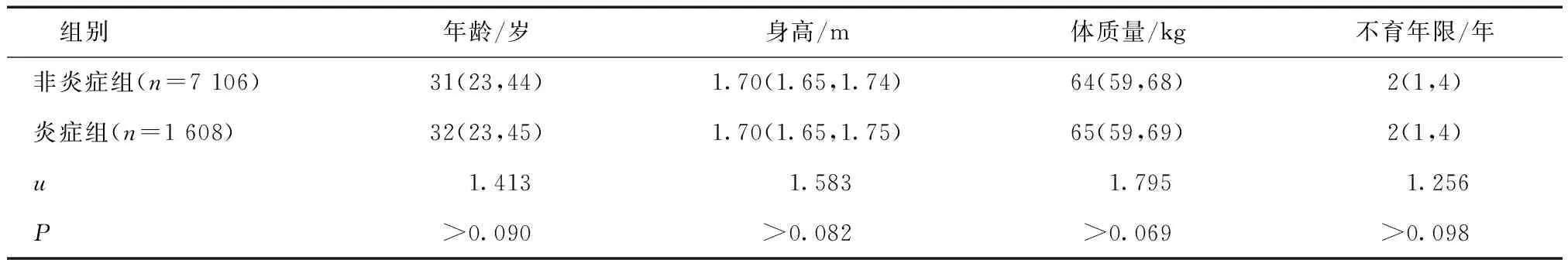
表1 两组患者临床资料比较
1.2 方法
1.2.1 精液常规分析 在患者知情同意的前提下,患者禁欲2~8 d,手淫法留取全部精液标本于清洁干燥、对精子无毒性的一次性采精杯中,轻轻混匀后立即置37 ℃孵育,待精液完全液化后,严格按照WHO《人类精液检查与处理实验室手册》(第5版)[2]要求进行精液常规分析,包括精液外观、液化时间、pH值、精子浓度、精子活动率、前向运动精子百分率、精子存活率及正常形态精子百分率等参数。同时,振摇混匀精液,用移液器吸取8 μL精液于MAKLER板中,37 ℃恒温条件下采用计算机辅助的精子动态图像检测系统(CASA)分析精子活力及精子运动轨迹等参数。所有标本的精液常规分析均由2名熟练的专业技术人员进行分析。
1.2.2 精液中白细胞检测 精液中白细胞检测采用白细胞过氧化物酶染色法,采用安徽安科生物工程股份有限公司生产的精液白细胞染色试剂盒,严格按照试剂盒说明书进行操作。
1.3 统计学方法
采用SPSS 16.0统计软件进行数据处理,检测数据等定量资料采用中位数(第5,95百分位数)表示,非正态分布资料两组间比较采用秩和检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 精液中白细胞对精液质量各主要参数的影响
与非炎症组相比,炎症组患者的精液体积、精子浓度、精子总数、精子存活率、前向运动精子百分率及正常形态精子百分率均降低,差异具有统计学意义(P<0.05);两组患者精液液化时间和pH值比较,差异无统计学意义(P>0.05)(表2)。
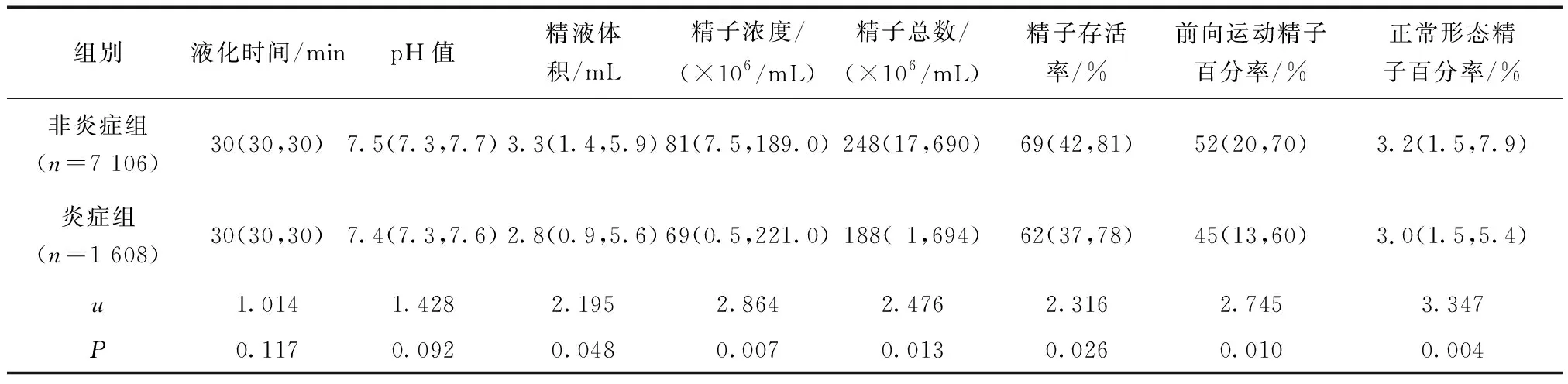
表2 两组患者精液各主要参数的比较
2.2 精液中白细胞对精子各运动参数的影响
与非炎症组比较,炎症组患者精子除侧向摆动幅度(ALH)外,精子的曲线运动速度(VCL)、直线运动速度(VSL)、直线性(LIN)、前向性(STR)、平均路径速度(VAP)均下降,差异有统计学意义(P<0.05);炎症组患者精子的平均鞭打频率(BCF)有所降低,但两组间比较,差异无统计学意义(P>0.05)(表3)。
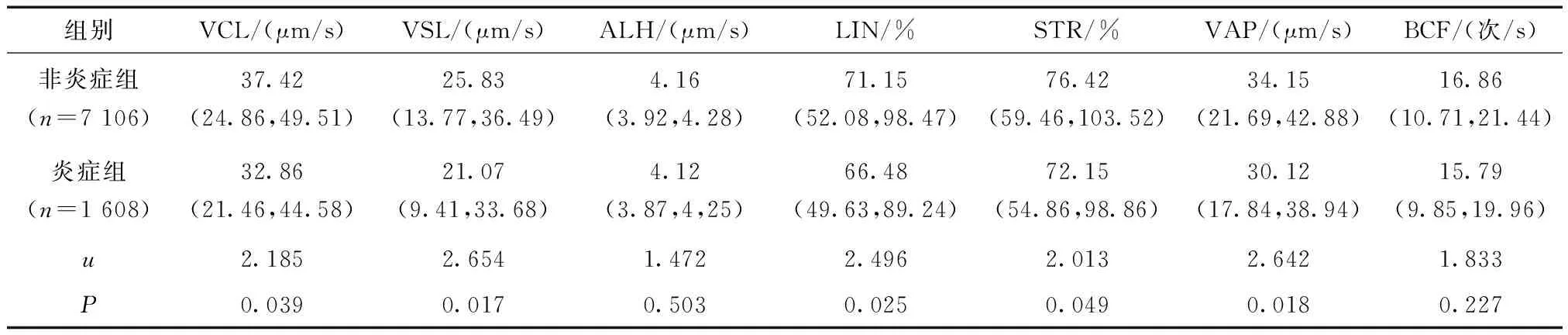
表3 白细胞对精子各运动参数的影响
3 讨论
精液质量分析是评价男性生育能力及优生优育的重要指标,是临床进行男性不育相关疾病诊断和疗效观察的常用检测项目之一。精液质量分析必须严格按照WHO《人类精液检查与处理实验室手册》(第5版)的要求,对包括精液外观、液化时间、pH值、精子浓度、精子活动率、前向运动精子百分率、精子存活率及正常形态精子百分率等参数进行分析,从而对男性的精液质量做出较为全面的评估[2]。
男性不育的病因很多,包括遗传性因素、内分泌疾病、免疫性因素、生殖道感染以及不良的生活习惯等[3],其中生殖道感染是导致男性不育的重要因素。研究[4]显示,精液中的白细胞对于吞噬和杀灭细菌等病原微生物至关重要,其可被细菌和精液中损伤的精子激活,从而清除变形、退化和凋亡的精子,阻止损伤的精子进入女性生殖系统。更多研究[5]发现,精液中的白细胞增加会直接或间接地释放炎症因子(ROS、蛋白酶、细胞因子和淋巴因子),与精子相互作用,导致精子数量减少,并影响精子运动能力及受精能力,从而影响男性生育能力。
本研究对8 714例男性不育患者精液中白细胞对精液质量的影响进行了分析,结果显示,炎症组男性不育患者的精液体积、精子浓度、精子总数、精子存活率、前向运动精子百分率及正常形态精子百分率均有所降低,且与非炎症组男性不育患者相比,差异具有统计学意义(P<0.05)。Barraud-Lange等[6]研究结果显示,精液中白细胞异常增加与精液主要参数,包括精子浓度、精子总数及活动率等呈负相关。王晟等[7]研究结果也发现,白细胞精子症可导致精子浓度、精子活动率及正常形态精子百分率降低,与本研究结果一致。
精子的运动能力是评估精子受精能力的重要指标之一。精子高度快速的运动有助于精子摆脱输卵管黏液形成的袋状和套状的影响,高度快速运动精子所占比例与精子体外受精能力、受精率密切相关,是反映精子质量的重要指标之一[8-9]。本研究结果显示,与非炎症组比较,炎症组患者精子的、VCL、VSL、LIN、STR、VAP均下降,且差异具有统计学意义(P<0.05);炎症组患者精子的 BCF和 ALH与非炎症组患者相比均有所降低,但差异无统计学意义(P>0.05)。可见,精液中白细胞异常增加可导致精子VCL、VSL、VAP显著下降,使精子的快速运动速率降低,同时改变精子的运动方式,减少空间位移程度,从而降低精子的运动能力,影响精子质量。
综上所述,精液中少量的白细胞可杀死、吞噬异常精子,但是精液中白细胞异常增高则会导致精子浓度、精子总数、前向运动精子百分率、正常形态精子百分率下降,精子前向快速运动速度受限。临床工作者应重视精液中白细胞的检测,对白细胞精子症患者早日进行抗炎治疗,从而降低精液中的白细胞,改善男性精液质量,提高男性的生育能力。
[1]Jung J H, Kim M H, Kim J,etal. Treatment of Leukocytospermia in Male Infertility: A Systematic Review[J]. World J Mens Health, 2016, 34(3): 165-172.
[2]World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed[M]. Geneva: World Health Organization, 2010:7-91.
[3]Kazemeini S K, Emtiazy M, Owlia F,etal. Causes of infertility in view of Iranian traditional medicine: A review[J]. Int J Reprod Biomed (Yazd), 2017, 15(4): 187-194.
[4]Kiessling A A, Lamparelli N, Yin H Z,etal. Semen leukocytes: friends or foes[J]. Fertil Steril, 1995, 64(1): 196-198.
[5]Agarwal A, Mulgund A, Alshahrani S,etal. Reactive oxygen species and sperm DNA damage in infertile men presenting with low level leukocytospermia[J]. Reprod Biol Endocrinol, 2014, 12: 126.
[6]Barraud-Lange V, Pont J C, Ziyyat A,etal. Seminal leukocytes are Good Samaritans for spermatozoa[J]. Fertil Steril, 2011, 96(6): 1315-1319.
[7]王晟, 贺占举, 郐艳荣, 等. 精液中白细胞与精液质量的关系研究[J]. 中国性科学, 2013, 22(5): 3-6.
[8]Hirano Y, Shibahara H, Obara H,etal. Relationships between sperm motility characteristics assessed by the computer-aided sperm analysis (CASA) and fertilization rates in vitro[J]. J Assist Reprod Genet, 2001, 18(4): 213-218.
[9]Fraczek M, Hryhorowicz M, Gill K,etal. The effect of bacteriospermia and leukocytospermia on conventional and nonconventional semen parameters in healthy young normozoospermic males[J]. J Reprod Immunol, 2016, 118: 18-27.

