硒结合蛋白表达对宫颈癌发生发展与预后的影响分析*
贺传勇,陈 典,邹 毅,谷 新,李新新, 廖 荔
恩施土家族苗族自治州中心医院(恩施 445000)
硒作为一种人体必需的微量元素,在多种生理活动中扮演重要角色,大量的流行病学及临床数据[1]表明,它具有预防和治疗前列腺癌、肺癌、肝癌等多种恶性肿瘤的作用,探究硒的抗癌分子机制是目前研究热点。关于硒与人类健康研究较多,硒能防治肿瘤细胞生长,诱导细胞凋亡,但主要集中在如肝癌、肺癌、前列腺癌等恶性肿瘤的研究中,而在妇科肿瘤方面的研究报道较少。子宫颈癌是女性生殖器官最常见的恶性肿瘤之一,其发病率在妇科肿瘤中位于第2位,死亡率居妇女恶性肿瘤之首。我国宫颈癌发病年龄呈年轻化趋势,严重威胁着女性健康。到目前为止,子宫颈癌的确切病因仍不完全清楚,认为引起子宫颈癌的主要原因有未成年即有性生活、多个性伴侣、多产、性病患者、单纯疱疹病毒(HSV-2)感染等。血管生成素-2、血小板反应素-1与子宫颈癌的发生、发展有关[2]。除了上述因素以外,一些地理环境如硒缺乏等因素,也与宫颈癌的发生有关[3]。本研究通过检测宫颈癌患者硒含量,以及硒结合蛋白(SEBP1)在不同宫颈组织的表达与宫颈癌关联,发现SEBP1与宫颈癌患者的预后密切相关,为宫颈癌临床诊断和预后判断提供理论依据,同时也对开发硒化合物治疗宫颈癌具有重要意义。现报道如下。
1 资料与方法
1.1 临床资料
随机选取2016年10月至2017年11月恩施土家族苗族自治州中心医院住院的宫颈癌患者及同期住院的宫颈上皮内肿瘤病人与其他宫颈良性疾病切除病人,均通过病理确诊。每组病例各70例,年龄29~79岁,平均年龄45.1岁,中位发病年龄43岁;未绝经143例,绝经67例。收集宫颈癌患者宫颈癌组织和其他组患者的良性宫颈组织,一部分做成直径约0.5 cm组织块,经4%多聚甲醛固定,常规脱水包埋,制成0.4 μm切片备用,行常规染色及免疫组织化学染色观察;剩余组织冻存于-80 ℃冰箱备用。上述所有研究对象在空腹8~12 h后,于清晨取肘静脉血约5 mL,离心后取血清检测血清硒含量。
1.2 主要仪器与试剂
RPMI-1640培养基、胎牛血清(FBS)、青-链霉素(P&S)、0.25%胰酶等均购自Gibco公司;SEBP1(SELENBP1)单抗( sc-373726)和内参GAPDH抗体均购自美国 SANTA CRUZ 公司;c-Myc与p53一抗购自Cell Signaling Technology公司;辣根过氧化物酶标记羊抗兔/鼠IgG二抗(Thermo公司);免疫组化检测试剂盒(三明安信)、BCA蛋白定量试剂盒购自上海碧云天公司;生物安全柜(新加坡ESCO公司);CO2恒温培养箱(美国Thermo公司);蛋白质电泳系统(美国Bio Rad公司);正置显微镜(日本尼康);Amersham Imager 600 System (GE公司);多功能酶标仪(Thermo公司)。
1.3 检测各组宫颈组织中蛋白表达
取多聚甲醛固定的各组宫颈组织,加入免疫组织化学染色(IHC),采用链霉菌抗生物素蛋白过氧化酶免疫组化(SP)法检测,DAB显色,一抗SEBP1的工作浓度为1∶400,一抗c-Myc为1∶200,p53为1∶1 000,操作流程按试剂说明书进行。SEBP1、c-Myc、p53的表达以细胞浆和/或细胞核出现棕黄色颗粒为阳性。
1.4 蛋白免疫印迹
3×105细胞接种于6孔板中,NP40裂解细胞并提取总蛋白和BCA法蛋白定量;取20 g总蛋白上样、SDS-PAGE分离、转膜,一抗(稀释比例均为1∶1 000)中4 ℃孵育过夜,二抗(1∶5 000)室温孵育1 h。采用Amersham Imager 600 System观察蛋白印迹条带和成像;应用Image J软件半定量分析蛋白印迹条带的积分光密度。
1.5 统计学方法
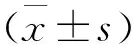
2 结果
2.1 宫颈癌患者中血清硒含量与SEBP1含量情况
宫颈癌患者的血清中,其血清硒含量最低,为(46.6±14.3)μg/L,宫颈上皮内肿瘤血清硒含量次之,为(61.3±12.1)μg/L,宫颈良性疾病患者的血清中硒含量最高,为(81.5±20.7)μg/L,宫颈癌患者的血清硒含量明显低于宫颈上皮内肿瘤和宫颈良性疾病的患者(P<0.05)(图1)。

图1 3组患者的血清硒含量比较注:与宫颈癌组比较,*P<0.05
2.2 3组患者组织中SEBP1表达量比较
3组病人组织阳性细胞SEBP1表达量中,宫颈癌患者、宫颈上皮内肿瘤和宫颈良性疾病患者分别为(12.4±4.7)%、(18.5±5.8)%、(22.4±6.4)%,其中宫颈癌患者明显低于宫颈上皮内肿瘤和宫颈良性疾病的患者(P<0.05)(图2)。

图2 3组患者组织切片中SEBP1阳性细胞的比例注:与宫颈癌组比较,*P<0.05
2.3 不同细胞系中SEBP1蛋白的表达水平
与宫颈正常上皮细胞系H8相比,宫颈肿瘤细胞系Hela、SiHa和CaSki中,其SEBP1表达明显降低,差异有统计学意义(P<0.05)(图3)。

图3WesternBloting检测宫颈正常上皮细胞系H8以及宫颈肿瘤细胞系Hela、SiHa和CaSk中SEBP1的表达量
注:与H8比较,*P<0.05
2.4 宫颈癌进展与SEBP1表达的关系
促癌基因c-Myc的阳性细胞比例与SEBP1阳性细胞比例呈负相关(r=-0.364),抑癌基因p53阳性细胞比例与SEBP1阳性细胞比例呈正相关(r=0.379),差异有统计学意义(P<0.05)(图4)。

图4 采用SP法检测3组组织切片中SEBP1、c-Myc与抑癌基因p53的阳性细胞
2.5 SEBP1表达与宫颈癌预后的关系
SEBP1 Low组患者其复发率比例、淋巴转移比例明显高于SEBP1 High组,差异有统计学意义(P<0.05),SEBP1 Low组患者其Ⅲ期或Ⅳ期的比例明显高于SEBP1 High组,差异有统计学意义(P<0.05),两组的高分化和低分化比例比较,差异无统计学意义(P>0.05)(表1)。

表1 SEBP1 High组与SEBP1 Low组中复发率、淋巴转移、肿瘤分期与分化程度比较[n(%),n=35]
3 讨论
硒是许多生物过程必需和独特的微量营养素,流行病学和临床试验研究[4]发现,膳食中硒缺乏与癌症发病率增加有关,硒发挥其抗癌作用主要是通过影响具有营养价值的硒蛋白,目前已经在人类基因组中至少鉴定了25个硒蛋白。硒蛋白广泛参与细胞代谢,并且可能与癌症的发生、发展密切相关。SEBP1是硒蛋白家族的成员之一,其主要功能是介导硒的细胞内转运[5]。SEBP1在各种正常组织类型(肝、心、肺、肾)都有表达,其主要位于细胞核和/或细胞质中,与其相应的正常组织相比,其表达在许多类型的癌症中明显降低,包括前列腺癌、胃癌、卵巢癌、肺癌、结肠和甲状腺[6-7]。Epplein等[8]研究表明,人SEBP1在多种肺腺癌表现出表达降低。通过使用组合的蛋白质组和基因组的方法分析发现,在大队列中,人肺癌SEBP1的蛋白质和mRNA表达下降。而刘杰文等[9]研究发现,SEBP1在乳腺腺病组织中呈高表达,而在乳腺癌组织中表达较低。本研究发现,与宫颈良性疾病患者相比,宫颈癌患者的组织切片中阳性细胞比例最低,宫颈上皮内肿瘤阳性细胞的比例居中,宫颈良性疾病患者的阳性细胞比例最高。在宫颈癌细胞中,与正常宫颈上皮细胞相比,3株宫颈肿瘤细胞系中存在SEBP1低表达现象,这些结果说明SEBP1与宫颈癌的发生密切相关。
在癌症的发生和预后中,SEBP1的下调可能发挥关键作用。最近研究[10]表明,SEBP1可能与肿瘤的进展密切相关,参与肿瘤细胞增殖、侵袭、转移和耐药。随着肿瘤分期的增加,SEBP1的表达降低,SEBP1水平也与细胞分化相关,低分化是晚期肿瘤阶段的标志。通过免疫组织化学评估SEBP1在结肠细胞分化的不同阶段表达时发现,当结肠细胞分化时,使用siRNA在Caco-2细胞中下调SEBP1的表达,结肠细胞系导致上皮分化标志物癌胚抗原的表达也升高[11]。以上证据表明,SEBP1可能在肿瘤进展过程中发挥功能。SEBP1具有抑制肿瘤的进展作用,但基础机制不清楚。Ying等[12]研究发现,在小鼠中SEBP1的诱导抑制结肠直肠癌细胞生长和转移,进一步采用同量异位标签进行相对和绝对定量分析,以鉴定参与SEBP1介导的肿瘤组织中抗癌作用的蛋白质,结果发现,SEBP1主要与MAPK、Wnt、NF-κB、NOTCH和上皮-间质转化(EMT)信号通路相关。这些结果揭示了SEBP1抑制癌症是通过多重信号通路的。在本研究中,促癌基因c-Myc和抑癌基因p53与SEBP1阳性明显相关,c-Myc基因与p53基因是肿瘤发生发展密切相关的基因,调节多重信号通路[13]。此外,本研究还发现,SEBP1表达与宫颈癌预后的关系密切,SEBP1的高表达能降低宫颈癌的复发率和转移率,减小宫颈癌的恶性程度,从而提高宫颈癌预后。本研究结果再次证实了SEBP1在宫颈癌中的作用,为SEBP1作为临床上肿瘤诊断与治疗的标志物提供了证据。
全面了解SEBP1抑制肿瘤的具体机制对提高SEBP1作为肿瘤治疗的靶点具有重要意义。SEBP1可能发挥其肿瘤抑制作用,主要是作为肿瘤氧化还原微环境的调节剂,因为SEBP1的表达降低可能影响谷胱甘肽过氧化物酶-1(GPX1)活性和HIF-1α表达[14]。去泛素化酶1(VDU1)是最近发现的SEBP1的另一个重要调节因子,能够参与泛素化或去泛素化,介导蛋白质降解途径[15]。一些研究人员[16]注意到,SEBP1表达可导致脂质/葡萄糖代谢相关蛋白变化,如Dickkopf相关蛋白1(DKK1),膜联蛋白A4(ANXA4)和核因子κB(NF-κB),并且这些分子能通过调节下游分子抑制致癌作用和肿瘤进展。此外,研究[17-18]显示,SEBP1与GPX1相互作用,并且降低GPX活性。因为GPX1是分解过氧化氢的硒酶,所以SEBP1可以通过改变氧化应激发挥抑制肿瘤的作用。在宫颈癌中不存在或存在过氧化氢处理的情况下,Hela细胞中敲低SEBP1的表达,能降低活性氧(ROS)水平。这种抑制的氧化应激可归因于GPX1,因为SEBP1能下降GPX酶活性[19],并且敲低SEBP1,增加GPX1蛋白表达,促进宫颈癌的发生发展与预后[20]。目前关于癌症发生过程中,ROS、SEBP1和抗氧化硒蛋白之间的相互作用并不清晰,本研究揭示了SEBP1对宫颈癌发生发展与预后的作用,但机制并未阐明,因此需要进一步的机制研究。
[1]Combs G F, Yan L. Status of Dietary Selenium in Cancer Prevention[J]. Selenium, 2016: 321-332.
[2]Llaguno A L T, Parra V E , Fuenzalida G S,etal. Incidence of cervical dysplasia and cervical cancer in patients younger than 25 years in a dysplasia clinic[J]. J Pediatr Adolesc Gynecol, 2016, 29(2): 179.
[3]Gong J, Li L. Sodium Selenite Inhibits Proliferation of Gastric Cancer Cells by Inducing SBP1 Expression[J]. Tohoku J Exp Med, 2016, 239(4): 279-285.
[4]Sun W, Lu J, Wu S,etal. Association of insulin resistance with breast, ovarian, endometrial and cervical cancers in non-diabetic women[J]. Am J Cancer Res, 2016, 6(10): 2334-2344.
[5]Christensen M J. Selenium and prostate cancer prevention: what next--if anything[J]. Cancer Prev Res (Phila), 2014, 7(8): 781-785.
[6]Geybels M S, van den Brandt P A, Schouten L J,etal. Selenoprotein gene variants, toenail selenium levels, and risk for advanced prostate cancer[J]. J Natl Cancer Inst, 2014, 106(3): dju003.
[7]Xie W, Yang M, Chan J,etal. Association of genetic variations of selenoprotein genes, plasma selenium levels, and prostate cancer aggressiveness at diagnosis[J]. Prostate, 2016, 76(7): 691-699.
[8]Epplein M, Burk R F, Cai Q,etal. A prospective study of plasma Selenoprotein P and lung cancer risk among low-income adults[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(7): 1238-1244.
[9]刘杰文, 路喜安, 齐广强. 硒结合蛋白1与半胱氨酸蛋白酶在乳腺癌中的表达及意义[J]. 中国药物与临床, 2016, 16(7): 964-966.
[10] Wang N, Chen Y, Yang X,etal. Selenium-binding protein 1 is associated with the degree of colorectal cancer differentiation and is regulated by histone modification[J]. Oncol Rep, 2014, 31(6): 2506-2514.
[11] Sethi M K, Thaysen-Andersen M, Kim H,etal. Quantitative proteomic analysis of paired colorectal cancer and non-tumorigenic tissues reveals signature proteins and perturbed pathways involved in CRC progression and metastasis[J]. J Proteomics, 2015, 126: 54-67.
[12] Ying Q, Ansong E, Diamond A M,etal. Quantitative proteomic analysis reveals that anti-cancer effects of selenium-binding protein 1 in vivo are associated with metabolic pathways[J]. PLoS One, 2015, 10(5): e0126285.
[13] Abraham S A, Hopcroft L E, Carrick E,etal. Dual targeting of p53 and c-MYC selectively eliminates leukaemic stem cells[J]. Nature, 2016, 534(7607): 341-346.
[14] 王凤杰, 王科坤, 陈显兵, 等. 宫颈癌组织中硒结合蛋白1表达与肿瘤微环境中抗氧化酶活性有关[J]. 中国免疫学杂志, 2016, 32(5): 711-714.
[15] Chen F, Chen C, Qu Y,etal. Selenium-binding protein 1 in head and neck cancer is low-expression and associates with the prognosis of nasopharyngeal carcinoma[J]. Medicine (Baltimore), 2016, 95(35): e4592.
[16] Soekmadji C, Riches J D, Russell P J,etal. Modulation of paracrine signaling by CD9 positive small extracellular vesicles mediates cellular growth of androgen deprived prostate cancer[J]. Oncotarget, 2016, 8(32):52237-52255.
[17] Gerstenberger J P, Bauer S R, Van Blarigan E L,etal. Selenoprotein and antioxidant genes and the risk of high-grade prostate cancer and prostate cancer recurrence[J]. Prostate, 2015, 75(1): 60-69.
[18] Yang W, Diamond A M. Selenium-binding protein 1 as a tumor suppressor and a prognostic indicator of clinical outcome[J]. Biomarker Research, 2013, 1(1): 15.
[19] Zhao C, Zeng H, Wu R T,etal. Loss of Selenium-Binding Protein 1 Decreases Sensitivity to Clastogens and Intracellular Selenium Content in HeLa Cells[J]. PLoS One, 2016, 11(7): e0158650.
[20] Wang Y, Fang W, Huang Y,etal. Reduction of selenium-binding protein 1 sensitizes cancer cells to selenite via elevating extracellular glutathione: a novel mechanism of cancer-specific cytotoxicity of selenite[J]. Free Radic Biol Med, 2015, 79: 186-196.

