精氨酸加压素反转前列腺素E2引起的大鼠视前区冷敏神经元活性增强*
侯晓钰,胥建辉,唐 瑜,罗 蓉,刘 畅,张 洁
1.成都医学院第一附属医院 产科(成都 610500);2.成都医学院 体温与炎症四川省高校重点实验室(成都 610500)
精氨酸加压素(arginine vasopressin, AVP)是一种九肽神经激素,它既可以作为激素被分泌到外周发挥维持体液、血压平衡的作用,也可以作为神经递质或调质被释放到中枢发挥调控情绪、学习记忆和社会行为的作用[1]。此外,AVP还在正常体温调节和退热中发挥了重要作用[2-3]。研究[2-4]表明,不论是外周还是中枢应用AVP均可以引起正常体温降低或导致脂多糖引起的大鼠发热效应减弱,但是目前AVP引起退热的机制还未完全阐明。
下丘脑视前区是体温调节中枢,这里分布着可以被下丘脑局部温度改变激活的热敏神经元和冷敏神经元,以及对局部温度改变无响应的温度不敏感神经元。既往的研究[5-6]表明,这些不同种类的神经元在正常体温调节与发热反应中扮演了重要角色。前列腺素E2(prostaglandin E2, PGE2)是一种关键的内源性致热因子,研究[7-8]发现,PGE2可降低视前区热敏神经元的放电频率,增加温度不敏感神经元或冷敏神经元的放电频率,提示PGE2的致热作用可能与此有关。与此相反,AVP可增加视前区热敏神经元的放电频率,降低温度不敏感神经元和冷敏神经元的放电频率[9],这就提示AVP可能影响PGE2对视前区神经元的作用。前期研究[10]已经证明,AVP能够对抗PGE2对内侧视前区热敏神经元和温度不敏感神经元的作用,但AVP是否能够影响PGE2对视前区冷敏神经元的作用还未见报道。因此,通过应用全细胞膜片钳技术,本研究观察了AVP对PGE2引起视前区冷敏神经元放电频率变化的影响。此外,通过应用AVP的V1a受体拮抗剂,还测试了AVP V1a受体是否在其中发挥了一定的作用。
1 材料与方法
1.1 动物和试剂
健康纯系雄性SD大鼠87只,每只体质量250 g左右,由成都达硕实验动物有限公司提供。 NaCl、KCl、CaCl2、MgCl2、MgSO4、KH2PO4、NaHCO3、葡萄糖和戊巴比妥钠均购自成都科龙化工试剂厂。AVP、AVP V1a受体阻断剂、四乙酸(EGTA)、羟乙基哌嗪乙磺酸(HEPES)、Mg-ATP和Na2GTP均购自Sigma公司,玻璃电极购自Sutter公司。
1.2 实验方法
1.2.1 脑片制备 按照以往研究[8]报道的方法,4%戊巴比妥钠(40 mg/kg, ip)麻醉大鼠,断头取脑,置于充以混合氧(95% CO2和5% O2)的0~4 ℃人工脑脊液中冷冻,1~2 min后取出修块,用少量502 胶将修好的组织块固定在切片机上,切成300 μm厚的脑薄片,选择含有视前区的脑片,在室温下于充以混合氧的人工脑脊液中孵育2 h左右备用。人工脑脊液成分:124 mmol/L NaCl,26 mmol/L NaHCO3,5 mmol/L KCl,2.4 mmol/L CaCl2,1.3 mmol/L MgSO4,1.24 mmol/L KH2PO4,10 mmol/L葡萄糖(渗透压调至295~300 mmol/L,pH值调至7.2~7.4)。
1.2.2 全细胞膜片钳记录 在正置微分干涉相差显微镜(FN1,Nikon,Japan)下挑选状态良好的细胞,选择入水电阻5 M欧左右的玻璃电极进行细胞封接。调整微操纵器(MPC-200, Sutter Instruments, USA)使玻璃电极靠近细胞,在电极入水直至电极接触细胞之前持续给予10~30 mm水柱正压,在接触细胞时放开正压,通过细胞自然回弹或者负压吸引封堵电极口形成G欧阻抗封接,封接稳定后电击(ZAP)破膜,此后切换至电流钳模式(I=0)记录视前区神经元自发放电,电流信号经放大器(EPC10,HEKA,Germany)放大后显示在计算机上。电极内液成分:130 mmol/L 葡萄糖酸钾,10 mmol/L EGTA,10 mmol/L HEPES,2 mmol/L Mg-ATP,2 mmol/L Na2GTP,和1 mmol/L CaCl2(渗透压调至295~300 mmol/L,pH值调至7.2~7.4)。
1.2.3 神经元温度敏感性的鉴别和给药 根据以往的文献[9, 11]报道,通过改变浴液温度鉴别视前区冷敏感神经元。设定温度控制器TC-324B(warner instruments, USA)为45~50 ℃,将记录浴槽的温度控制在37 ℃左右,改变另1个温度控制器 CL-100(warner instruments, USA)的设定温度,即可使浴液温度快速地在28~42 ℃变化,根据温度对神经元自发放电的影响,计算温度敏感系数:以温度为横坐标,单位时间内的放电个数为纵坐标做散点图,线性拟合后的斜率(m值)即为温度敏感系数,它表示单位时间和温度内的放电个数,即imp/S·℃(impluse/S·℃)。根据文献[5]定义,m值≤-0.6为冷敏神经元。鉴定神经元温度敏感性类型后,向人工脑脊液中加入AVP(1 μmol)或 AVP(1 μmol)+PGE2(1 μmol)或AVP(1 μmol)+PGE2(1 μmol)+AVP V1a(1 μmol)受体阻断剂,加药时间为5 min,此后用人工脑脊液洗脱10 min,以充分去除药物对神经元的影响。
1.3 统计学方法
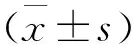
2 结果
2.1 PGE2对冷敏神经元的作用
实验程序完成后,共有13个冷敏神经元仍保持活性,其平均放电频率为(7.3±0.78)imp/s,不同药物对所有冷敏神经元放电频率的影响如下所示(图1),加药后典型的冷敏神经元放电频率改变如下所示(图2A,图3A和图4A)。在加入PGE2后,有8个冷敏神经元的放电频率明显升高,其平均放电频率上升了(69.6±39.7)%(t=2.731,P=0.016)(图1和图2B);3个冷敏神经元的放电频率明显下降,其平均放电频率下降了(90.0±21.49)%,但差异无统计学意义(t=2.619,P=0.058)(图1和图3B);2个冷敏神经元的放电频率保持不变(t=0.056,P=0.959)(图1和图4B)。

图1 不同药物对大鼠视前区冷敏神经元放电频率的影响
注:A~C:描述了冷敏神经元分别应用不同药物前后的放电频率;散点处于虚线以上或以下分别表明对应的神经元加药后放电增加或减少;“○”,“△”,“□”分别代表了加PGE2后放电频率增加、减少或不变的冷敏神经元;V1aant:AVP V1a受体拮抗剂
2.2 AVP对PGE2引起冷敏神经元放电变化的影响
为了研究AVP对PGE2引起冷敏神经元放电变化的影响,本研究用人工脑脊液灌流10 min洗脱PGE2的作用后,又在灌流液中加入了PGE2和AVP混合液。结果显示,PGE2引起放电频率上升的冷敏神经元在加入PGE2和AVP混合液后,其平均放电变化转为下降(n=8,P<0.05),说明AVP反转了PGE2引起的冷敏神经元放电活性增强(图2A和图2C)。
此后,为了研究AVP的作用是否由AVP V1a受体介导,在用人工脑脊液灌流10 min洗脱AVP和PGE2混合液的作用后,又在灌流液中加入了PGE2、AVP和AVP V1a受体阻断剂混合液。结果所示,在加入了PGE2、AVP和V1a受体拮抗剂后,神经元的平均放电变化与PGE2和AVP混合液引起的放电变化比较,差异有统计学意义(n=8,P<0.05),而且与PGE2引起的放电变化相似(n=8,P>0.05),表明V1a受体拮抗剂废除了AVP对PGE2引起神经元放电改变的影响,提示V1a受体介导了AVP的作用(图2A和图2C)。
3个PGE2引起放电频率下降的神经元在分别加入了AVP和PGE2混合液以及AVP、PGE2和AVP V1a受体拮抗剂混合液后的平均放电变化与加入PGE2后引起的放电变化相似(n=3,P=0.934),表明AVP和AVP V1a受体拮抗剂不能影响PGE2引起的冷敏神经元活性下降(图3A和图3C)。与此相似,其余2个对PGE2没有响应的冷敏神经元,在分别加入了AVP和PGE2混合液以及AVP、PGE2和AVP V1a受体拮抗剂混合液后,其平均放电变化依然无明显改变(n=2,P=0.921),说明AVP和AVP V1a受体拮抗剂对这类神经元的活性无明显影响(图4A和图4C)。

图2 AVP通过V1a受体反转了PGE2引起的大鼠视前区冷敏神经元自发放电频率增加
注:A:PGE2激活的冷敏神经元在加入AVP和PGE2混合液以及AVP、PGE2和V1aant混合液后的典型放电改变图;B:PGE2激活的冷敏神经元加入PGE2后的平均放电频率改变;C:PGE2激活的冷敏神经元分别加入PGE2、AVP和PGE2混合液以及AVP、PGE2和AVP V1a受体拮抗剂混合液后的平均放电变化;*P<0.05

图3 AVP和V1a受体拮抗剂无法改变PGE2引起的大鼠视前区冷敏神经元放电频率降低
注:A:PGE2抑制的冷敏神经元在加入AVP和PGE2混合液以及AVP、PGE2和V1aant混合液后的典型放电改变图;B:PGE2抑制的冷敏神经元加入PGE2的平均放电频率改变;C:PGE2抑制的冷敏神经元分别加入PGE2、AVP和PGE2混合液,以及AVP、PGE2和V1aant混合液后的平均放电变化

图4 AVP和V1a受体拮抗剂无法影响对PGE2无响应的大鼠视前区冷敏神经元的放电频率
注:A:对PGE2无响应的冷敏神经元在加入AVP和PGE2混合液以及AVP、PGE2和V1aant混合液后的典型放电改变图;B:对PGE2无响应的冷敏神经元加入PGE2前后的平均放电频率;C:对PGE2无响应的冷敏神经元分别加入PGE2、AVP和PGE2混合液,以及AVP、PGE2和V1aant混合液后的平均放电变化
3 讨论
发热是机体面临感染时的一种防御性体温升高,脂多糖引起的发热主要是由致热因子PGE2介导。研究[12]发现,往视前区微量注射PGE2可以引起发热反应,而选择性地删除视前区的PGE2EP3受体基因,可以阻断大多数PGE2和脂多糖引起的发热,提示PGE2通过影响视前区神经元活性介导脂多糖引起的发热。本实验首先观察了PGE2对视前区冷敏神经元活性的影响,结果表明,PGE2可以增加冷敏神经元的放电频率,这与早年Gordon等[8]研究的结果相似,但他们记录到冷敏神经元放电频率增加的比例和增加的幅度都比本实验的结果高。本实验在大鼠视前区脑片上用全细胞膜片钳记录方式发现,PGE2能够使61.5%(8/13)的冷敏神经元放电频率增加,且平均增幅为(69.6±39.7)%;而他们在未麻醉的新西兰兔上,用细胞外记录方式发现PGE2能够增加83.3%(5/6)的冷敏神经元的放电频率,且平均增幅高达(190±88)%。引起这些差异的原因可能与实验所用的动物种类或神经元放电记录方式不同有关。视前区的温度敏感神经元可以整合来自外周和下丘脑局部的温度信号,并进一步通过下行通路控制机体的产热或散热反应,因而在体温调节中发挥了重要作用[5]。目前,有研究[5-6]认为,激活热敏神经元可以引起产热减少、散热增加,而激活冷敏神经元则可能引起产热增加、散热减少。因此,PGE2增加冷敏神经元的活性可能有助于其引起发热效应,而AVP能够反转PGE2引起的视前区冷敏神经元活性增强则可能有助于AVP发挥退热效应。
AVP主要由下丘脑视上核、室旁核合成。研究[13-14]表明,腹腔注射脂多糖、体核温度上升均可引起室旁核的AVP能神经元释放AVP。另一方面,视前区被大量可能源自室旁核的AVP免疫反应阳性纤维支配[15]。此前研究[10]发现,AVP能够对抗PGE2引起的大鼠内侧视前区热敏和温度不敏感神经元活性改变。本实验又进一步证明了,AVP还能够反转PGE2引起的视前区冷敏神经元活性增强。这就提示,在发热的时候AVP很可能从室旁核释放到视前区,然后在此对抗PGE2引起的视前区温度敏感和温度不敏感神经元活性改变,以此对抗PGE2的致热作用。与这个理论一致,电生理刺激室旁核可以减弱脂多糖引起的发热效应[2];此外,激活室旁核的神经元可以反转视前区微量注射PGE2引起的棕色脂肪组织产热增加[16]。这些资料表明,AVP很有可能通过对抗PGE2对视前区神经元的作用参与机体的内源性退热和发热上限的形成。
AVP主要有V1a、V1b、V23种不同的受体,其中V1a受体在中枢表达最为广泛,AVP的一些中枢功能也多由其介导[1]。V1a受体在视前区也有大量表达[17]。以前研究[9]表明,AVP V1a受体参与调控了视前区冷敏神经元的紧张性放电,最近又发现V1a受体介导了AVP对PGE2引起内侧视前区热敏和温度不敏感神经元活性改变的对抗作用[10]。因此,猜测AVP对PGE2引起冷敏神经元活性增强的反转作用很可能也是由V1a受体介导的。结果与设想一致,此次实验发现V1a受体拮抗剂阻断了AVP对PGE2引起视前区冷敏神经元改变的影响,说明AVP确实通过V1a受体反转了PGE2对视前区冷敏神经元的作用。与本实验结果一致的是,Kovacs等[18]发现,应用V1a受体拮抗剂可以阻断中枢应用AVP引起的退热作用,说明中枢应用AVP引起的退热作用是由V1a受体介导的。这就提示AVP的退热效应可能与AVP通过V1a受体反转PGE2引起的视前区冷敏神经元活性增强有关。由于本实验并未应用药物阻断突触传递,所以还不清楚AVP与V1a受体结合后是通过影响突触传递还是通过直接影响视前区神经元的细胞膜电生理特性来反转PGE2引起的视前区冷敏神经元活性改变,这个问题将会在下一步的研究中去确认。
在此次实验中,还发现有15.4%(2/13)的冷敏神经元对PGE2并无响应,23.1%(3/13)的冷敏神经元在加入PGE2后活性下降。此前也有学者[19]在大鼠视前区脑片上用细胞外记录方式记录到了3个冷敏神经元对PGE2的响应,发现PGE2仅增加其中1个冷敏神经元的放电频率,其余2个冷敏神经元对PGE2并无响应。这就提示冷敏神经元中存在着不同的亚型,这些对PGE2有着不同响应的冷敏神经元有可能在PGE2介导的发热进程中发挥了不同的作用。此外,本实验结果表明,AVP和V1a受体拮抗剂均无法影响PGE2对这些冷敏神经元的作用,提示这两类冷敏神经有可能并未参与AVP的退热作用。
综上所述,本研究主要应用全细胞膜片钳技术发现,PGE2增加了61.5%的冷敏神经元的放电频率,平均增幅为(69.6±39.7)%;AVP可以反转PGE2引起的冷敏神经元放电频率上升;AVP V1a受体介导了AVP的这个作用。这些结果可能为AVP退热的中枢机制提供了新的证据。
[1]Koshimizu T A, Nakamura K, Egashira N,etal. Vasopressin V1aand V1b receptors: from molecules to physiological systems[J]. Physiol Rev, 2012, 92(4): 1813-1864.
[2]Roth J. Endogenous antipyretics[J]. Clin Chim Acta, 2006, 371(1/2): 13-24.
[3]Yang Y L, Liu X, Luo R,etal. Sinoaortic denervation attenuates vasopressin-induced hypothermia and reduction of sympathetic nerve activity innervating brown adipose tissue in rats[J]. J Therm Biol, 2017, 66: 10-16.
[4]李博萍, 孟立, 罗蓉, 等. 精氨酸加压素翻转脂多糖引起大鼠发热及其对痛觉敏感性的影响[J]. 中国病理生理杂志, 2017, 33(4): 635-639.
[5]Boulant J A. Neuronal basis of Hammel's model for set-point thermoregulation[J]. J Appl Physiol, 2006, 100(4): 1347-1354.
[6]Morrison S F. Central neural control of thermoregulation and brown adipose tissue[J]. Auton Neurosci, 2016, 196: 14-24.
[7]Ranels H J, Griffin J D. The effects of prostaglandin E2on the firing rate activity of thermosensitive and temperature insensitive neurons in the ventromedial preoptic area of the rat hypothalamus[J]. Brain Res, 2003, 964(1): 42-50.
[8]Gordon C J, Heath J E. Effects of prostaglandin E2on the activity of thermosensitive and insensitive single units in the preoptic/anterior hypothalamus of unanesthetized rabbits[J]. Brain Res, 1980, 183(1): 113-121.
[9]Tang Y, Yang Y L, Wang N,etal. Effects of arginine vasopressin on firing activity and thermosensitivity of rat PO/AH area neurons[J]. Neuroscience, 2012, 219: 10-22.
[10] Xu J H, Hou X Y, Tang Y,etal. Arginine vasopressin antagonizes the effects of prostaglandin E2on the spontaneous activity of warm-sensitive and temperature-insensitive neurons in the medial preoptic area in rats[J]. Neurosci Lett, 2018, 662: 59-64.
[11] Wright C L, Burgoon P W, Bishop G A,etal. Cyclic GMP alters the firing rate and thermosensitivity of hypothalamic neurons[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294(5): R1704-R1715.
[12] Nakamura K. Central circuitries for body temperature regulation and fever[J]. Am J Physiol Regul Integr Comp Physiol, 2011, 301(5): R1207-R1228.
[13] Xu S, Guo S, Jiang X,etal. Effect of indomethacin on the c-fos expression in AVP and TH neurons in rat brain induced by lipopolysaccharide[J]. Brain Res, 2003, 966(1): 13-18.
[14] Sharif-Naeini R, Ciura S, Bourque C W. TRPV1 gene required for thermosensory transduction and anticipatory secretion from vasopressin neurons during hyperthermia[J]. Neuron, 2008, 58(2): 179-185.
[15] Rood B D, De Vries G J. Vasopressin innervation of the mouse (Mus musculus) brain and spinal cord[J]. J Comp Neurol, 2011, 519(12): 2434-2474.
[16] Madden C J, Morrison S F. Neurons in the paraventricular nucleus of the hypothalamus inhibit sympathetic outflow to brown adipose tissue[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 296(3): R831-R843.
[18] Kovacs G L, Baars A M, De Wied D. Antipyretic effect of central arginine8-vasopressin treatment: V1 receptors specifically involved[J]. Life Sci, 1992, 50(21): 1625-1630.
[19] Watanabe T, Morimoto A, Murakami N. Effect of PGE2on preoptic and anterior hypothalamic neurons using brain slice preparation[J]. J Appl Physiol, 1987, 63(3): 918-922.

