小分子热休克蛋白Hsp16.3参与介导结核分枝杆菌致巨噬细胞凋亡的研究进展
黄丹丹
川北医学院基础医学院,四川南充 637007
结核病是世界范围内亟待解决的问题之一[1]。虽然目前联合药物治疗对结核病的蔓延有一定抑制作用,但结核病仍然是全球造成死亡的十大疾病之一。相关学者通过对感染结核分枝杆菌(MTB)的肺巨噬细胞进行蛋白质组学分析,发现在235种蛋白质中,绝大多数异常表达的蛋白质都参与细胞凋亡、氧化磷酸化等生物学过程,证实了细胞凋亡在结核病的发生发展过程中扮演了重要的角色[2]。但另一方面,大量研究表明,MTB感染巨噬细胞后,可延缓凋亡途径[3-4]。Jee B等证实,在小分子热休克蛋白家族中,Hsp16.3可介导MTB在巨噬细胞内稳定生长,并延迟、减少巨噬细胞凋亡[5]。因此,明确Hsp16.3在MTB中的具体作用,以及其对巨噬细胞凋亡的影响和具体机制,对临床靶向治疗药物开发具有重要意义。
1 Hsp16.3蛋白分子结构及功能
Hsp16.3分布于MTB,由144个氨基酸组成,分子量约为16kDa,与ESAT6、CFP10等并称为Mtb相关抗原。正常情况下,细胞内少有或检测不到该蛋白表达。Hsp16.3可与巨噬细胞内蛋白结合,抑制巨噬细胞凋亡,从而增加Mtb的细菌内稳定性与生存率。Hsp16.3的C端由3部分组成,分别为C端尾(CTT),IXI模体与C端扩展区(CTE)。CTE主要介导蛋白低聚化解离与辅助增强Hsp16.3的分子伴侣功能。
Alok Kumar Panda等通过CTE基因敲除发现,CTE敲除后蛋白低聚化解离活性与Hsp16.3的分子伴侣功能均有所降低。见图1。
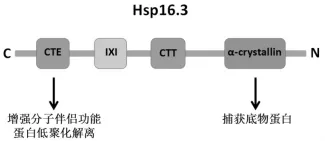
图1 Hsp16.3蛋白分子结构及功能
2 Hsp16.3介导MTB致巨噬细胞凋亡的作用及其发生机制
2.1 Hsp16.3介导MTB致巨噬细胞凋亡的作用
巨噬细胞凋亡是机体自我防御机制之一,其可有效促进MTB抗原暴露,向树突状细胞提成抗原,并促进T细胞活化,诱导免疫应答。巨噬细胞凋亡还能抑制MTB在体内的播散,激活未感染巨噬细胞,增强机体对MTB的杀伤力。在感染晚期,MTB增殖数量增多,MTB自身毒力因子、毒素等分泌增强,均可增加MTB抗凋亡能力,延缓巨噬细胞凋亡进程。
Hsp16.3可抑制巨噬细胞凋亡,增加Mtb的细菌内稳定性与存活率。庹清章等证实,在MTB感染早期、晚期,Hsp16.3的表达可有效抑制巨噬细胞凋亡。庹清章等[6]建立小鼠的感染模型,将MTB H37Rv Hsp16.3基因缺失强毒株注入小鼠体内,并与对照组比较,发现在感染早期、晚期,巨噬细胞凋亡率Hsp16.3基因未缺失组较Hsp16.3基因缺失组显著增高,且Bcl-2与Caspase-3也有显著增高。说明在MTB感染早期、晚期,Hsp16.3的表达可有效抑制巨噬细胞凋亡。刘云霞等[7]通过流式细胞技术发现,MTB感染巨噬细胞后,巨噬细胞内Hsp16.3蛋白表达增多。姚楠等[8]进一步研究发现,MTB致巨噬细胞凋亡的程度与Hsp16.3蛋白表达水平与MTB菌株毒力有关。MTB菌株毒力较弱时,巨噬细胞易发生早期凋亡。Hsp16.3蛋白表达水平较高且MTB菌株毒力较强时,巨噬细胞凋亡显著减少。在MTB隐性感染中,Hsp16.3也介导了MTB在细菌内稳定繁殖与免疫力低下时MTB激活。此外,Shi CH等[9]发现Hsp16.3蛋白可显著增高MTB菌落形成单位的数量,进一步证实Hsp16.3蛋白对MTB生长繁殖的重要性。
2.2 Hsp16.3介导MTB致巨噬细胞凋亡的机制
Hsp16.3介导MTB致巨噬细胞凋亡的机制目前尚不十分清楚,该进展归纳总结了4种可能的调控机制,见图2。
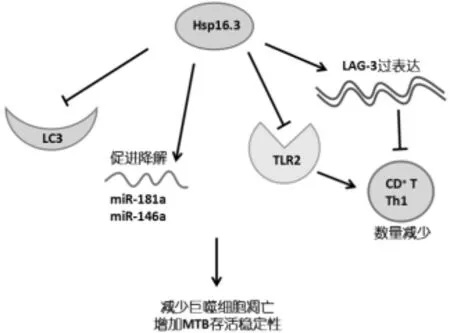
图2 Hsp16.3介导MTB致巨噬细胞凋亡的机制
2.2.1 Hsp16.3抑制微管结合蛋白LC3的表达 Shi CH等[9]证实,Hsp16.3抑制微管结合蛋白LC3的表达,进一步影响细胞凋亡的过程。LC3在细胞自噬或凋亡过程中具有识别与连接作用,当自噬或凋亡过程发生时LC3蛋白转变成LC3-II,并介导溶酶体与细胞识别,促进凋亡过程。Hsp16.3抑制LC3表达后,细胞质量控制(Quality Control)出现异常,巨噬细胞凋亡过程显著下降[10]。
2.2.2 Hsp16.3促进miR-181a与miR-146a降解Qing-Lin Meng等[11]利用U937细胞系作为体外巨噬细胞模型,通过对MTB感染巨噬细胞中mRNA种类与含量进行分析,发现Hsp16.3可抑制miR-181a与miR-146a,并促进已产生的miR-181a与miR-146a降解。从而直接参与MTB的免疫逃避过程。
2.2.3 Hsp16.3抑制TLR2表达及其正常作用 Haibo Su等[12]发现Rv2029c可通过TLR2介导的下游通路增加MHC-II的表达,进一步刺激CD4+T细胞活化与凋亡的形成。在MTB感染的巨噬细胞中,此通路可被Hsp16.3抑制,减少T细胞活化与凋亡的早期形成。
2.2.4 Hsp16.3促进LAG3过表达 此外,淋巴细胞活化基因3(LAG3)过表达时,CD4+T细胞介导的Th1细胞免疫应答显著减少,并加剧MTB在细胞内繁殖。Hsp16.3参与介导了LAG3的过表达,且与LAG3对细胞内MTB繁殖有协同作用[11]。
3 Hsp16.3临床应用前景
3.1 Hsp16.3相关分子早期检测
TLR2/TLR12介导的下游通路可增加MHC-II的表达,进一步刺激CD4+T细胞活化与凋亡的形成,在MTB感染的巨噬细胞中,Hsp16.3表达增多,并可抑制TLR2,使TLR2表达处在较低水平。 Qing-Lin Meng等利用U937细胞系作为体外巨噬细胞模型,通过对MTB感染巨噬细胞中mRNA种类与含量进行分析,发现miR-93-3p在巨噬细胞感染后显著下降,且在隐性感染模型中也可检测到含量变化。以上结果提示,TLR2/TLR12,Caspase-3,Bcl-2,TNFα,miR-93-3p可作为早期MTB感染的检测指标[13]。
3.2 靶向药物开发
如前所述,Hsp16.3表达增多时,可抑制TLR2,使TLR2表达处在较低水平。增加TLR2表达可作为MTB治疗靶点之一。刘红艳等[14]发现miR-19b沉默可上调TLR2表达,进一步促进MTB诱导的大鼠肺泡巨噬细胞凋亡。此外,Yongyan Wu等[15]证实Sp110可与Hsp16.3结合,阻断Hsp16.3与细胞内分子的结合,释放凋亡相关分子,使凋亡过程回到正常水平。另一方面,Sp110可与核糖体蛋白Rps3a结合,上调前凋亡聚合酶(PARP)表达水平,进一步促感染细胞凋亡。 以上结果提示,TLR2,miR-19b,Sp110 可作为MTB治疗靶点。
3.3 Hsp16.3疫苗研发
Geluk等发现,单独注射卡介苗并不能增强T细胞针对Hsp16.3的免疫应答作用,使疫苗在针对部分静止期胞内寄生MTB或隐形感染患者时大大减少[16]。C.Shi等发现,将Hsp16.3或其合成肽注入小鼠时,细胞免疫与体液免疫均较注射卡界面有所增强,且MTB增值有所减缓。实验结果提示,将Hsp16.3或其合成肽设计成疫苗,可能会刺激机体产生更有效的免疫应答[17]。
4 展望
该研究进展通过对Hsp16.3介导MTB致巨噬细胞凋亡作用及其发生机制的相关文献进行梳理,总结出 LC3,miR-181a、miR-146a,TLR2 与 LAG3 等 4 条可能的通路,并针对Hsp16.3提出早期分子检测、靶向药物开发、Hsp16.3疫苗研发等临床应用意见,以期为临床治疗提供帮助指导。但上述凋亡相关通路还需进一步阐明详细机制,Hsp16.3相关分子检测技术、临床用药、新型疫苗还有待进一步临床试验。
[1]屈野,殷瑛,李浩,等.MTB分泌蛋白ESAT-6对小鼠巨噬细胞凋亡的诱导作用[J].武警后勤学院学报:医学版,2014,23(1):1-5.
[2]何玉龙,张文清,何承文,等.MTBBCG和H37Ra对巨噬细胞凋亡的影响及其机制研究[J].农业生物技术学报,2015,23(5):571-578.
[3]师清博,赵明明,王春凤,等.MTB感染与巨噬细胞凋亡的免疫机制研究进展[J].中国兽医学报,2017,37(9):1811-1816.
[4]于翔,陆佳嘉,王秦,等.巨噬细胞凋亡对MTB感染的机制研究进展[J].现代生物医学进展,2014,14(5):972-977.
[5]Jee B,Katoch VM,Awasthi SK.Dissection of relationship between small heat shock proteins and mycobacterial diseases[J].Indian J Lepr,2008,80(3):231-245.
[6]庹清章,张万江.MTB感染中巨噬细胞凋亡的研究进展[J].中国人兽共患病学报,2012,28(5):496-499.
[7]刘云霞,董伟杰,庹清章,等.MTBHsp16.3对感染巨噬细胞凋亡的影响[J].石河子大学学报:自然科学版,2013,31(5):597-600.
[8]姚楠,董江涛,徐芳,等.MTBHsp16.3与感染巨噬细胞凋亡的相关性研究 [J].中国病原生物学杂志,2012,7(8):569-573.
[9]Shi CH,Jiang Y,Zhao Y,et al.Effects of Mycobacterium tuberculosis Hsp16.3 protein on the autophagy function of mice macrophages[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2011,27(12):1301-1303.
[10]Liu H,Dai C,Fan Y,et al.From autophagy to mitophagy:the roles of P62 in neurodegenerative diseases[J].J Bioenerg Biomembr,2017,49(5):413-422.
[11]Meng Q L,Liu F,Yang X Y,et al.Identification of latent tuberculosis infection-related microRNAs in human U937 macrophages expressing Mycobacterium tuberculosis Hsp16.3[J].BMC Microbiol,2014,14:37.
[12]Su H,Zhu S,Zhu L,et al.Mycobacterium tuberculosis Latent Antigen Rv2029c from the Multistage DNA Vaccine A39 Drives TH1 Responses via TLR-mediated Macrophage Activation[J].Front Microbiol,2017,8:2266.
[13]Phillips BL,Gautam US,Bucsan AN,et al.LAG-3 potentiates the survival of Mycobacterium tuberculosis in host phagocytes by modulating mitochondrial signaling in an in-vitro granuloma model[J].PLoS One,2017,12(9):e0180413.
[14]刘红艳.MicroRNA-19b对强毒力结核分枝杆菌诱导的大鼠肺泡巨噬细胞凋亡的影响及其机制[J].现代医学,2016,44(7):952-957.
[15]Wu Y,Guo Z,Liu F,et al.Sp110 enhances macrophage resistance to Mycobacterium tuberculosis via inducing endoplasmic reticulum stress and inhibiting anti-apoptotic factors[J].Oncotarget,2017,8(38):64050-64065.
[16]Geluk A,Lin M Y,van Meijgaarden K E,et al.T-cell recognition of the HspX protein of Mycobacterium tuberculosis correlates with latent M.tuberculosis infection but not with M.bovis BCG vaccination[J].Infect Immun,2007,75(6):2914-2921.
[17]Shi C,Zhang H,Zhang T,et al.New alternative vaccine component against mycobacterium tuberculosis--heat shock protein 16.3 or its T-cell epitope[J].Scand J Immunol,2009,70(5):465-474.

