声脉冲辐射力弹性成像技术对不同回声颈动脉粥样斑块的评估价值
姚俊东,张周龙,王运昌
流行病学显示脑血管疾病正在高速持续增长[1-2]。颈动脉粥样斑块(carotid plaque,CP)是颈动脉粥样硬化持续发展的形态表现,与急性缺血性脑卒中患者(cerebral ischemic stroke,CIS)的发生有密切的关系。大的脂质核心是致使CP易损化的三大特性之一,CP内部脂质核心的形成主要是由于CP内部持续性的炎性反应及其所引起的病理性新生血管的破裂并出血,炎性反应、出血区域的质地较软,常规灰阶超声因其自身的局限性[3-4],无法对CP内部的质地进行有效的评估,而声脉冲辐射力弹性成像技术(acoustic radiation force impulse,ARFI)[5-6]是一种新型的超声检查技术,通过探头向人体器官或者组织感兴趣区发射脉冲信号,测量剪切波速度(shear wave velocity,SWV),对其弹性或硬度进行量化分析,感兴趣区质地越硬其SWV就越快,相反SWV值就越慢[7]。本研究将用ARFI技术对CP质地进行量化分析,探究其评估颈动脉斑块易损性的应用情况,现报道如下。
1 资料与方法
1.1对象选择2016年10月至2017年6月于河南科技大学第一附属医院诊治的119例伴有颈动脉粥样斑块的患者为研究对象。纳入标准:①经过MRI证实为急性缺血性脑梗死病变[8];②均行超声心动图检查;③有完整的病例资料。排除标准:①出血性脑梗死[9];②颅内血管畸形、狭窄或闭塞;③心源性梗死[10];④大动脉炎[11];⑤颈动脉中度及以上狭窄患者[12];⑥多器官功能障碍综合征患者。
1.2分组将纳入研究的119例伴有CP的患者,其中男性70人,女性49人,年龄(66.26±11.74)岁,最大者91岁,最小者38岁。按中国医师协会超声医师分会颁布的《血管和浅表器官超声检查指南》[13]将斑块按回声分为低回声(low echo plaque,LP)、等回声(isoechoic plaque,IP)、混合回声(mixed echo plaque,MP)及强回声均质斑块(strong echo plaque,SP)分为LP、IP、MP、SP这4组;另根据MRI证实颅内有、无急性缺血性脑梗死灶的情况,分为有症状组、无症状组,有症状组中男34例,女24例,年龄(65.91±12.65)岁;无症状组中男36例,女25例,年龄(66.75±11.79)岁。
1.3过程使用Siemens Acuson S 2000超声仪器检查,9L4线阵探头,频率为8 MHz。常规超声:在常规颈动脉超声下,观察CP的形态、内部回声,于最大长轴、短轴切面上分别测量长度、厚度。按回声分LP、IP、MP及SP 4组。ARFI测量:在患者平卧休息10 min后,尽量减小颈动脉搏动的影响,调节至ARFI模式,选取斑块长轴切面并予以固定,调节并移动取样框(6 mm×5 mm),使其最大限度包含整个斑块,嘱患者屏气状态后,测量出CP的SWV,为减小误差,每个CP需测量5次,见图1。上述操作过程均需两名高年资医师共同在场并依次测量后取其平均值。
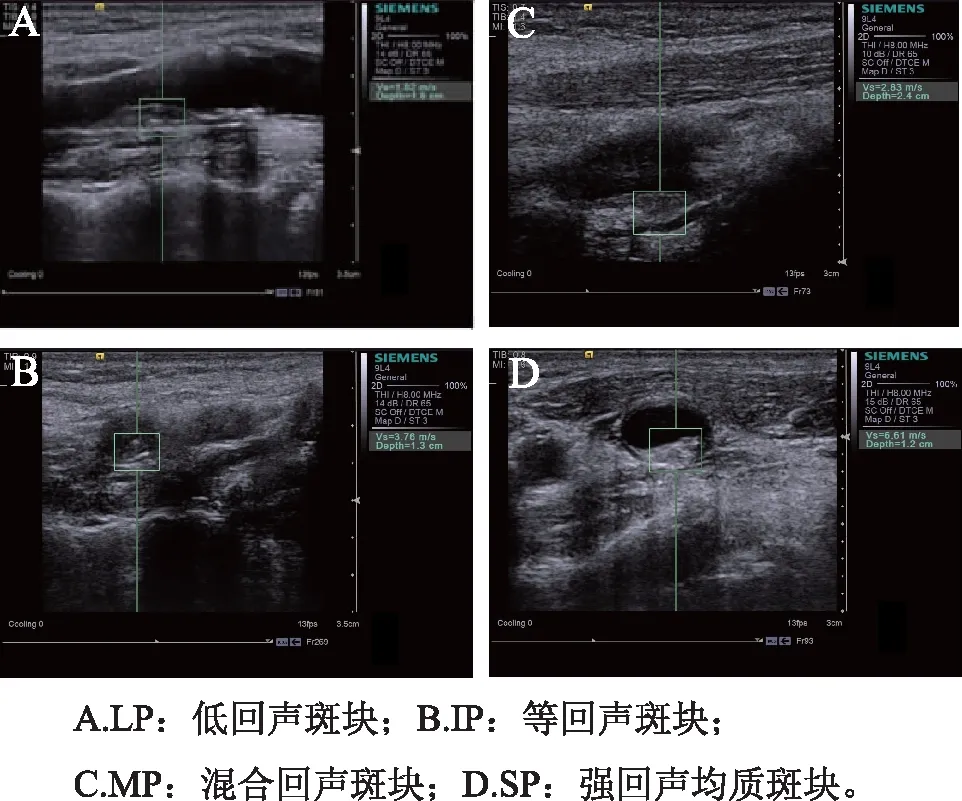
图1 不同回声斑块的超声图像
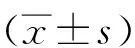
2 结果
2.1一般情况对比将119例患者划分为有症状组58例、无症状组61例,两组的年龄及性别构成差异均无统计学意义(t=0.375,P=0.708;χ2=0.002,P=0.965)。另将119例根据CP回声情况分为LP、IP、MP和SP 4组,各组人数分别为38、27、30和24人。各组年龄及性别构成差异均无统计学意义(F=1.781,P=0.155;χ2=5.251,P=0.154)。
2.2有症状组与无症状组间斑块影像指标对比有症状组CP的SWV(2.15±0.95) m·s-1小于无症状组CP的SWV(3.16±1.31) m·s-1,差异有统计学意义(t=4.848,P=0.00004);无症状组CP的长度、厚度分别为(12.06±6.93) mm、(3.00±0.80) mm,有症状组CP的长度、厚度分别为(13.21±1.08) mm、(2.91±0.97) mm,两组CP的长度及厚度差异无统计学意义(P>0.05),见表1。
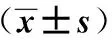
表1 有症状组与无症状组间斑块影像指标对比
注:SWV:剪切波速度。
2.3各回声CP组的症状对比LP、IP、MP及SP组的有症状率分别为63.16%、55.56%、46.67%、20.83%,各组之间症状有、无情况差异有统计学意义(χ2=11.196,P=0.011)。进一步两两比较显示,LP、IP和MP组中的有症状率均高于SP组,差异有统计学意义(P<0.05),见表2。
2.4各回声CP组SWV对比各回声CP组之间的SWV差异有统计学意义(H=110.023,P<0.001),进一步比较显示,LP组的SWV均低于其他3组,差异有统计学意义(P<0.05);IP组、MP组的SWV要低于SP组,差异有统计学意义(P<0.05),MP组的SWV高于IP组,差异有统计学意义(P<0.05),见表2。
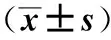
表2 各回声CP组的症状情况对比 例(%)
注:①与LP组比较,P<0.05;②与IP组比较,P<0.05;③与MP组比较,P<0.05。LP:低回声斑块;IP:等回声斑块;MP:混合回声斑块;SP:强回声斑块。
2.5CP的SWV均值与大小均值的相关性分析CP的SWV与长度、厚度之间的相关性均无计学意义(P均>0.05),见表3。

表3 CP的SWV与大小之间的相关性分析
注:LP:低回声斑块;IP:等回声斑块;MP:混合回声斑块;SP:强回声斑块。
3 讨论
WHO研究表明[1-2],我国是脑卒中的高发病率国家,在发病率高、致死率高的背景下,幸存患者中有3/4都伴发不同程度的残疾。在全国范围每年对于本疾病的诊治费用高达百亿元以上,给国家及家庭都带来的严重的经济负担。目前国内外研究认为,CP内部的病理性新生血管及炎症反应程度与自身的稳定性以及脑卒中的发生息息相关,炎症反应程度高的区域中巨噬细胞及其所分泌的金属蛋白酶含量较高,致使这一区域的质地较软,而病理性新生血管容易破裂出血,并且其周边往往伴随着高程度的炎性反应,这一区域的质地亦较软[14-16]。
常规超声具有操作简便、安全无创、可重复性高的优点,在临床上被广泛应用,但是在评估CP稳定性时,其观察的是CP的局部断面,无法在一张切面上准确显示CP的立体空间形态结构,评估斑块的大小、内部质地结构、管腔的狭窄程度等[17]。同时受检查者主观判断及手法影响,检查结果差异较大,重复性较低,从而大大影响其评估CP稳定性的临床价值[2]。
ARFI是新型超声诊断技术[5-6],通过探头向人体组织或者器官的内部感兴趣区域发射脉冲信号,在其局部发生形变后,检测由形变而产生的横向的SWV,从而量化分析该区域的弹性或硬度,SWV值与组织的硬度呈正比例关系[7],为评估CP的稳定性拓展了新的研究领域。
在目前国内ARFI技术广泛应用于乳腺[18]、甲状腺[19]良恶性结节鉴别、肝纤维化分级[20]及慢性肾炎[21]领域,而应用AFRI技术无创性的评估CP稳定性是少有的。本研究共纳入119例患者,先后应用常规超声和ARFI技术对CP进行量化评估,所得结果经分析显示,对于各回声组CP的SWV均值,根据组织感兴趣区的SWV值与其弹性系数成反比的研究结果,CP的硬度为LP
综上所述,ARFI技术对CP内部的质地有一定的评估价值,虽然ARFI技术在测量CP的SWV时,容易受到呼吸、颈动脉搏动因素影响以及ROI取样框大小不可调节的限制,致使部分厚度较薄的CP结果差异较大,但因价格低廉、操作简便快捷,能够为CP的易损性进行初步的量化分析,值得在临床推广应用。
参考文献:
[1] 中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组.中国缺血性脑和短暂性脑缺血发作二级预防指南2010[J].中国临床医生杂志,2011,48(11):154-160.
[2] 张全成,李俊平.职业人群心脑血管疾病患病率及影响因素分析[J].现代预防医学,2014,41(5):785-788.
[3] ten Kate GL,Sijbrands EJ,Staub D,et al.Noninvasive imaging of the vulnerable atherosclerotic plaque[J].Curr Prob Cardiol,2010,35(11):556-591.
[4] 吕蕾,李怡,鲍海华,等.比较影像学在颈动脉斑块评估中的研究进展[J].山东医药,2016,56(17):101-104.
[5] 郝轶,柳莉莎.超声弹性成像技术及其临床应用[J].医学综述,2010,16(3):453-455.
[6] 孙渭玲,严碧歌,马磊.超声弹性成像技术及其应用[J].现代生物医学进展,2007,7(9):1411-1413.
[7] 张志伟,钱雪松.ACUSON S2000彩色多普勒超声诊断仪ARFI技术原理及临床应用[J].医疗卫生装备,2012,33 (8):125-126.
[8] 高聚,姜华,肖展翅.急性期缺血性脑梗塞患者CT与MRI检查结果比较分析[J].中国CT和MRI杂志,2017,15(3):30-32.
[9] 张振宇.核磁共振成像在出血性脑梗死中的临床诊断价值分析[J].医学理论与实践,2017, 30(7):1047-1048.
[10]罗伟权,黄志勇.经食道心脏超声在心源性栓塞性脑梗死诊断中的应用[J].中国当代医药,2013,20(22):102-103.
[11]江毅卿,宋水江,洪卫军.大动脉炎致脑梗死临床分析[J].临床内科杂志,2010,27(10):683-684..
[12]米国青,薛满忠,马洪颖,等.颈动脉狭窄性短暂性脑缺血进展脑梗死的相关危险因素分析[J].中西医结合心脑血管病杂志,2017,15(9):1110-1113.
[13]中国医师协会超声医师分会.血管和浅表器官超声检查指南[M].北京:人民军医出版社,2011:26.
[14]Gujral DM,Shah BN,Bhattacharyya S,et al.Contrast enhanced-ultrasound to assess plaque neovascularization in irradiated carotid arteries[J].Int J Cardiol,2016,202(11):3-4.
[15]栗静,田婷,石正洪,等.急性缺血性卒中患者颈动脉易损性斑块的临床分布特点及危险因素分析[J].解放军医学杂志,2016,41(9):740-745.
[16]吴国斌,严臻泉,史万英,等.颈动脉斑块形成相关危险因素的临床研究[J].河北医药,2014,36(10):1501-1503.
[17]张艳.缺血性脑卒中和颈动脉粥样硬化的相关性及超声影像学分析[J].中国实用神经疾病杂志,2013,16(15):25-26.
[18]高维强, 张周龙. 超声弹性成像与彩色能量多普勒在鉴别乳腺肿块中的临床应用[J]. 河南科技大学学报(医学版), 2012, 30(1):35-36.
[19]陈璐,陈悦,陈林,等.超声弹性面积比值法与声脉冲辐射力成像鉴别诊断甲状腺结节的对比研究[J].中国超声医学杂志,2013,29(9):772-774.
[20]闫荟同,唐文博,宋欣,等.声脉冲辐射力成像评价肝占位患者肝纤维化与病理对照研究[J].中国医学影像学杂志,2013,21(5):367-369.
[21]胡巧,王小燕,康利克,等.声脉冲辐射力弹性成像定量评价早期慢性肾小球肾炎的价值[J].广东医学,2014,35(4):520-523.
[22]Grufman H,Schiopu A,Edsfeldt A,et al.Evidence for altered inflammatory and repair responses in symptomatic arotid plaques from elderly patients[J].Atherosclerosis,2014,237(1):177-182.
[23]吴国斌,严臻泉,朱明,等.颈动脉斑块与缺血性脑卒中危险因素分析[J].河北医科大学学报,2015,36(1):91-93.
[24]樊荣,冯建钦,郭倩倩,等.剪切波弹性成像用于动脉粥样斑块组织成分定征及易损性评价的实验研究[J].中华超声影像学杂志,2015,24(5):429-434.
[25]薛红元,叶玉泉,高丽,等.应用超声造影技术对不同厚度颈动脉斑块内新生血管的评价[J]. 中国超声医学杂志, 2016, 32(6):491-493.

