大黄酚对局灶性脑缺血再灌注小鼠脑组织p-CREB、BDNF和p-STAT3的影响
房亚兰 黄语悠 赵咏梅* 李锦程 段云霞 高 利 罗玉敏
(1.北京市平谷区医院全科医疗科,北京 101200;2. 首都医科大学宣武医院 北京市老年病医疗研究中心,北京 100053)
缺血性卒中严重威胁人类健康,目前已成为我国国民死亡的首要原因[1]。然而临床上治疗脑缺血的药物非常有限,唯一有效的治疗方法是在有限的时间窗内应用重组组织型纤溶酶原激活剂进行溶栓。中药大黄在我国用于治疗脑缺血损伤由来已久,大黄酚(chrysophanol, CHR)是自大黄中提取的一种活性成分[2],近年来的研究[2-4]表明,CHR能显著减少脑缺血再灌注损伤,但其相关神经保护机制尚不完全清楚。
环磷酸腺苷反应元件结合蛋白(cyclic AMP response element binding protein,CREB)是细胞核内的一种转录因子,其磷酸化程度与细胞对缺氧导致死亡的耐受性相关[5-6]。研究[7]表明,脑缺血损伤抑制磷酸化CREB(phosphorylated CREB,p-CREB)产生。给予永久性大脑中动脉梗死(middle cerebral artery occlusion, MCAO)小鼠西洛他唑治疗后,神经元内p-CREB蛋白表达增加,细胞凋亡减少,脑梗死体积显著减小[5]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是CREB的下游调控因子,作为大脑发育过程及成人期的主要神经营养因子,广泛分布于大脑皮质、海马和纹状体,能促进神经功能恢复,在脑缺血损伤中发挥神经保护作用[8]。给予脑缺血再灌注大鼠三七皂甙R1治疗可能通过上调BDNF基因在海马的表达水平,增加抗凋亡因子表达,从而保护脑缺血再灌注大鼠的海马神经元,减少脑梗死体积[9]。
p-CREB和BDNF在脑缺血动物模型和脑缺血患者中表达失调,与脑缺血损伤密切相关,被认为是未来治疗脑缺血的重要靶点[10]。转录激活因子3(signal transducer and activator of transcription 3, STAT3)是一种广泛存在于中枢神经系统的DNA结合蛋白,在信号转导和转录过程中发挥重要作用。有文献[11]报道,STAT3联结BDNF后可发挥神经可塑性。磷酸化STAT3(phosphorylated STAT3,p-STAT3)是STAT3的激活形式,p-STAT3参与脑缺血损伤的细胞死亡、凋亡过程[12]。研究[13]表明,在脑缺血再灌注大鼠的缺血侧海马组织,p-STAT3显著增加。因此,本研究采用 MCAO再灌注模型小鼠,观察CHR对脑缺血小鼠再灌注后14 d CREB、BDNF和p-STAT3表达的影响,从而进一步探讨CHR长期拮抗脑缺血再灌注损伤的机制。
1 材料与方法
1.1 主要仪器设备
麻醉机(Harvard Apparatus公司,美国)、小动物手术显微镜(Carl Zeiss公司,德国)、双极电凝器(天业德威医疗设备有限公司)、反馈式温度调节仪(CMA 150, Carnegie Medicin公司,瑞典)、荧光显微镜(Nikon公司,日本)。
1.2 试剂
CHR(中国食品药品检定研究院);Tween 80(Sigma公司,美国);恩氟烷(河北一品制药有限公司); p-CREB抗体(北京中杉金桥公司);BDNF抗体(Abcam公司,美国);NeuN抗体(Millipore公司,美国);p-STAT3抗体(CST公司,美国);β-actin抗体(Santa cruz公司,美国)等。
1.3 实验动物及分组
2月龄C57BL健康雄性小鼠,体质量(23.5±1)g,实验动物许可证号:SCXK(京) 2012-0001(北京维通利华实验动物公司),饲养于SPF级动物实验室。按照数字表法随机将18只小鼠分为3组(每组6只):假手术(Sham)组、MCAO组、CHR组。CHR溶于含1%(体积分数)Tween 80和1%(体积分数)DMSO的0.9%(质量分数)氯化钠注射液中,从造模当天至再灌注后14 d,CHR组小鼠按0.1 mg/kg腹腔注射CHR,每天1次, Sham组和MCAO组小鼠腹腔注射同等体积的含1%(体积分数) Tween 80和1%(体积分数) DMSO的0.9%(质量分数)氯化钠注射液。
1.4 动物模型制作
MCAO模型按改良ZeaLonga法制备。将恩氟烷混合于70%(体积分数)N2O和30%(体积分数)O2中,先用5%(体积分数)恩氟烷诱导麻醉,再用面罩吸入2%(体积分数)恩氟烷维持麻醉。于小鼠颈部沿正中线切口,分离右侧颈总动脉、颈内动脉及颈外动脉,将头端直径0.38 mm的尼龙线栓由颈外动脉残端插入颈内动脉,至颈外动脉和颈内动脉分叉约1 cm处。手术过程中使用反馈性控温毯监测实验小鼠肛温,维持在(37.0±0.5) ℃。缺血45 min后,小心地将线栓拔出进行再灌注。术后小鼠饲养于SPF级动物实验室,自由进食饮水。
1.5 免疫荧光双标
于造模后14 d,各组小鼠经腹腔注射水合氯醛麻醉后,快速断头取脑,经4%(质量分数)多聚甲醛固定48 h后,于30%(质量分数)蔗糖脱水24 h,将脑组织行连续冰冻切片(厚度为20 μm),切片经PBS洗后,用含0.2%(体积分数)TritonX-100的PBS孵育10 min,再经PBS洗后,于室温下用5 %(体积分数)山羊血清封闭30 min,滴加一抗(p-CREB与NeuN鼠多克隆抗体 1∶300,或BDNF与NeuN鼠多克隆抗体 1∶300),4 ℃孵育过夜。次日取出切片,经PBS洗后,滴加山羊抗鼠和山羊抗兔荧光二抗(1∶300),避光于室温下孵育1 h。经PBS洗后,最后用含DAPI(4′,6-diamidino-2-phenylindole)的封片剂进行封片。于荧光显微镜下观察脑皮质缺血半暗带区[14]。每组选取5只小鼠同一位置的脑切片3张,在相同放大倍数、相同参数条件下,每张脑组织冰冻切片随机选取4个视野照相,使用NIS Element软件统计p-CREB和BDNF阳性细胞数目。
1.6 Western blotting
再灌注14 d后,各组小鼠快速断头取脑,立即于前囟0到-0.1切取1 mm厚的脑组织冠状切片,将缺血侧脑组织在含有蛋白酶抑制剂的裂解缓冲液中于冰上匀浆,经30 min冰浴后,4 ℃条件下12 000 g离心30 min取上清。用BCA法进行蛋白浓度测定。将上样缓冲液加入样品煮沸10 min,然后进行SDS-PAGE电泳,湿转法转膜90 min,于5%(质量分数)脱脂牛奶室温下封闭1 h,加入一抗(p-STAT3 1∶1 000,β-actin 1:1 000),4 ℃孵育过夜,用TBST洗膜3次,室温下于HRP标记的二抗中孵育1 h,TBST洗膜3次,用ECL化学发光液显色,并用化学发光系统扫描,蛋白条带用Image J图像处理软件进行定量分析。
1.7 统计学方法
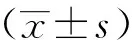
2 结果
2.1 CHR促进MCAO小鼠脑缺血半暗带区p-CREB表达
免疫荧光染色结果显示,Sham组小鼠脑组织内可见p-CREB红色荧光染色,而MCAO组小鼠脑缺血半暗带区p-CREB染色阳性细胞显著减少,CHR组小鼠脑缺血半暗带区p-CREB染色阳性细胞数目比MCAO组显著增加(图1 A),差异具有统计学意义(P<0.05,图1 B)。免疫荧光双标染色结果可见,在MCAO小鼠脑缺血半暗带区内可见p-CREB阳性细胞及NeuN阳性细胞,其中p-CREB阳性细胞为红色荧光,NeuN阳性细胞为绿色荧光。所有细胞的胞核为蓝色荧光。图像合并后,绿色与红色荧光重合,表明p-CREB与神经元共定位,即脑缺血再灌注后p-CREB在缺血半暗带区神经元内表达(图1 A)。
2.2 CHR促进MCAO小鼠脑缺血半暗带区BDNF表达
免疫荧光染色结果显示,Sham组小鼠脑组织内可见BDNF红色荧光染色,分布于大脑皮质、海马及纹状体,MCAO组小鼠脑缺血半暗带区BDNF染色阳性细胞比Sham组明显减少,CHR组小鼠脑缺血半暗带区BDNF的表达比MCAO组明显增加(图2 A),差异具有统计学意义(P<0.05,图2 B)。在MCAO小鼠脑缺血半暗带区内可见BDNF阳性细胞为红色荧光及NeuN阳性细胞为绿色荧光,细胞核为蓝色荧光。图像合并后,绿色与红色荧光重合,表明BDNF与神经元共定位,即脑缺血再灌注后BDNF在缺血半暗带区神经元内表达(图2 A)。
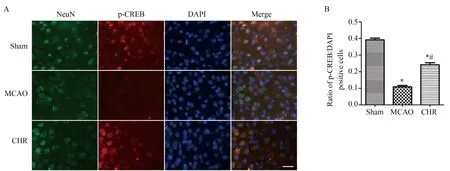
图1 Sham、MCAO及CHR各组小鼠再灌注14 d脑缺血半暗带区p-CREB/NeuN免疫荧光双标结果Fig.1 The double immunofluorescence labeling of p-CREB (red) / NeuN (green) in cerebralischemia penumbra of Sham, MCAO and CHR groups mice 14 d after reperfusion
A:representative double immunofluorescence labeling of p-CREB (red) / NeuN (green) on 14 d after ischemia/reperfusion. Bar=20μm.B: quantification of p-CREB-positive cells. (n=5, mean ± SD)*P<0.05vssham group,#P<0.05vsMCAO group;MCAO: middle cerebral artery occlusion;CHR:chrysophanol;p-CREB:phosphorylated cyclic AMP response element binding protein;DAPI: 4′,6-diamidino-2-phenylindole.
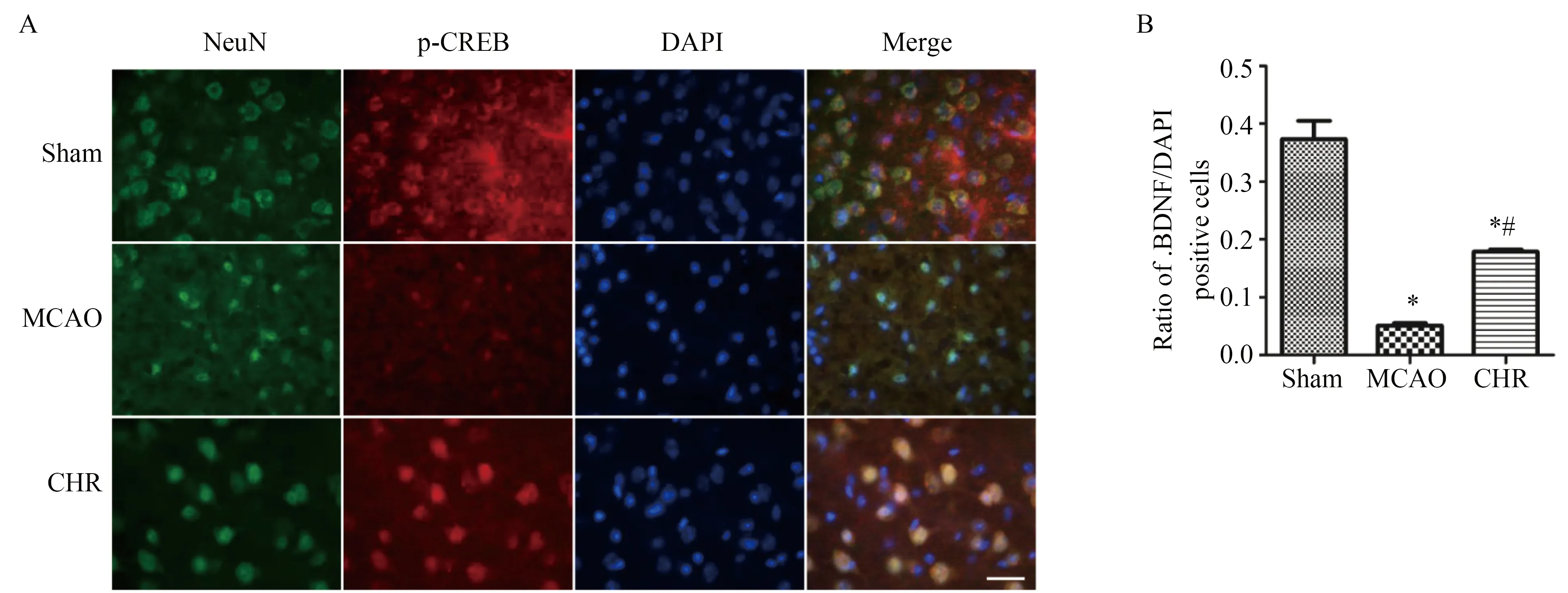
图2 Sham、MCAO及CHR各组小鼠再灌注14 d脑缺血半暗带区BDNF/NeuN免疫荧光双标结果Fig.2 The double immunofluorescence labeling of BDNF (red) / NeuN (green) in cerebral ischemia penumbra of Sham, MCAO and CHR groups mice 14 d after reperfusion
A:representative double immunofluorescence labeling of BDNF (red) / NeuN (green) on 14 d after ischemia/reperfusion. Bar=20μm.B: quantification of BDNF-positive cells. (n=5, mean ± SD)*P<0.05vsSham group,#P<0.05vsMCAO group;BDNF:brain derived neurotrophic factor;MCAO: middle cerebral artery occlusion;CHR:chrysophanol;DAPI: 4′,6-diamidino-2-phenylindole.
2.3 CHR抑制MCAO小鼠缺血侧脑组织p-STAT3蛋白表达
Western blotting结果显示,与Sham组相比,MCAO组小鼠缺血侧脑组织的p-STAT3蛋白表达水平显著增加,差异具有统计学意义(P<0.05,图3)。CHR组小鼠缺血侧脑组织p-STAT3蛋白水平比MCAO组显著减少,差异具有统计学意义(P<0.05,图3)。
3 讨论
炎性反应、氧化应激、兴奋性氨基酸毒性等多种机制参与脑缺血/再灌注损伤过程。本课题组的研究[2]表明,脑缺血再灌注后14 d,CHR提高了MCAO小鼠生存率,改善神经功能评分,减少脑组织丢失,从而发挥长期的神经保护作用。这可能与CHR抑制内质网应激,进而抑制脑缺血半暗带区内NF-κΒ活化,减少下游炎性反应因子表达有关[2-3]。然而对于缺血性脑损伤过程中,CHR发挥长期脑保护作用的机制尚不完全清楚。本研究采用免疫荧光染色方法检测MCAO小鼠脑缺血半暗带区p-CREB和BDNF蛋白表达水平,Western blotting检测MCAO小鼠缺血侧脑组织p-STAT3的蛋白水平,从而探讨CHR拮抗脑缺血再灌注损伤的相关机制。
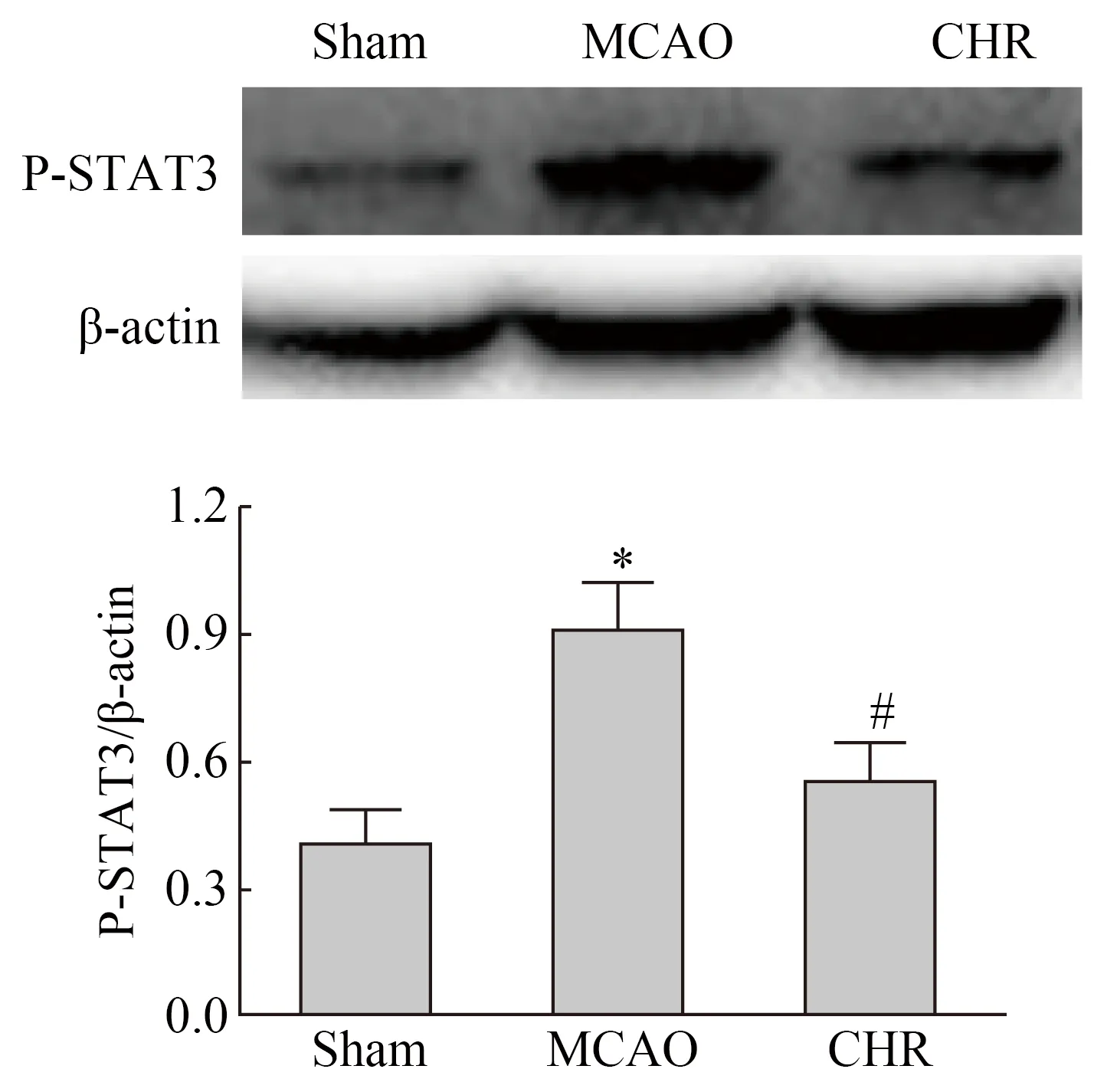
图3 Sham、MCAO及CHR各组小鼠再灌注14 d缺血侧脑组织p-STAT3的蛋白免疫印迹结果Fig.3 Western blotting results of p-STAT3 in ischemiabrain tissue of Sham, MCAO and CHR groupsmice 14 d after reperfusion
Western blotting results of p-STAT3. β-actin functions as loading control.*P<0.05vsSham group,#P<0.05vsMCAO group (n=5, mean±SD);MCAO: middle cerebral artery occlusion;CHR:chrysophanol;p-STAT3:phosphorylated signal transducer and activator of transcription 3.
研究[15]表明,p-CREB诱导激活与神经元存活相关的多种靶基因。为阐明CHR保护脑缺血损伤的机制,本研究观察了CHR对MCAO小鼠脑缺血半暗带区p-CREB表达的影响。免疫荧光染色结果显示,脑缺血再灌注14 d,MCAO组小鼠缺血半暗带区p-CREB蛋白水平较Sham组显著降低,p-CREB介导一些神经营养因子和神经保护蛋白的转录,对修复神经细胞损伤有重要作用,有助于神经细胞存活[16],因此,本研究结果提示短暂性局灶性脑缺血再灌注损伤抑制p-CREB产生,导致神经细胞损伤。给予CHR治疗的MCAO小鼠脑缺血半暗带区p-CREB蛋白表达显著增加,表明CHR促进p-CREB产生,结合课题组之前的研究[2]结果,给予CHR治疗14 d能明显改善MCAO小鼠神经功能缺损,减少细胞凋亡。提示CHR可能是通过促进p-CREB蛋白表达,减少神经细胞凋亡,从而减轻脑缺血损伤。
内源性神经保护剂BDNF是由p-CREB激活的神经营养因子之一[16],为进一步阐明CHR拮抗脑缺血损伤的机制,本研究观察了CHR对MCAO小鼠脑缺血半暗带区BDNF表达水平的影响。结果显示,脑缺血再灌注14 d,MCAO组小鼠缺血半暗带区BDNF蛋白水平较Sham组显著降低,提示脑缺血再灌注损伤抑制内源性BDNF产生,促进神经元死亡,加重脑缺血再灌注损伤。p-CREB能促进BDNF等神经营养因子产生[17],增加BDNF水平或激活BDNF相关信号通路有助于恢复卒中导致的神经功能缺损[18],给予CHR治疗的MCAO小鼠脑缺血半暗带区BDNF蛋白表达显著增加,提示CHR可能通过上调p-CREB表达,进而促进内源性BDNF产生,发挥长期脑保护作用。
有研究[19]显示,脑缺血后BDNF与TNF-α在海马小胶质细胞中共定位表达,BDNF能抑制TNF-α蛋白及mRNA的表达[20],表明BDNF参与调节炎性反应。结合本课题组之前的研究[2]结果,CHR能显著抑制TNF-α等炎性反应因子表达,提示CHR可能通过促进BDNF产生,进而抑制炎性反应,发挥神经保护作用。
P-CREB能促进BDNF等神经营养因子产生,提高神经元存活率,改善突触功能[17]。为阐明MCAO小鼠脑内p-CREB、BDNF在缺血半暗带区神经元中表达水平的变化,本研究分别将p-CREB、BDNF与神经元标志物NeuN共染。免疫荧光双标染色结果显示,p-CREB、BDNF分别与NeuN共定位,表明p-CREB、BDNF在神经元内表达,提示p-CREB、BDNF影响脑缺血后神经元损伤。
STAT3介导许多细胞因子驱动的信号转导。STAT3磷酸化后被激活,p-STAT3促进暂时性局灶性脑缺血后的神经元损伤[21]。在本研究中,笔者通过Western blotting检测发现,脑缺血再灌注14 d,MCAO组小鼠缺血侧脑组织p-STAT3蛋白比Sham组显著增多。局灶性缺血后,p-STAT3可与DNA结合诱导多种基因表达,导致神经炎性反应、细胞凋亡和脑损伤[12]。因此本研究结果提示,脑缺血再灌注促进p-STAT3表达,进而促进细胞凋亡,因此,p-STAT3参与脑缺血再灌注损伤。文献[22]报道,肢体远端缺血后处理可调节反应性星形细胞可塑性并抑制STAT3磷酸化,以促进缺血性卒中后的神经功能恢复。本研究中给予CHR治疗的MCAO小鼠缺血侧脑组织p-STAT3蛋白显著减少,表明CHR可能通过抑制缺血损伤后脑组织内p-STAT3表达,从而发挥长期神经保护作用。
综上,本研究结果表明,给予CHR治疗能促进脑缺血再灌注损伤过程半暗带区p-CREB产生,上调BDNF表达,进而抑制炎性反应,并抑制缺血侧脑组织p-STAT3蛋白表达,减少神经元死亡,发挥长期脑保护作用。
[1] Lin Y, Li Z, Liu C, et al. Towards precision medicine in ischemic stroke and transient ischemic attack [J]. Front Biosci (Landmark Ed), 2018, 23: 1338-1359.
[2] Zhao Y, Fang Y, Li J, et al. Neuroprotective effects of chrysophanol against inflammation in middle cerebral artery occlusion mice [J]. Neurosci Lett, 2016, 630: 16-22.
[3] Zhao Y, Fang Y, Zhao H, et al. Chrysophanol inhibits endoplasmic reticulum stress in cerebral ischemia and reperfusion mice [J]. Eur J Pharmacol, 2018, 818: 1-9.
[4] 房亚兰, 黄语悠, 赵咏梅, 等. 大黄酚对局灶性脑缺血再灌注小鼠缺血半暗带区环氧化酶2和基质金属蛋白酶-9表达的影响[J]. 首都医科大学学报, 2017, 38(1): 47-52.
[5] Shichinohe H, Tan C, Abumiya T, et al. Neuroprotective effects of cilostazol are mediated by multiple mechanisms in a mouse model of permanent focal ischemia [J]. Brain Res, 2015, 1602: 53-61.
[6] 鲁杨, 张鸿, 马英. CREB与脑缺血神经元损伤[J]. 解剖科学进展, 2010, 16(4): 374-376.
[7] Miyamoto N, Tanaka R, Shimosawa T, et al. Protein kinase A-dependent suppression of reactive oxygen species in transient focal ischemia in adrenomedullin-deficient mice [J]. J Cereb Blood Flow Metab, 2009, 29(11): 1769-1779.
[8] Dancause N, Nudo R J. Shaping plasticity to enhance recovery after injury [J]. Prog Brain Res, 2011, 192: 273-295.
[9] Zou S, Zhang M, Feng L, et al. Protective effects of notoginsenoside R1 on cerebral ischemia-reperfusion injury in rats [J]. Exp Ther Med, 2017, 14(6): 6012-6016.
[10] Qin L, Jing D, Parauda S, et al. An adaptive role for BDNF Val66Met polymorphism in motor recovery in chronic stroke [J]. J Neurosci, 2014, 34(7): 2493-2502.
[11] Tang Q P, Shen Q, Wu L X, et al. STAT3 signal that mediates the neural plasticity is involved in willed-movement training in focal ischemic rats [J]. J Zhejiang Univ Sci B, 2016, 17(7): 493-502.
[12] Hu G Q, Du X, Li Y J, et al. Inhibition of cerebral ischemia/reperfusion injury-induced apoptosis: nicotiflorin and JAK2/STAT3 pathway [J]. Neural Regen Res, 2017, 12(1): 96-102.
[13] 陈媛, 吴海金, 黄晓松, 等. 葛根素对脑缺血再灌注大鼠海马组织P-STAT3、P53表达的影响[J]. 湖南中医药大学学报, 2018, 38(1): 36-39.
[14] Dong W, Qi Z, Liang J, et al. Reduction of zinc accumulation in mitochondria contributes to decreased cerebral ischemic injury by normobaric hyperoxia treatment in an experimental stroke model [J]. Exp Neurol, 2015, 272: 181-189.
[15] Lee J H, Park S Y, Lee W S, et al. Lack of antiapoptotic effects of antiplatelet drug, aspirin and clopidogrel, and antioxidant, MCI-186, against focal ischemic brain damage in rats [J]. Neurol Res, 2005, 27(5): 483-492.
[16] Chen A, Xiong L J, Tong Y, et al. The neuroprotective roles of BDNF in hypoxic ischemic brain injury [J]. Biomed Rep, 2013, 1(2): 167-176.
[17] Cortes-Mendoza J, Diaz de Leon-Guerrero S, Pedraza-Alva G, et al. Shaping synaptic plasticity: the role of activity-mediated epigenetic regulation on gene transcription [J]. Int J Dev Neurosci, 2013, 31(6): 359-369.
[18] Liu B, Li L L, Tan X D, et al. Gadd45b mediates axonal plasticity and subsequent functional recovery after experimental stroke in rats [J]. Mol Neurobiol, 2015, 52(3): 1245-1256.
[19] Mohamed R A, Agha A M, Abdel-Rahman A A, et al. Role of adenosine A2A receptor in cerebral ischemia reperfusion injury: signaling to phosphorylated extracellular signal-regulated protein kinase (pERK1/2) [J]. Neuroscience, 2016, 314: 145-159.
[20] Jiang Y, Wei N, Lu T, et al. Intranasal brain-derived neurotrophic factor protects brain from ischemic insult via modulating local inflammation in rats [J]. Neuroscience, 2011, 172: 398-405.
[21] Satriotomo I, Bowen K K, Vemuganti R. JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia [J]. J Neurochem, 2006, 98(5): 1353-1368.
[22] Cheng X, Zhao H, Yan F, et al. Limb remote ischemic post-conditioning mitigates brain recovery in a mouse model of ischemic stroke by regulating reactive astrocytic plasticity [J]. Brain Res, 2018, 1686: 94-100.

