17β羟基类固醇脱氢酶5型和6型基因多态性与多囊卵巢综合征发病风险相关性的Meta分析
李青春 邢莹莹 贾萌萌 程晓琳 田晓予
(河南科技大学临床医学院 河南科技大学第一附属医院妇产科,河南洛阳 471003)
多囊卵巢综合征(polycystic ovary syndrome,PCOS) 是一种以雄激素过高的临床或生物化学表现、稀发排卵或无排卵、卵巢多囊改变为特征的病变[1]。流行病学研究[2]显示,该病在育龄期女性中的发生率为6.1%~15.7%,占无排卵性不孕症的80%[3]。PCOS以无排卵、不孕和肥胖、多毛等高雄激素血症的典型临床表现为主,该病不仅增加流产、早产、妊娠期糖尿病和高血压疾病等产科疾病的发病风险,其远期合并症如糖尿病、代谢综合征、心血管病、子宫内膜癌及患者生活质量问题等的发生风险也高于正常人群[1]。近年来,随着生活环境的改变,其发病率呈上升趋势,严重困扰人们的生活,得到社会各界的重视[4]。
迄今为止,PCOS的确切病因及病理生理机制仍不清楚。PCOS的家族聚集现象提示遗传因素在其发病机制中起重要作用[5]。高雄激素血症作为PCOS的主要特征,据报道[6]50%以上的PCOS患者存在高雄激素血症,卵泡内雄激素过多可致卵泡闭锁,从而使卵巢呈多囊样改变。17β-羟基类固醇脱氢酶(17β-hydroxysteroid dehydrogenases,17β-HSDs)参与雄激素生物合成及代谢,因此,编码17β-HSDs的基因成为PCOS病因研究中的重要候选基因。目前有关17β-羟基类固醇脱氢酶基因(17β-hydroxysteroid dehydrogenase gene,HSD17B)的单核苷酸基因多态性(single nucleotide polymorphisms,SNP)与PCOS发病相关性的研究报道结论并不一致。本文研究旨在选择HSD17B的两个亚型5型(HSD17B5rs3763676)和6型(HSD17B6rs898611)的SNP通过Meta分析的方法来探究各研究之间的不一致性,客观评价HSD17B基因作为PCOS候选基因的可能性,为从基因水平上认识PCOS的病因及发病机制提供证据。
1 资料与方法
1.1 纳入标准
本研究为病例-对照研究。PCOS病例组诊断符合欧洲人类生殖及胚胎学会和美国生殖医学会制定的鹿特丹(Rotterdam)标准或者美国国立卫生研究院(National Institutes of Health,NIH)制定的 NIH诊断标准,对照组为健康人群,且有两组人群的基本构成信息。暴露因素为HSD17B5rs3763676或HSD17B6rs898611基因突变。结局指标为PCOS发病风险。文献语种不限
1.2 排除标准
样本资料交代不清或不全、数据不完整的文献。对于重复报告的文献,只纳入最新发表或高质量者。剔除摘要、讲座或综述类文献。
1.3 文献检索
通过计算机检索中国知网、万方、维普、中国生物医学数据库4个中文数据库和The Cochrane Library、PubMed、EMBASE(OVID)3个英文数据库,收集有关国内外发表的关于HSD17B单核苷酸多态性与 PCOS 关联性研究的文献,同时追溯纳入文献的参考文献。检索时限均为从建库到 2017年6月30日。采用主题词加自由词的方法进行检索,中文检索主题词包括“多囊卵巢综合征、基因多态性、17β-羟基类固醇脱氢酶和17β-HSD”,英文检索主题词包括“Polycystic ovary syndrome”、“17beta-hydroxysteroid dehydrogenase”、“Polymorphism*”。
1.4 文献筛选、资料提取及偏倚风险评估
两名研究者严格按照纳入与排除标准独立筛选文献、提取资料。提取的资料内容如下:第一作者、发表时间、种族、样本量、PCOS的诊断标准、基因型的检测方法、各组等位基因和基因型分布频率。首先,对对照组进行哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)检验以减少病例-对照研究中出现的抽样偏倚,本文HWE检验应用Excel表格设置函数进行检验,当P>0.05时表示样本具有群体代表性,来自同一孟德尔群体,符合群体基因遗传平衡,可以进行Meta定量分析;当P≤0.05时,只进行描述性定性分析。然后,采用观察性研究的偏倚风险评价工具纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)评价纳入的病例对照研究的偏倚风险,NOS评分总分为 9 分,≥ 6 分的为高质量研究[7-8]。最后,将结果进行核对,对选评文献过程中存在的分歧通过讨论解决。
1.5 统计学方法
应用RevMan5.3软件进行Meta分析,计算等位基因及各基因型遗传模型的发病风险比值比(odds ratio,OR)及其 95%可信区间(confidence interval,CI)衡量。采用Q检验法研究各试验间的异质性,并利用I2值对异质性进行定量分析。当P≥0.1和I2≤50%,表示研究间异质性较小,选用固定效应模型;反之,当P<0.1和I2>50%,表示研究间存在异质性较大,选用随机效应模型。但是考虑到随机模型相对较保守,使结果更倾于安全,对于I2≥30%,选择采用随机效应模型进一步验证。如异质性源于低质量研究则进行敏感性分析。采用Z检验对合并效应量OR值进行假设检验,以P<0.05为差异有统计学意义。同时应用RevMan5.3软件绘制漏斗图分析可能存在的发表偏倚。
2 结果
2.1 文献检索结果
根据文献检索策略初步检索得到相关文献664篇:其中Pubmed 66篇,EMbase 36篇,The Cochrane Library 20篇,中国知网203篇,万方209篇,中国生物医学文献37篇,维普93篇,利用Endnote X7文献管理软件去除重复文献262篇。根据纳入及排除标准,首先阅读标题和摘要进行初筛,共剔除文献390篇。然后阅读全文进—步筛选,剔除符合排除标准的文献共4篇,其中重复发表的研究1篇,综述研究1篇,不包含HSD17B5rs3763676或HSD17B6rs898611基因位点的文献2篇。在所有纳入的8篇文献中,1篇文献研究结果显示纳入人群的HSD17B5rs3763676突变基因稀有,无法进行统计学分析,只能进行定性描述。具体文献检索流程见图1。
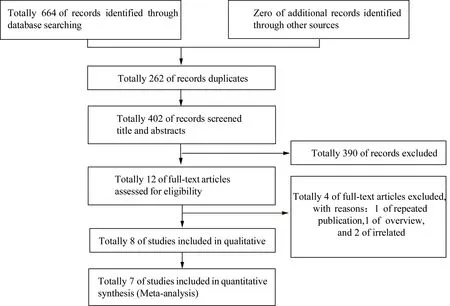
图1 文献检索流程图Fig.1 Flow-chart of study selection
2.2 纳入文献的基本特征
本研究按照纳入与排除标准共纳入8篇文献[9-16],其中Ke等[15]和 Ju等[16]同时研究了HSD17B5和HSD17B6两个亚型单核苷酸基因多态性与PCOS发病风险的相关性,但Ju等[16]研究的HSD17B5型中并不包括本研究rs3763676位点的突变基因多态性,所以最终共有5篇研究HSD17B5rs3763676位点单核苷酸基因多态性,包括病例组889例和对照组751例。但因柯纪定等[11]和Ke等[15]两个研究发现中国人的G突变基因为稀有基因,无法进行HWE检验和Meta定量分析,只能进行定性分析。有关HSD17B6rs898611位点基因多态性与PCOS发病风险的研究共4篇进行Meta分析,共包括病例组 1 065例和对照组942例。纳入文献的基本特征见表1,纳入研究的等位基因及基因型频率分布情况及HWE检验结果见表2、表3。
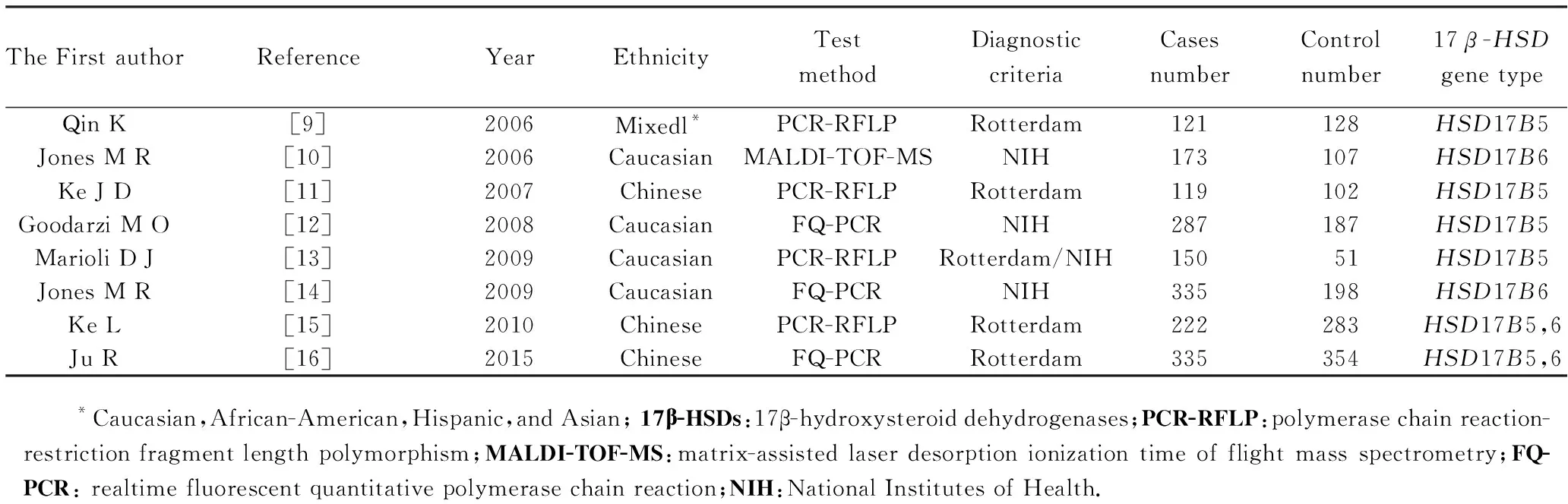
表1 纳入文献的基本特征Tab.1 Characteristics of the included studies
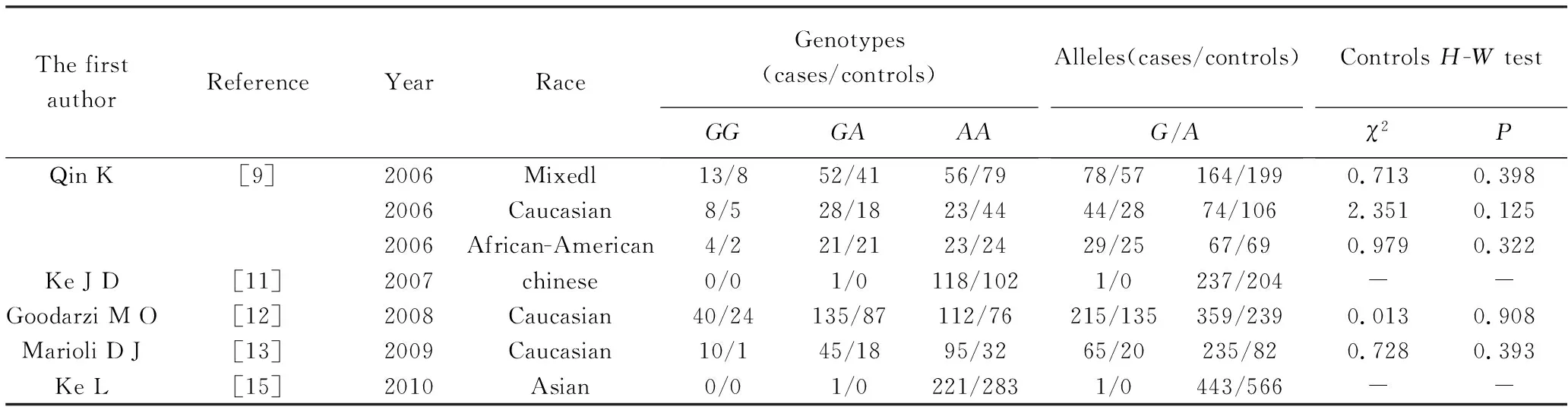
表2 HSD17B5 SNP rs3763676 A→G及基因型频率分布情况及HWE检验结果Tab.2 Allele and genotype HSD17B5 SNP rs3763676 A→G frequency distribution of the genes and HWE test results
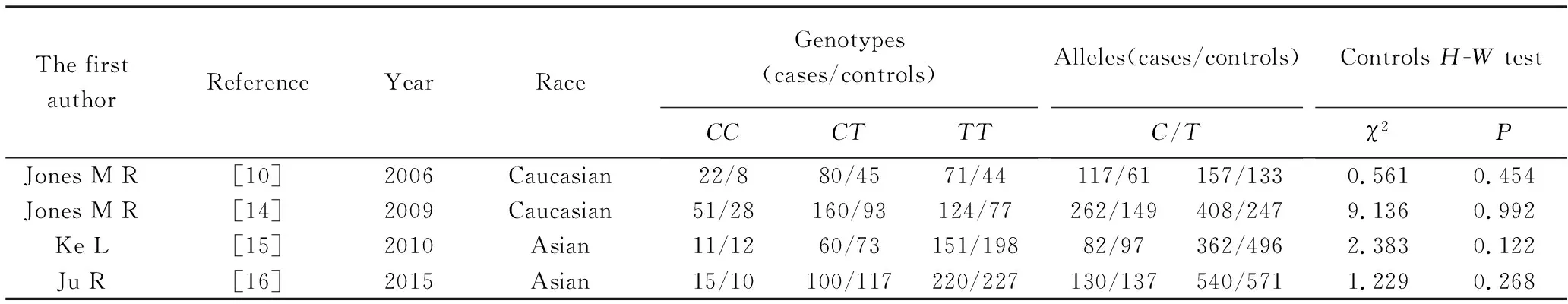
表3 HSD17B6 SNP rs898611 T→C及基因型频率分布情况及HWE检验结果Tab.3 Allele and genotype HSD17B6 SNP rs898611 T→C frequency distribution of the genes and HWE test results
2.3 纳人研究的方法学质量
纳入Meta分析的7篇文献NOS评分≥6,表明纳入的文献质量较高(表4)。7个病例-对照研究中全部对病例组进行了充分定义而且具有代表性,几乎都对对照组的选择进行了详细报道。大部分纳入文献都对各研究中病例组及对照组的年龄、体质量、月经初潮、代谢相关指标等混杂因素进行比较,但有些研究中这些因素两组之间存在差异,而且大多数研究结果的比较并未调整这些混杂因素。大多数研究未报道测量是否采用盲法,但所有研究中病例组与对照组暴露因素的测量方法是完全相同的且应答率100%。
2.4 Meta分析结果
2.4.1HSD17B5rs3763676位点SNP与PCOS的发病风险相关性研究
本研究共纳入3个病例对照研究进行Meta分析,所有异质性检验I2<50%,表明各研究间同质性较好。HSD17B5rs3763676A/GSNP的等位基因模型(GvsA)及基因型模型(显性模型GG+AGvsAA,隐性模型GGvsAG+AA,共显性模型GGvsAA及AGvsAA)间的差异均无统计学意义(表5,GvsA:OR=1.21,95%CI:0.98~1.49,P=0.070;GG+AGvsAA:OR=1.26,95%CI:0.85~1.86,P=0.250;GGvsAG+AA:OR=1.35,95%CI:0.86~2.12,P=0.190;GGvsAA:OR=1.47,95%CI:0.91~2.38,P=0.110;AGvsAA:OR=1.19,95%CI:0.79~1.78,P=0.410)。Qin等[9]的研究对象为混合人群,包括高加索人、非洲裔美国人、西班牙人和亚洲人,对高加索人群进行亚组分析时,发现所得结果与总体一致,等位基因模型和基因型模型均与PCOS发病风险差异无统计学意义(图2)。
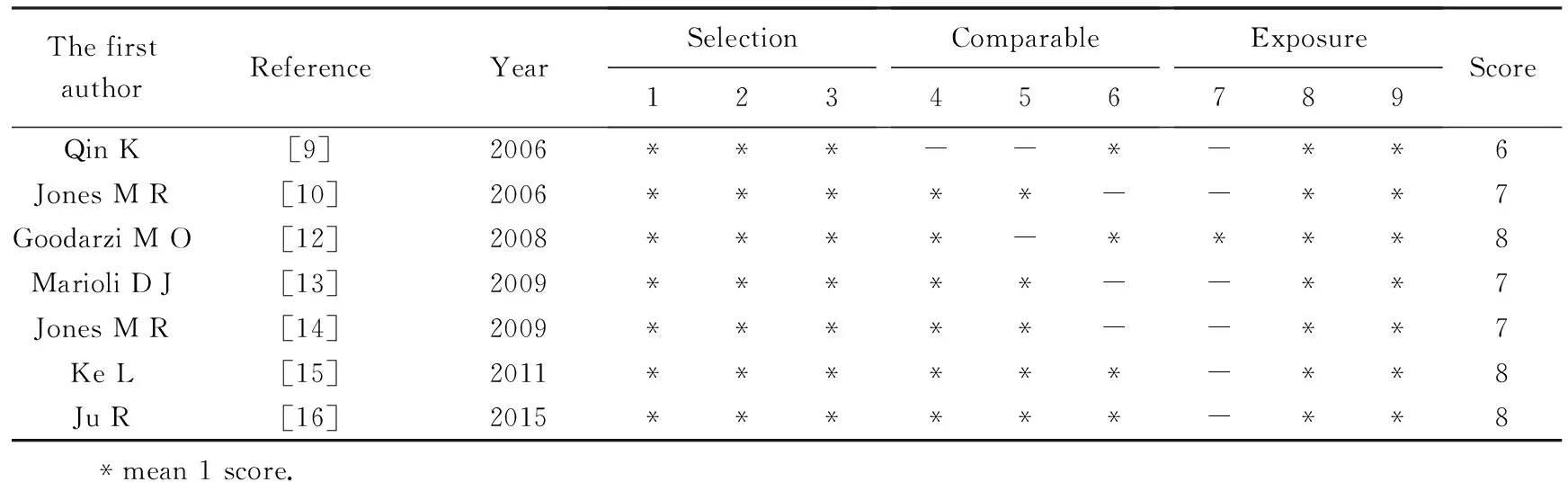
表4 纳入文献质量评价结果Tab.4 Assessment of quality results of the included studies
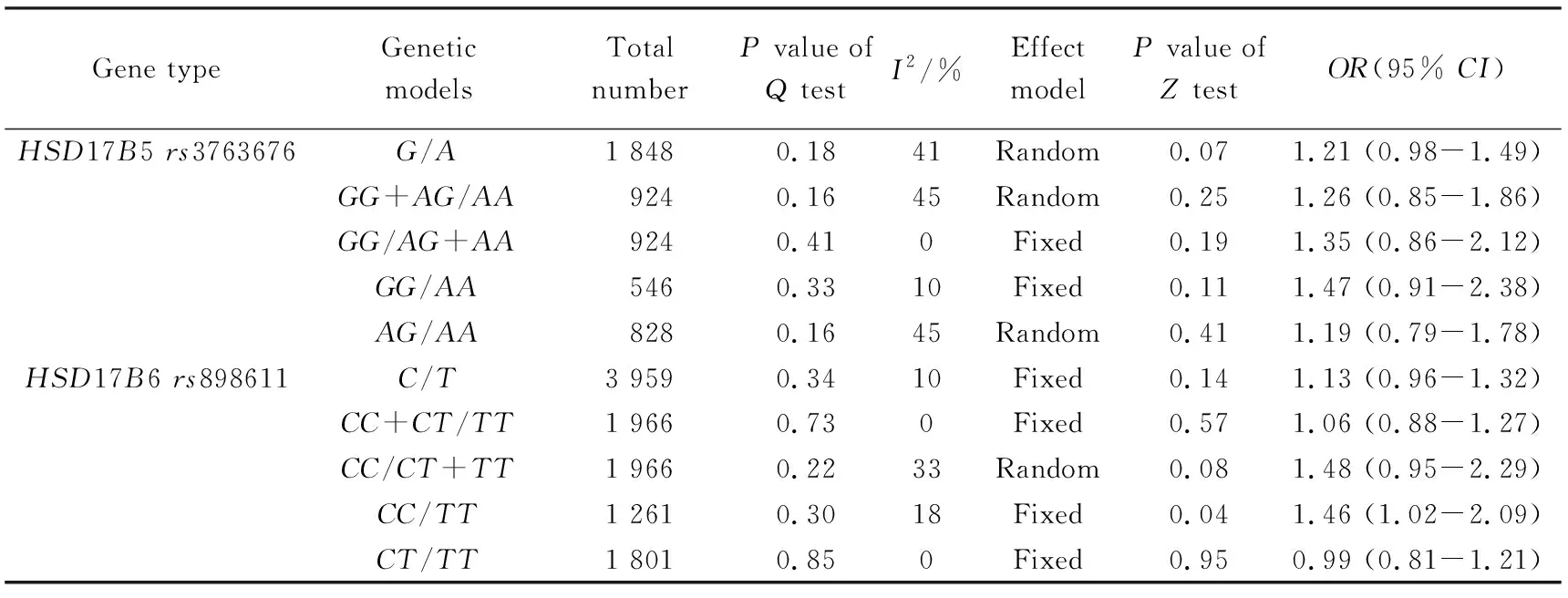
表5 5种遗传学模型比较结果汇总Tab.5 Summary of the results of five genetic models
2.4.2HSD17B6rs898611位点单核苷酸基因多态性与PCOS发病风险的相关性研究
本研究共纳入4篇HSD17B6rs898611 C/T SNP与PCOS发病风险相关性的病例对照研究进行Meta分析,研究结果表明除共显性模型CCvsTT差异有统计学意义外(CCvsTT:OR=1.46,95%CI:1.02~2.09,P=0.040),其余差异均无统计学意义(CvsT:OR=1.13,95%CI:0.96~1.32,P=0.140;CC+CTvsTT:OR=1.06,95%CI:0.88~1.27,P=0.570;CCvsCT+TT:OR=1.48,95%CI:0.95~2.29,P=0.080;CTvsTT:OR=0.99,95%CI:0.81~1.21,P=0.950,表5)。按研究对象种族分为中国汉族人和欧洲高加索人进行亚组分析,结果发现汉族人和高加索人的rs898611等位基因模型与各基因型模型均与PCOS发病风险差异无统计学意义(图3)。
2.5 敏感性分析结果
本文采取逐一排除所纳入Meta分析文献的方法进行敏感性分析,通过Revman5.3软件在每个效应模型分析中每次分别勾掉一个研究,观察总效应量OR及95%CI和异质性检验结果(I2和P值)。敏感度分析结果显示排除任意一项研究后,在相应的效应模型中每组OR值、可信区间及异质性结果均与总体接近,不受单个研究的影响,本Meta分析结果稳定性好,结果可靠。
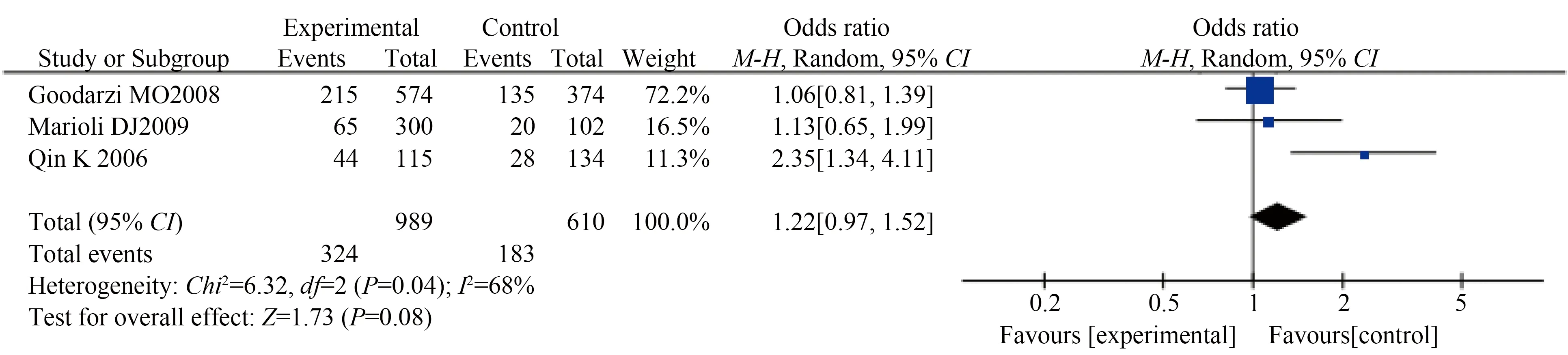
图2 高加索人HSD17B5 rs3763676与PCOS易感性的等位基因模型森林图Fig.2 Forest plot of allele model of Caucasian HSD17B5 rs3763676
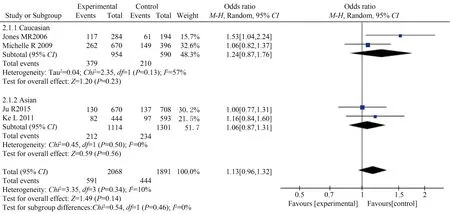
图3 HSD17B6 rs898611与PCOS易感性的亚组分层等位基因模型森林图Fig.3 Race subgroup analysis forest plot of HSD17B6 rs898611 allele model
2.6 发表偏倚评估
利用Revman 5.3 对HSD17B5rs3763676和HSD17B6rs898611的易感相关性的5种遗传学模型绘制漏斗图定性分析发表偏倚,所有模型的漏斗图基本对称,结果均提示没有明显的发表偏倚,结论可信度较高。
3 讨论
17β-HSDs是一类NAD(P)H/NAD(P)+依赖的氧化还原酶,其主要功能是参与性激素的代谢,通过调节细胞内甾体类激素水平从而在生殖系统中发挥重要作用[18]。PCOS患者的促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)激动剂试验数据证实PCOS卵巢17β-HSD 表达增多[19]。卵泡膜细胞雄激素生成过多是PCOS发病的内在性质[20],参与雄激素生物合成的关键酶量、活性及其基因表达水平一直是PCOS发病机制研究的热点。17β-HSD5和17β-HSD6是17β-HSDs的两个亚型,均参与雄激素合成代谢,17β-HSD5的功能是催化雄烯二酮转化睾酮[21],17β-HSD6通过催化高效的雄激素生成(如3α雄烯二醇向5α双氢睾酮转化)在调节能与雄激素受体结合的活性雄激素的平衡过程中起着重要的作用[22],并有研究[23]表明PCOS卵巢卵泡膜细胞中HSD17B6的mRNA表达显著增加。目前已有大量关于人17β-HSDs基因单核苷酸多态性与PCOS易感性关联的研究发表,但各研究间的结论并不一致,总体看来缺乏较大量的样本依据,所以本研究通过全面收集有关17β-HSDs单核苷酸基因多态性与PCOS发病风险相关性的研究,利用科学严谨的系统评价研究方法得出一个综合可靠的结论。
本次研究结果表明,纳入3篇关于HSD17B5rs3763676的5个不同的等位基因模型和基因型模型之间的比较差异均无统计学意义(P>0.05),表明HSD17B5rs3763676G/A的突变与PCOS发病风险没有相关性。笔者进一步只对高加索人进行亚组分析,所得结果与总体一致,表明高加索人的PCOS发病风险与HSD17B5rs3763676G/A的突变也没有相关性。17β-HSD5参与卵巢雄激素生成,研究已表明HSD17B5rs3763676、rs12529和rs1937845基因多态性与PCOS血清睾酮高水平相关[9,13,16],但是Nelson等[24]卵泡膜细胞培养试验表明PCOS的17β-HSD5酶的活性及mRNA表达水平与正常人卵泡膜细胞并没有明显差异。本研究严格按Meta分析过程进行的,其HSD17B5rs3763676G/A的突变与PCOS发病风险没有相关性的结论真实可信,但是HSD17B5基因多态性与PCOS高雄激素血症相关的确切分子机制需进一步研究。
本研究结论与Qin等[9]的研究结果并不一致,可能与群体分层有关。群体分层是指在一个研究中不同群体在同一个疾病中具有不同等位基因频率及基因型。群体分层对遗传关联分析可能直接导致结果偏倚,产生假阳性或假阴性的结果[25]。Qin等[9]研究纳入的是混合人群,包括高加索人、非洲裔美国人、西班牙人和亚洲人,由于这些人群的遗传背景不同而产生了假阳性结果。柯纪定等[11]和Ke等[15]对中国汉族人的rs3763676G/A的基因多态性与PCOS发病风险相关性进行了研究,结果发现G等位基因在中国人种中是一种稀有基因。柯纪定等[11]纳入的121名研究对象中只有一位PCOS患者的基因型为AG,Ke等[15]纳入的505名研究对象也是只有一位PCOS患者的基因型为AG,该结果也说明HSD17B5rs3763676G/A基因突变可能与PCOS发病风险没有相关性,同时也表明在不同人种中rs3763676G/A具有不同的分布频率,但是目前尚缺少其他种族有关HSD17B5rs3763676G/A基因与PCOS相关性的研究。
本研究纳入4篇有关HSD17B6 rs898611C/T单核苷酸基因多态性与PCOS发病风险相关性研究,除共显性模型CCvsTT比较的差异有统计学意义外(CCvsTT:OR=1.46,95%CI:1.02~2.09,P=0.040),其余差异均无统计学意义。在进行种族亚组分析时,发现无论是汉族人还是高加索人,5种遗传模型的差异均无统计学意义,表明HSD17B6rs898611C/T单核苷酸基因多态性与PCOS发病风险没有相关性。虽然PCOS卵巢组织中HSD17B6酶的活性及mRNA表达增高,但是酶活性及基因表达改变的机制仍不清楚[23]。Jones等[10]首次对澳大利亚人进行了6个HSD17B6基因单核苷酸多态(rs2277339、rs7967600、rs898611、rs1227117、rs10459246、rs1870673)与PCOS之间相关性的研究,结果只有rs898611的等位基因在PCOS组和对照组之间存在明显差异。Jones等[14]随后对美国人进行研究验证HSD17B6rs898611C/T与PCOS之间的关系,结果并未发现两者之间存在相关性。Ke等[15]和Ju等[16]对中国汉族人的研究也没有发现rs898611和PCOS之间存在相关性。所以本研究结果与大部分已发表的文献观点一致。
但是上述研究均表明rs898611基因多态性与PCOS代谢表型之间具有相关性,主要是肥胖和胰岛素相关特征。已有研究表明卵巢局部高雄激素可以导致肥胖,胰岛素与LH的共同作用可导致卵泡膜细胞和间质细胞过度增生合成更多的雄激素[26]。PCOS高雄激素血症和胰岛素抵抗之间具有相互作用,但是关于HSD17B6是如何影响循环胰岛素水平的机制并不清楚,需要功能学研究进一步阐明PCOS雄激素代谢与胰岛素代谢之间通路的具体机制。
近年来,大规模的遗传学及功能学研究更进一步了解PCOS的病因及发病机制,特别是全基因组关联研究(genome-wide association study,GWAS),表明遗传因素在PCOS具有重要作用[27-29]。但是PCOS不是一种单基因遗传疾病,其致病原因是多基因共同作用的结果,同时环境因素和个人生活方式等因素也发挥重要作用。对于多基因遗传病,即复杂性状遗传病,其遗传并不完全符合孟德尔规律[27]。本研究仅仅分析了HSD17B5rs3763676和HSD17B6rs898611两个单核苷酸多态性与PCOS的相关性,目前尚缺少其基因内部多个变异之间相互作用共同导致PCOS发病的多基因相关性研究。也许是HSD17B5rs3763676G/A或HSD17B6rs898611C/T单个基因变异对PCOS疾病的影响作用非常微小无法检测出来得出不相关结论。
需要指出的是,本研究存在一定的局限性。首先,相关研究数量较少,Meta分析只纳入3篇有关HSD17B5rs3763676G/A和4篇HSD17B6rs898611C/T的研究,而且笔者检索虽然没有限制语言,但纳入的只有汉语和英语研究,可能存在未发表或其他的与本文相关的研究,这些研究均影响本研究的结果。其次,由于缺乏原始研究数据,无法在分析过程中对基因-基因或者基因-环境之间的潜在相互作用进行评估。最后,尽管所有研究的病例组和对照组都是按照筛选标准进行确定,但是还存在其他的潜在因素没有被考虑。
综上所述,该Meta分析虽然未发现HSD17B5rs3763676G/A和HSD17B6rs898611C/T单核苷酸基因多态性与PCOS发病风险存在关联,特别是亚洲人 群,但HSD17B5和HSD17B6 这两种酶对雄激素代谢存在影响,而雄激素在PCOS患病发挥重要作用。由于该Meta分析相应的局限性,因而不应忽视其与PCOS易感潜在的关联,同时上述位点的具体功能尚未研究透彻,在上述结果得到合理的解释之前,还需要进行大量关于上述位点功能的基础研究。
[1] 沈铿, 马丁, 丰有吉,等. 妇产科学[M]. 3版.北京:人民卫生出版社, 2015:246-250.
[2] Yildiz B O, Bozdag G, Yapici Z, et al. Prevalence,phenotype and cardiometabolic risk of polycystic ovary syndrome under different diagnostic criteria[J].Hum Reprod, 2012, 27(10):3067-3073.
[3] Balen A H, Morley L C, Misso M, et al. The management of anovulatory infertility in women with polycystic ovary syndrome: an analysis of the evidence to support the development of global WHO guidance[J]. Hum Reprod Update, 2016, 22(6):687-708.
[4] 何晓彤, 孟祥雯, 张雪娇,等. 多囊卵巢综合征病因与发病机制的研究进展[J]. 中国妇幼保健, 2017, 32(7):1588-1591.
[5] Legro R S, Driscoll D, Strauss J F 3rd, et al. Evidence for a genetic basis for hyperandrogenemia in polycystic ovary syndrome[J]. Proc Natl Acad Sci USA, 1998, 95(25):14956-14960.
[6] Jonard S, Dewailly D. The follicular excess in polycystic ovaries,due to intra-ovarian hyperandrogenism,may be the main culprit for the follicular arrest[J]. Hum Reprod Update, 2004, 10(2):107-117.
[7] 曾宪涛, 刘慧, 陈曦,等. 分析系列之四: 观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 4(4):297-299.
[8] Zeng X, Zhang Y, Kwong J S, et al. The methodological quality assessment tools for preclinical and clinical studies,systematic review and meta-analysis,and clinical practice guideline: a systematic review[J]. J Evid Based Med, 2015, 8(1):2-10.
[9] Qin K, Ehrmann DA, Cox N, et al. Identification of a functional polymorphism of the human type 5 17beta-hydroxysteroid dehydrogenase gene associated with polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2006, 91(1):270-276.
[10] Jones M R, Italiano L, Wilson S G, et al. Polymorphism in HSD17B6 is associated with key features of polycystic ovary syndrome[J]. Fertil Steril, 2006, 86(5):1438-1446.
[11] 柯纪定, 柯路, 王勇,等.多囊卵巢综合征与17β-HSD5基因多态性关系[J].中国公共卫生, 2007, 23(9):1119-1120.
[12] Goodarzi M O, Jones M R, Antoine H J, et al. Nonreplication of the type 5 17beta-hydroxysteroid dehydrogenase gene association with polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2008, 93(1):300-303.
[13] Marioli D J, Saltamavros A D, Vervita V, et al. Association of the 17-hydroxysteroid dehydrogenase type 5 gene polymorphism(-71AC HSD17B5 SNP) with hyperandrogenemia in polycystic ovary syndrome(PCOS)[J]. Fertil Steril, 2009, 92(2):648-652.
[14] Jones M R, Mathur R, Cui J, et al. Independent confirmation of association between metabolic phenotypes of polycystic ovary syndrome and variation in the type 6 17beta-hydroxysteroid dehydrogenase gene[J]. J Clin Endocrinol Metab, 2009, 94(12):5034-5038.
[15] Ke L, Che Y N, Cao Y X, et al. Polymorphisms of the HSD17B6 and HSD17B5 genes in Chinese women with polycystic ovary syndrome[J]. J Womens Health, 2010, 19(12):2227-2232.
[16] Ju R, Wu W, Fei J, et al. Association analysis between the polymorphisms of HSD17B5 and HSD17B6 and risk of polycystic ovary syndrome in Chinese population [J]. Eur J Endocrinol, 2015, 172(3):227-233.
[17] Wickenheisser J K, Nelson-Degrave V L, Mc Allister J M. Dysregulation of cytochrome P450 17 alpha-hydroxylase messenger ribonucleic acid stability in theca cells isolated from women with polycystic ovary syndrome[J]. Clin Endocrinol Metab, 2005, 90(3):1720-1727.
[18] 苏文,许华敏,康继宏,等. 羟基类固醇脱氢酶的功能[J]. 生理科学进展, 2014, 45(1):27-31.
[19] Rosenfield R L, Barnes R B, Ehrmann D A. Studies of the nature of 17-hydroxyprogesterone hyperresponsiveness to gonadotropin-releasing hormone agonist challenge in functional ovarian hyperandrogenism[J]. J Clin Endocrinol Metab,1994, 79(6):1686-1692.
[20] Nelson V L, Legro R S, Strauss J F 3rd, et al. Augmented androgen production is a stable steroidogenic phenotype of propagated theca cells from polycystic ovaries[J]. Mol Endocrinol,1999, 13(6):946-957.
[21] Penning T M, Burczynski M E, Jez J M, et al. Structure-function aspects and inhibitor design of type 5 17-hydroxysteroid dehydrogenase (AKR1C3)[J]. Mol Cell Endocrino,2001, 1171(1-2):137-149.
[22] Biswas M G, Russell D W. Expression cloning and characterization of oxidative 17β-and 3α-dehydrogenases from rat and human prostate[J]. J Biol Chem, 1997, 272(25):15959-15966.
[23] Wood J, Nelson V L, Ho C, et al. The molecular phenotype of polycystic ovary syndrome (PCOS) theca cells and new candidate PCOS genes defined by microarray analysis[J]. J Biol Chem, 2003, 278(29):26380-26390.
[24] Nelson V L,Qin K N, Rosenfield R L, et al. The biochemical basis for increased testosterone production in theca cells propagated from patients with polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2001, 86(12):5925-5933.
[25] 智联腾,周钢桥,贺福初. 人类复杂疾病关联研究中群体分层的检出和校正[J]. 遗传, 2007, 29(1):3-7.
[26] Essah P A,Nestler J E,Carmina E. Difference in dyslipidemia between American and Italian women with polycystic ovary syndrome[J]. J Endocrinol Invest, 2008, 31(1):35-41.
[27] 张洪丽, 刘元宁, 张浩,等.精神分裂症易感基因的多位点关联性分析[J].吉林大学学报:工学版, 2008, 38(S2):205-212.
[28] 赵越, 阮祥燕,崔亚美,等.不同亚型的多囊卵巢综合征患者临床及实验室指标特征的研究[J].首都医科大学学报,2015,36(4):567-572.
[29] 赵彦楠,刘洪祥,霍佳宁,等.晚期糖基化终末产物在多囊卵巢综合征大鼠模型中的表达[J].中国医科大学学报,2017,46(5):388-391.

