一氧化氮合酶抑制剂N-硝基-L-精氨酸甲酯对局灶性脑缺血再灌注大鼠缺血半暗带区细胞自噬的影响
黄语悠 房亚兰 师文娟 刘克建 赵咏梅
(首都医科大学宣武医院中心实验室 北京市老年病医疗研究中心 神经变性病教育部重点实验室 脑血管病转化医学北京市重点实验室,北京 100053)
缺血性脑血管病是导致死亡的重要原因之一,也是导致肢体残疾的重要因素[1]。脑缺血/再灌注损伤涉及一系列复杂的病理过程,但具体目前机制仍不明确。其中,氧化应激损伤在脑缺血再灌注损伤中扮演了重要角色[2]。因此,缺血性卒中的氧化应激损伤与脑保护策略是目前的研究热点之一[3]。
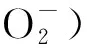
自噬可以通过产生游离氨基酸和脂肪酸来维持细胞功能,并通过去除损伤的细胞器和蛋白质保持细胞健康,从而使细胞在营养限制条件下存活,是维持细胞稳态的一种重要机制,是细胞得以保持健康的重要原因之一[9-10]。然而,过量的自噬也会导致过度的自我消化或引发细胞凋亡而导致细胞死亡[10-11]。研究者[12]认为神经元死于缺血性损伤后的坏死或凋亡。然而,新的研究[13]表明,缺血再灌注也可以激活自噬性细胞死亡,而NO在多种细胞中被证实对自噬信号产生了不同的影响,NO通过上调自噬来防止I/R诱导的肝损伤,但同时,也有研究[14]显示NO可以造成缺血再灌注后的脑损伤与心肌损伤。血管再通是目前针对缺血性卒中最有效的治疗方法,氧化应激和自噬在缺血再灌注过程中发挥的作用对于缺血性卒中的治疗和预后有着重要意义。本课题组[7]前期研究显示延迟并减弱NO产生可对大脑缺血再灌注损伤产生保护作用,但自噬在其中扮演了怎样的角色目前尚不明确。因此,本研究采用大脑中动脉闭塞(middle cerebral artery occlusion, MCAO) 再灌注模型大鼠,观察一氧化氮合酶(nitric oxide synthase, NOS)抑制剂(Nω-nitro-L-arginine methyl ester, L-NAME)对大鼠脑缺血再灌注后24 h NO和自噬相关蛋白LC3B和Beclin1的表达产生的影响,从而进一步探讨NO在脑缺血再灌注过程中扮演的角色,并探讨其机制。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠,体质量280~320 g,北京维通利华实验动物公司,实验动物许可证号:SCXK(京) 2012-0001,于SPF级动物实验室恒温饲养,术前12 h禁食水。将18只大鼠采用数字表法随机分为3组:假手术(Sham)组;MCAO组;MCAO+L-NAME组。L-NAME溶于0.9%(质量分数)氯化钠注射液中,于术前30 min腹腔注射给药(1 mg/kg),Sham组和MCAO组小鼠腹腔注射同等体积的0.9%(质量分数)氯化钠注射液。
1.2 主要仪器设备
小动物麻醉机(Harvard Apparatus公司,美国)、手术显微镜(Carl Zeiss公司,德国)、反馈式温度调节仪(CMA 150 Carnegie Medicin公司瑞典)、小动物呼吸机(Harvard Apparatus 683,Harvard Apparatus公司,美国)双极电凝器(德威,DEVEL,ACC100)、冰冻切片机(Thermo Fisher Scientific公司,美国)、荧光显微镜(Nikon公司,日本)。
1.3 试剂
恩氟烷(河北一品制药有限公司);水合氯醛(首都医科大学宣武医院);L-NAME(Sigma公司,美国);3-NT抗体(Abcam公司,英国);NeuN抗体(Millipore公司,美国);LC3B抗体(CST公司,美国)等。
1.4 动物模型制作
MCAO大鼠模型按照改良Zea Longa法制备。将恩氟烷混合于70%(体积分数) N2O、30%(体积分数) O2中,用5%(体积分数)恩氟烷诱导麻醉后改用面罩吸入2%(体积分数)恩氟烷维持麻醉。于大鼠颈部沿正中线切口,分离右侧的颈总动脉、结扎并凝断颈外动脉,将头端直径为0.38 mm的尼龙线栓自颈外动脉残端插进颈内动脉,到达距颈外动脉和颈内动脉分叉约18 mm处。术中检测大鼠心率、血压,并使用反馈性控温毯监测术中大鼠肛温,维持体温在 (37.0±0.5)℃。缺血90 min后,将线栓拔出进行再灌注。术后大鼠饲养于SPF级动物实验室,自由进食饮水。
1.5 免疫荧光双标
各组大鼠于再灌注后24 h,用水合氯醛腹腔注射麻醉后,快速断头取脑,包埋冰冻,行连续冰冻切片(厚度为20 μm)。首先将脑组织冰冻切片经4%(质量分数)多聚甲醛固定10 min,PBS洗后,用含有0.2%(体积分数) TritonX-100的PBS孵育约10 min,PBS洗后,用5 %(体积分数)的山羊血清在室温下封闭30 min,滴加一抗(3-NT 1∶400, LC3B 1∶400,Beclin1 1∶400),4 ℃孵育一抗过夜。次日将切片取出,PBS洗后,滴加荧光二抗(1∶300),在室温下避光孵育1 h。PBS洗后,最终用DAPI(4′,6-diamidino-2-phenylindole)封片。在荧光显微镜下观察。阴性对照组用PBS代替一抗。
1.6 统计学方法
2 结果
2.1 L-NAME抑制MCAO 大鼠脑缺血半暗带区 LC3B的表达
免疫荧光染色结果显示,Sham组大鼠大脑中与缺血半暗带相对应的脑区偶见LC3B阳性的红色荧光染色,而MCAO组大鼠缺血侧额颞叶皮质及纹状体可见大量LC3B阳性细胞。与Sham组相比,MCAO组大鼠LC3B阳性细胞数量明显增多;与MCAO组相比,L-NAME组大鼠缺血半暗带区LC3B阳性细胞数量明显减少(图1 A),差异有统计学意义(P<0.05,图1 B)。
2.2 L-NAME抑制MCAO大鼠缺血半暗带区Beclin1的表达
免疫荧光结果显示,Sham组大鼠脑组织有少量Beclin1蛋白阳性细胞,散见于海马区与额顶颞叶皮质。MCAO组大鼠脑组织于镜下可见大量红色荧光,大脑缺血半暗带区Beclin1阳性细胞数量较Sham组明显增高。L-NAME组大鼠脑组织切片缺血半暗带区Beclin1阳性细胞数量较MCAO组明显减少(图2 A),差异有统计学意义(P<0.05,图2 B)。
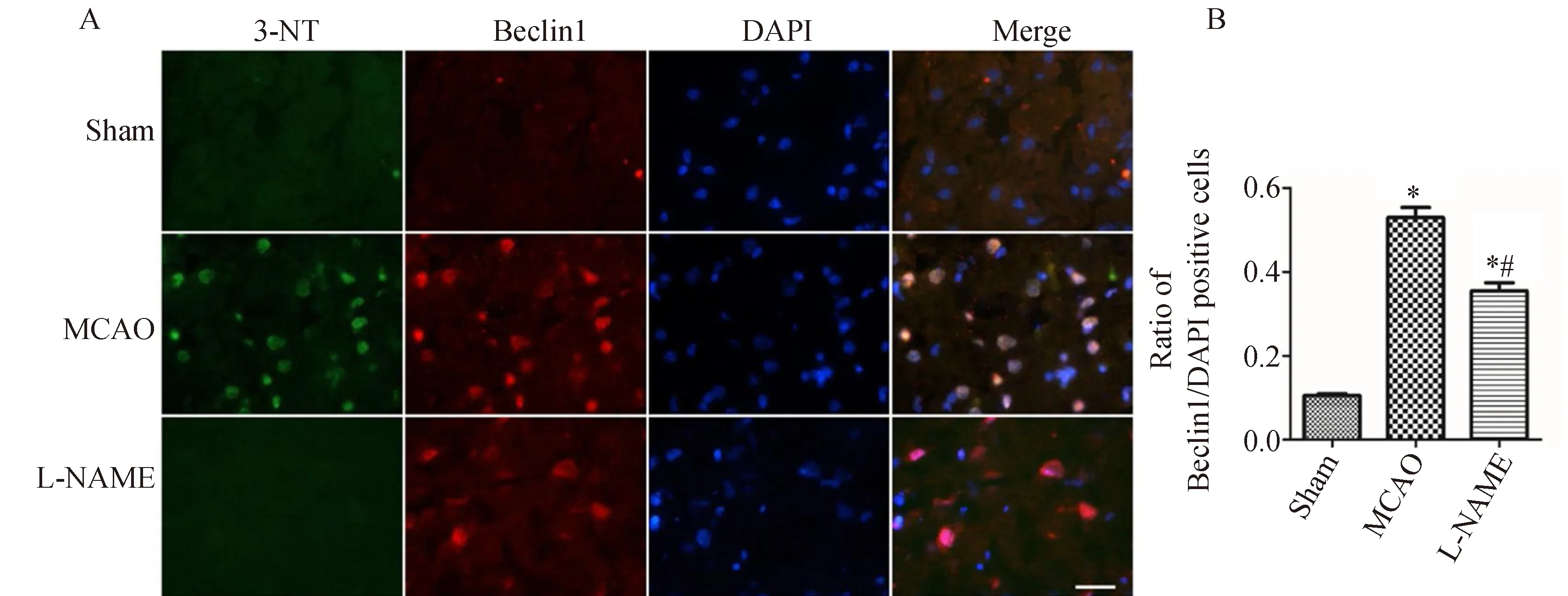
图1 L-NAME抑制大鼠再灌注24 h脑缺血半暗带区与3-NT相关的Beclin1表达Fig.1 Nω-nitro-L-arginine methyl ester (L-NAME) inhibits the production of 3-nitrotyrosine (3-NT)-related Beclin1 in the ischemic penumbra of cortices of middle cerebral artery occlusion (MCAO) rats 24 h after reperfusion
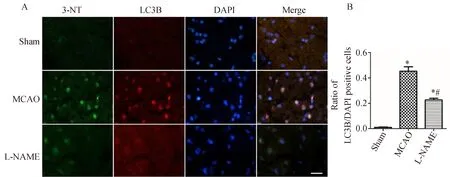
图2 L-NAME降低大鼠再灌注24 h脑缺血半暗带区与3-NT相关的LC3B表达Fig.2 Nω-nitro-L-arginine methyl ester (L-NAME) inhibits the expression of 3-nitrotyrosine (3-NT)-relatedLC3B in the penumbra of middle cerebral artery occlusion (MCAO)rats at 24 h after reperfusion
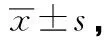
2.3 大鼠脑缺血半暗带区LC3B、Beclin1分别与3-NT共定位
通过免疫荧光双标可见,LC3B和Beclin1阳性细胞均呈红色荧光,3-NT阳性细胞为绿色荧光,细胞核染色为蓝色荧光。合并图像后,绿色荧光与红色荧光重合,说明LC3B和Beclin1与3-NT共定位,提示缺血再灌注后LC3B与Beclin1蛋白表达量的增加与NO的过量产生具有相关性(图1、2)。
3 讨论
脑缺血后的神经损伤机制十分复杂,因此至今仍缺乏针对病因的有效治疗[1]。氧化应激是脑缺血再灌注过程中神经损伤的重要因素,其与神经元凋亡之间的关系一直是脑保护剂研究的重点方向[3]。近年来,有研究[14]显示,除了神经元凋亡,神经元的自噬性细胞死亡与氧化应激损伤之间也有着密切的联系,可能是脑缺血损伤产生的一个重要因素。NO与自噬的相关性在心血管疾病中的研究较多,但其在脑血管疾病中的关系目前仍存在争议,有研究[13]认为自噬通过吞噬受损细胞器缓解缺血再灌注引起的氧化应激损伤;但也有研究[11,14]观察到NO与自噬具有协同作用,加重缺血再灌注损伤。本研究通过腹腔注射NOS抑制剂L-NAME抑制缺血再灌注后大鼠脑内NO的产生,观察NO的产生是否影响大鼠脑内自噬的激活,以探究NO与自噬的直接关系。
脑缺血、缺氧后多种信号分子参与了自噬激活[13]。作为调控自噬小体合成的上游蛋白,Beclin1是自噬小体形成过程必不可少的分子,对检测组织内自噬作用有着重要的意义[11]。已知上调Beclin1的表达可以激活自噬作用,体外培养的Beclin1缺失的细胞自噬减少。在自噬形成的初始阶段[9],Beclin1通过与PI3K形成复合体调节自噬相关基因(autophagy related gene, Atg)表达的Atg蛋白在自噬前体中的位置。Atg8家族的LC3蛋白可以诱导自噬体双层膜结构的形成,因此LC3一直存在于自噬体的膜结构中,作为自噬体形成的标志。哺乳动物体内的LC3蛋白存在3种不同的亚型(LC3A、LC3B、LC3C),这3种亚型的LC3蛋白在不同的组织和细胞内分布情况不同,但目前缺少足够的研究结果对其进行详细的区分,现阶段通常通过检测组织中LC3B蛋白含量代表组织内LC3蛋白的表达量[15]。本研究结果显示,在缺血再灌注24 h,自噬相关蛋白Beclin1和LC3B均可与ONOO-共定位,提示NO与脑缺血再灌注过程中脑组织自噬的激活存在相关性。
研究[11]表明,在大脑缺血再灌注几小时后,自噬相关蛋白表达量上升,参与缺血再灌注损伤的多个病理生理过程。但是自噬在脑缺血再灌注损伤过程中所扮演的角色仍存在争议。当自噬适度激活时[15],可促使细胞内蛋白质细胞器等垃圾物质降解,产生氨基酸、能量等补充细胞内物质不足,对细胞存活具有促进作用。Ye等[16]的研究表明,自噬的激活对新生缺氧缺血性脑病大鼠产生神经保护作用。而当自噬过度激活时,可破坏细胞内部稳态,扰乱细胞的正常代谢,导致细胞裂解,引起自噬性细胞死亡。Feng等[11]的研究结果显示,抑制自噬作用对脑缺血损伤具有保护作用。但是缺血再灌注后自噬表达的上调是否与NO的产生直接相关,目前的研究仍缺乏明确的证据。故而在本研究中,于MCAO术前30 min经腹腔注射NOS抑制剂,以减少缺血再灌注后大鼠脑内NO的产生。笔者观察到,作为NOS抑制剂,L-NAME可有效抑制大鼠MCAO模型中由NO介导的蛋白质损伤。同时,L-NAME也明显降低了MCAO大鼠脑组织中自噬相关蛋白LC3B和Beclin1的表达量,但仍高于Sham组。文献[17]报道L-NAME可以保护脑缺血损伤,改善MCAO大鼠的神经功能。因此,本研究推测NO介导的蛋白质损伤导致Beclin1和LC3B的表达应激性上调,且此时自噬的表达的上调可能加重了脑损伤。L-NAME通过抑制NOS活性,减少NO的产生,直接避免神经元的氧化应激损伤;同时,氧化应激损伤的减弱也避免了自噬的进一步激活,起到了间接的神经保护作用[18]。
了解再灌注介导的氧化应激和自噬之间的相互作用,以明确缺血性脑损伤的机制,对于基于tPA溶栓治疗的脑保护策略研究具有重要意义,且具有一定的临床价值。本研究证明缺血再灌注后NO的产生可上调自噬相关蛋白表达,抑制NO产生可降低自噬相关蛋白的表达量,产生脑保护作用。以上研究为进一步深入探讨氧化应激和自噬在脑缺血损伤过程中的相互作用关系提供了一定的科学依据,但是作为脑损伤过程中的重要因素,氧化应激与自噬错综复杂的关系仍需要进行更深层次的探究。
[1] Kalkonde Y V, Deshmukh M D, Sahane V, et al. Stroke is the leading cause of death in rural gadchiroli, india: a prospective community-based study [J]. Stroke, 2015, 46(7): 1764-1768.
[2] Bar-Or D, Bar-Or R, Rael L T, et al. Oxidative stress in severe acute illness [J]. Redox Biol, 2015, 4: 340-345.
[4] 黄语悠, 房亚兰, 刘克建 等. 一氧化氮及其衍生物在缺血性脑血管病中的作用 [J]. 首都医科大学学报, 2017, 38(1):67-71.
[5] Zhao H, Tao Z, Wang R, et al. MicroRNA-23a-3p attenuates oxidative stress injury in a mouse model of focal cerebral ischemia-reperfusion [J]. Brain Res, 2014, 1592: 65-72.
[6] Liu H, Li J, Zhao F, et al.Nitric oxide synthase in hypoxic or ischemic brain injury [J].Rev Neurosci, 2015,26(1): 105-117.
[7] Yuan Z, Liu W, Liu B, et al. Normobarichyperoxia delays and attenuates early nitric oxide production in focal cerebral ischemic rats [J].Brain Res, 2010,1352: 248-254.
[8] Yang H, Chen Y, Yu L, et al. Esculentoside A exerts anti-inflammatory activity in microglial cells [J]. Int Immunopharmacol, 2017, 51:148-157.
[9] Yin Y, Zhao Y, Han S, et al. Autophagy-ERK1/2-Involved Disinhibition of Hippocampal Neurons Contributes to the Pre-Synaptic Toxicity Induced by Aβ42 Exposure [J]. J Alzheimers Dis, 2017, 59(3):851-869.
[10] Haiying L, Jiang W, Haitao S, et al. Autophagy in hemorrhagic stroke: mechanisms and clinical implications [J]. Prog Neurobiol,2017, 4(2):1-19.
[11] Feng J, Chen X, Guan B, et al. Inhibition of peroxynitrite-induced mitophagy activation attenuates cerebral ischemia-reperfusion injury [J]. Mol Neurobiol, 2018, [Epub ahead of print].
[12] Coelho C H, Martins T F, Oliveira-Pelegrin G R, et al. Inhibition of neuronal nitric oxide synthase activity does not alter vasopressin secretion in septic rats [J]. Pituitary, 2017,20(3):333-339.
[13] Shin J K, Kang J W, Lee S M. Enhanced nitric oxide-mediated autophagy contributes to the hepatoprotective effects of ischemic preconditioning during ischemia and reperfusion [J]. Nitric Oxide, 2016, 58:10-19.
[14] Bu Q, Liu X, Zhu Y, et al. w007B protects brain against ischemia-reperfusion injury in rats through inhibiting inflammation, apoptosis and autophagy [J]. Brain Res, 2014, 1558:100-108.
[15] Zhang X, Yan H, Yuan Y, et al. Cerebral ischemia-reperfusion-induced autophagy protects against neuronal injury by mitochondrial clearance [J]. Autophagy, 2013, 9(9):1321-1333.
[16] Ye L, Feng Z, Doycheva D, et al. CpG-ODN exerts a neuroprotective effect via the TLR9/pAMPK signaling pathway by activation of autophagy in a neonatal HIE rat model [J]. Exp Neurol, 2018, 301(Pt A):70-80.
[17] Xue T F, Ding X, Ji J, et al. PD149163 induces hypothermia to protect against brain injury in acute cerebral ischemic rats [J]. J Pharmacol Sci, 2017, 135(3):105-113.
[18] 曾晓莉, 张文娟,赵博,等.慢性脑缺血神经保护机制及药物研究进展[J].中国脑血管病杂志,2017,14(11):607-611.

