DELLA蛋白缺失对拟南芥干旱胁迫耐受性的影响
王 玮,冯 起,张莉环,杨 宁*
(1 西北师范大学 生命科学学院,兰州 730070;2 中国科学院 西北生态环境资源研究院,内陆河流域生态水文重点实验室,兰州 730000)
赤霉素(gibberellins,GAs)属四环二萜类化合物,作用于植物整个生命周期,调节和控制着高等植物生长发育、分化开花和繁殖的不同过程[1-4],是一类生长促进类植物激素。在拟南芥的赤霉素信号转导通路中,GA与受体GID(gibberellin insensitive dwarf)和DELLA蛋白结合,在去磷酸酶TOPP4和E3泛素连接酶SLY1(sleepy1)作用下将DELLA去磷酸化并泛素化,随后进入降解途径降解,从而解除DELLA蛋白对GA应答基因的阻遏作用,启动应答基因表达[5-7]。因此DELLA蛋白作为转录抑制因子,在赤霉素信号传导途径发挥着重要的负调控作用。
赤霉素在干旱胁迫方面的作用机制研究还比较少[8],赤霉素作为植物体内促进发育的激素之一,其含量在水分缺失条件下的降低,是植物为了应对干旱而降低生长速率所进行的适应策略,并且赤霉素与脱落酸具有拮抗作用,因此植物在干旱胁迫下赤霉素应该被负调控[8-9]。一系列研究表明,冷、盐、干旱等非生物胁迫通过DREB1/CBF家族(dehydration-responsive element binding protein/c-repeat binding factor)转录因子上调GA代谢酶GA2ox(gibberellin 2-oxidase)基因表达,降低有生物活性的GA的含量,促进DELLA蛋白积累,抑制植物生长,从而提高植物对逆境胁迫的耐受能力[8, 10-11]。在土豆中过表达拟南芥赤霉素甲基转移酶基因,虽然降低了土豆中赤霉素的活性,但增加了植株对干旱的胁迫耐受能力[12]。干旱胁迫下,外源施加GA降低了拟南芥的耐受能力,提高了植株死亡率[13]。与此一致的是,在拟南芥中过表达GA合成酶基因,植株表现出GA过量的表型,同样降低了拟南芥对干旱胁迫的耐受能力;相反,GA合成酶基因缺失突变体却提高了其在干旱胁迫下的存活能力[8]。然而,拟南芥spy,一个表现出赤霉素过量表型的赤霉素负调控因子SPINDLY蛋白缺失突变体,却表现出对高盐和干旱较强的耐受能力[13],这一发现使得赤霉素相关突变体在干旱胁迫中的抗逆机制值得进一步研究。
本研究以表现出GA过量表型的拟南芥DELLA蛋白五缺突变体gai-t6rga-t2rga1-1rga2-1rga3-1(简称della)为研究对象,观察其在干旱胁迫下的存活率、失水率、萌发率等表型,检测脯氨酸、可溶性糖和丙二醛含量等生理指标,对发挥植物细胞脱水保护功能的胚胎晚期丰富蛋白编码基因LEA(late embryogenesis abundant protein)和ABA(abscisic acid)应答基因表达水平进行了定量分析,初步确定della突变体抗旱能力提高的表型及原因,为后期深入研究della突变体抗逆机制和选育抗旱植物的新方向奠定基础。
1 材料和方法
1.1 材 料
本实验所用拟南芥野生型Ler(Landsbergerecta,CS20)和della突变体(CS16298)均订购于Arabidopsis Biological Resource Center(ABRC)。种子用0.1% HgCl2表面消毒5~8 min,然后用无菌水冲洗6~8次,点播于1/2 MS固体培养基(MS盐+1%蔗糖+0.8%琼脂,pH 5.8)上。在4 ℃条件下春化3 d,放于培养间培养,光周期为16 h光照/8 h黑暗,温度22 ℃,光照强度300 μmol·m-2·s-1,相对湿度80%。
1.2 方 法
1.2.1生存率参考Qin等的方法[13],分3个生物学平行,每个平行的Ler和della种植到同一个花盆中,正常生长14 d后停止浇水,干旱胁迫21 d后重新浇水,复水7 d后统计2种实生苗的生存率。
1.2.2萌发率参考Xu等的方法[14],Ler和della种植到分别含0、200 mmol/L甘露醇的1/2 MS固体培养基中,春化后每24 h统计一次萌发率,连续统计7 d。实验分3个重复进行,每个平行100颗种子。
1.2.3叶片失水率参考Qin等的方法[13],摘取土壤中生长14 d的Ler和della幼苗绿色组织,随机分成3个生物学重复,置于22 ℃环境下的无盖培养皿中自然风干,分别在0、10、20、30、40、60、90、120、150、180 min时间点测量材料重量。叶片失水率=[(鲜重-风干后重量)/鲜重]×100%。
1.2.4生理指标检测干旱胁迫按照1.2.1的方法处理,分别于第3、6、9、12、15 d取样并分为3个重复。脯氨酸、可溶性糖、丙二醛含量检测按照试剂盒说明书进行。
1.2.5基因定量表达分析干旱胁迫按照1.2.2的方法处理,0.1 g植物材料用Trozol法提取总RNA,1 μg总RNA按照PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)说明书方法去除基因组DNA并反转录。荧光定量PCR加样体系与仪器程序参考SYBR Premix Ex TaqTMⅡ (Tli RNaseH Plus)说明书。每一个基因的相对表达量通过2-ΔΔCT方法计算,用GAPC作为内参基因。数据至少3次生物学重复。荧光定量PCR所需的引物如表1所示。

表1 本研究所用到的引物Table 1 All primers used in this study
** 表示0.01显著性水平,下同** indicate significant differences P < 0.01, the same as below
2 结果与分析
2.1 干旱胁迫对Ler和della生长的影响
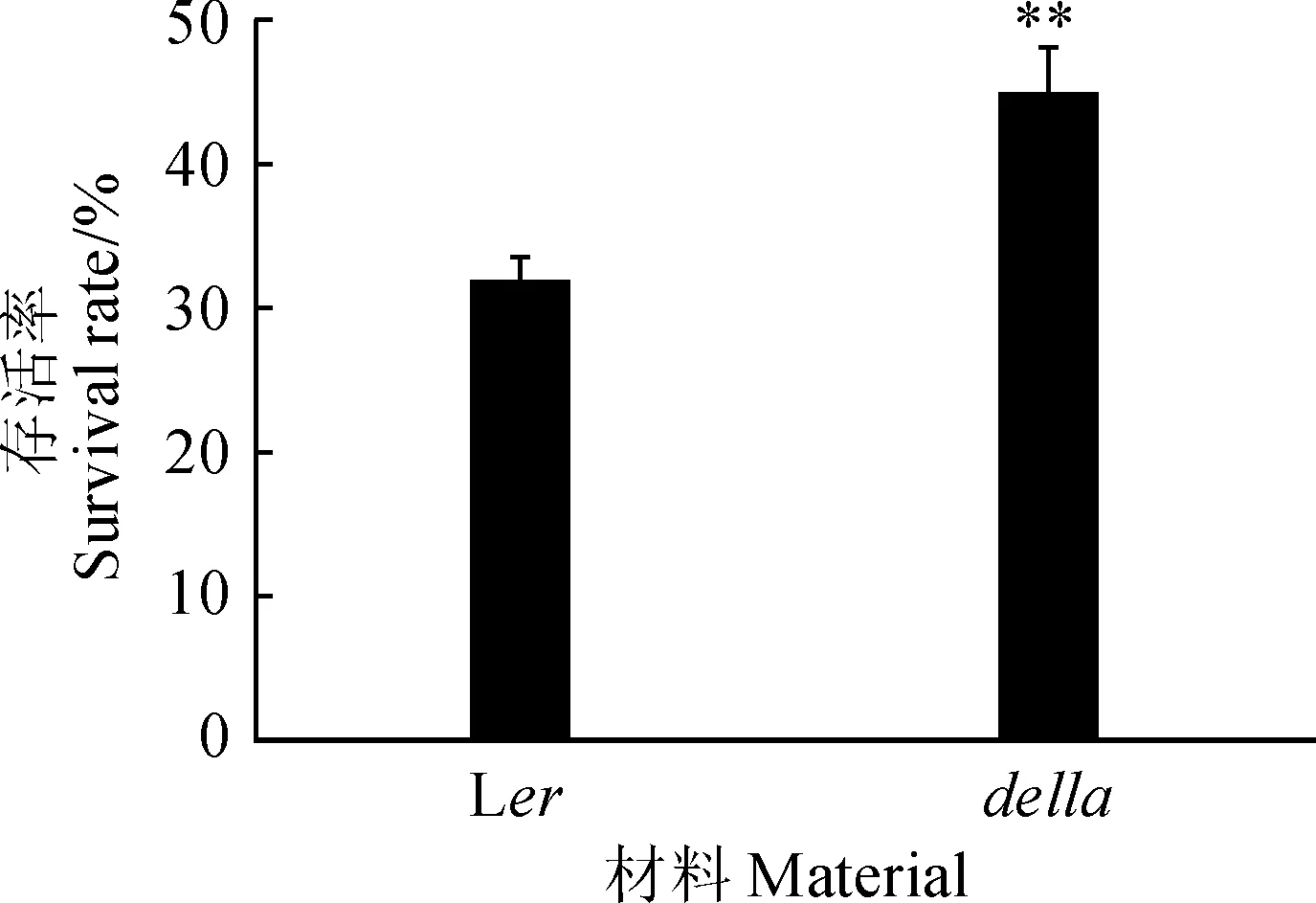
为比较Ler和della在相同干旱胁迫下生长状态的差异,2种拟南芥种植在同一个花盆中,以确保干旱处理条件的一致性。经21 d干旱胁迫后,野生型和突变体都表现出多数叶片干枯萎蔫的胁迫症状,但突变体的叶片颜色较绿。复水7 d后,统计Ler的生存率约为31.7%,而della的生存率约为44.9%,显著高于野生型对照(图1)。结果说明表现出生长快、开花早等GA过量表型的della突变体耐受干旱胁迫的能力比野生型强。
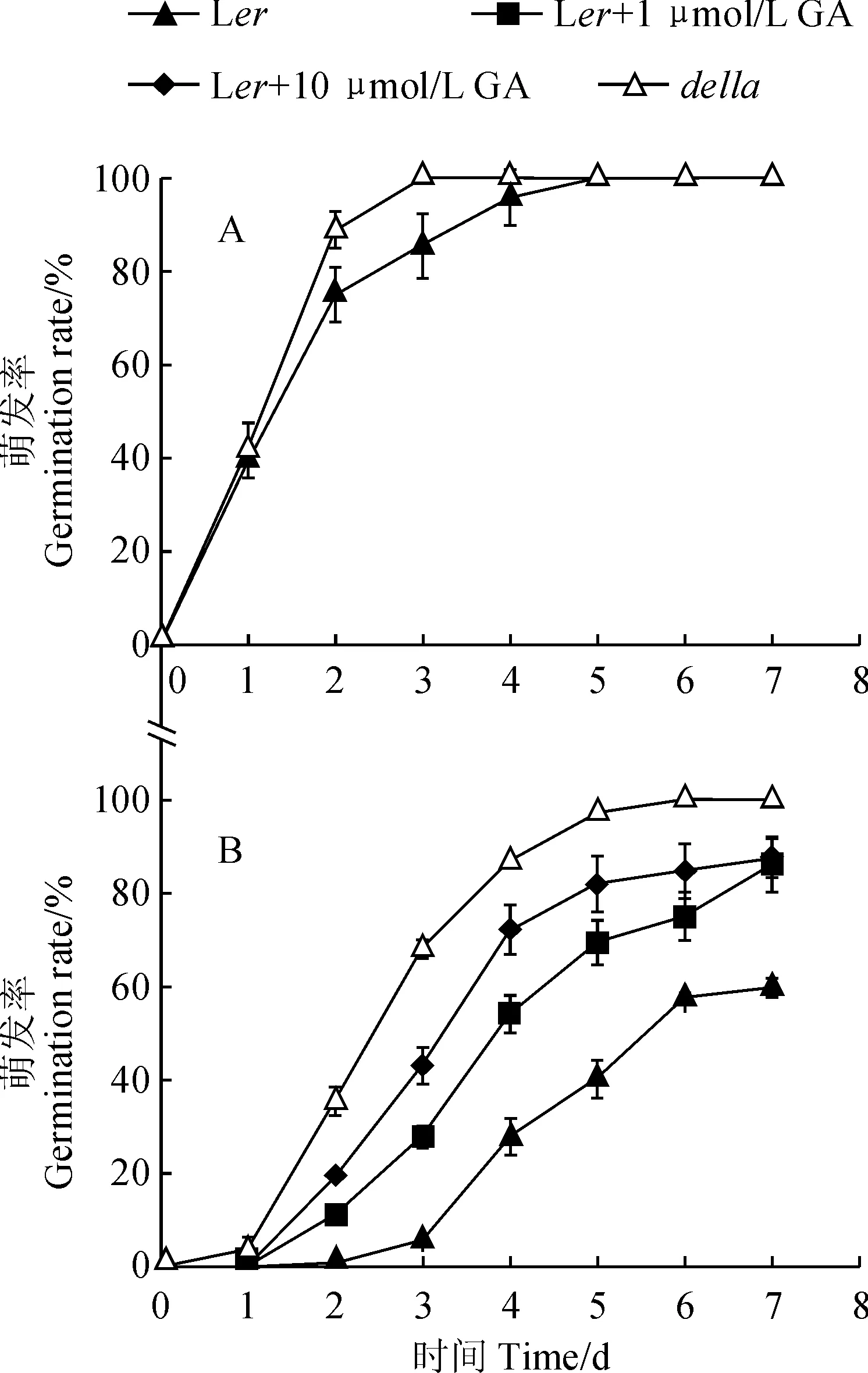
萌发率结果如图2所示,正常生长条件下,della的萌发率略高于野生型,在第3天即可达到100%萌发,而Ler在第3天的萌发率约为85.4%,在第5天才能够100%萌发。200 mmol/L甘露醇模拟干旱胁迫时,野生型Ler和突变体della的萌发率都受到明显影响,但della的萌发率显著高于野生型,并且在第6天完全萌发,此时Ler的萌发率仅为57.6%。外源施加GA能够增加野生型植株在甘露醇胁迫下的萌发率,但仍无法达到della萌发率水平。这些结果表明della突变体耐受渗透胁迫的能力比野生型强,并且萌发能力提高的表型特征可能不完全是GA信号通路持续激活引起的。
2.2 干旱胁迫对Ler和della叶片失水率的影响
野生型和突变体离体叶片的失水速度的检测结果如图3所示,随着干旱处理时间的增加,2种植物失水率都逐渐增大,但della的失水速度显著低于野生型,处理180 min后,della的失水率达到44.9%,而Ler的失水率则高达54.2%。说明较低的植株失水速度是della突变体较野生型耐旱的原因之一。
2.3 干旱胁迫对Ler和della脯氨酸、可溶性糖和丙二醛含量的影响
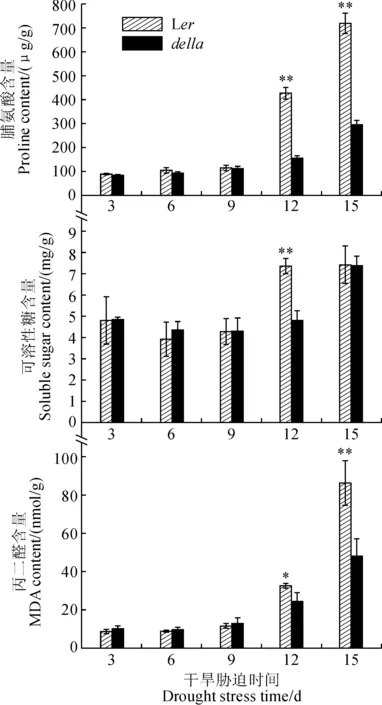
对Ler和della的脯氨酸和可溶性糖含量检测结果显示,正常生长条件下,与Ler相比della的脯氨酸和可溶性糖含量没有显著性差异,干旱胁迫后della的脯氨酸和可溶性糖含量升高的速率比Ler慢(图4)这些结果表明在相同干旱处理条件下,della突变体受到的胁迫程度较低,同时也说明渗透调节物质含量和变化速率并不是della突变体较Ler耐旱的原因。
A.对照,正常水分供应;B. 200 mmol/L甘露醇模拟干旱胁迫A. Control; B. 200 mmol/L Mannitol
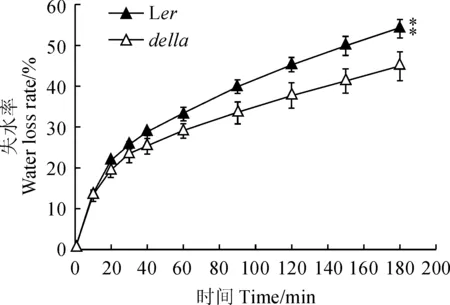
图3 Ler和della离体叶片失水率Fig.3 The water loss rate of leaves detached from Ler and della mutant
* 表示0.05水平显著性,下同* indicates significant differences P < 0.05,the same as below
丙二醛是植物膜脂过氧化的产物之一,其含量反映了植物胁迫后的氧化损伤程度。图4结果所示,干旱胁迫后della的丙二醛含量升高的速率比Ler慢,同样说明della突变体胁迫后受到的氧化损伤程度较低。
2.4 干旱胁迫下LEA基因的表达模式
在拟南芥赤霉素负调控因子SPINDLY蛋白缺失突变体spy中,3个LEA基因(At2g03850、At2g36640和At3g17520)的高表达可能是其对干旱胁迫耐受的原因[13],为检测这3个LEA基因在Ler和della突变体中的表达模式,利用qRT-PCR检测At2g03850、At2g36640和At3g17520 mRNA的干旱诱导表达水平。结果如图5所示,干旱胁迫后,除AT2g36640基因在Ler和della表达模式相似以外,At2g03850和At3g17520基因在della中的上调表达变化倍数均高于Ler,这说明较高的LEA基因上调表达倍数可能是导致della突变体较野生型耐旱的另一个原因。
2.5 干旱胁迫下ABA应答基因的表达模式
干旱条件下,ABA通过调节气孔关闭降低蒸腾作用防止水分丢失、诱导抗逆相关基因表达,从而增强植物的抗旱能力[15]。为检测della突变体抗旱能力较强的表型是否由于ABA信号应答引起的,对LOX3、COR15b和COR413等3个ABA应答基因的表达量进行检测。结果表明(图6),干旱胁迫后,这3个ABA应答基因在della中的上调表达程度均低于野生型。尤其是LOX3基因在Ler中干旱胁迫1 h后表达量升高了约125倍,而在della突变体中仅升高了约17倍。这些结果表明,della突变体中ABA信号并没有过度激活,较之野生型在干旱胁迫后的表现反而受到了抑制。
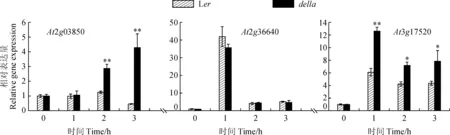
图5 At2g03850、At2g36640和At3g17520基因表达模式Fig.5 Gene expression patterns of At2g03850, At2g36640, and At3g17520

图6 LOX3、COR15b和COR413基因表达模式Fig.6 Gene expression patterns of LOX3, COR15b, and COR413
3 讨 论
植物激素是一类小分子化合物,调控了植物生长和发育以及对环境变化的响应。通过改变激素的合成、运输和信号转导,植物能够调节生长与胁迫耐受的平衡,促进植物在胁迫环境中生存。作为生长促进类激素,在低温、高盐和干旱胁迫下,赤霉素的含量和信号转导会降低来抑制植物生长抵抗逆境;相反,在树荫和水淹环境下,赤霉素的含量和信号转导又会增强来促进植物生长从而逃离不利环境[8]。越来越多的证据表明,GA缺陷虽然植株矮化但增加了其对胁迫的耐受能力[8, 10-12, 16]。然而,表现出GA过量表型的spy突变体通过降低在干旱胁迫下的失水速率、诱导LEA基因和CKX基因表达,提高了植物对高盐和干旱胁迫的耐受性,推测可能是由于SPINDLY蛋白与其他蛋白(而不是DELLA蛋白)相互作用参与了胁迫应答,因为外源施加GA降解DELLA后,拟南芥对干旱胁迫不耐受[13]。在本研究中,同样具有GA过量表型的拟南芥DELLA蛋白五缺突变体也表现出对干旱胁迫有较高的耐受能力,并且这种耐受能力并不是脯氨酸、可溶性糖等小分子渗透调节物质含量高导致的,而是由于在干旱胁迫后,della突变体叶片失水速度较野生型慢以及LEA基因表达量上调程度较高引起的。这一结果与在spy突变体中观察到的结果一致,说明单纯的DELLA蛋白失活能够提高植物胁迫耐受能力,只是这种失活不能是由于GA水平升高引起,可能存在其他机制。
ABA通过正调控SnRK2s(sucrose non-fermenting1-related protein kinases 2)促进气孔关闭减少植物在干旱胁迫下的水分丢失[15, 17],Lin等[9]的研究发现GA能够降低SnRK2活性拮抗ABA信号通路。干旱胁迫后的della突变体中,因GA信号持续激活,ABA应答基因的上调表达的程度低于野生型,这一结果说明della突变体干旱胁迫下失水率较低的表型并不是ABA含量升高引起的,也存在着其他原因(图7)。但另一方面该结果解释了della突变体在甘露醇胁迫下萌发率较快的原因可能由于ABA应答程度较低引起的。
本研究发现DELLA蛋白缺失植物表现出干旱胁迫耐受的表型,这种表型的产生是由于della突变体在干旱胁迫后失水速率低、LEA基因诱导上调表达程度高引起的。但是通过提高GA水平降解DELLA蛋白反而降低了植物对干旱胁迫的耐受,说明DELLA蛋白在植物平衡生长发育和胁迫应答的功能方面仍待进一步研究。这个发现改变了以往GA过量表型突变体对干旱胁迫耐受程度低的认识,为深入研究DELLA蛋白功能及其在干旱胁迫下GA与ABA拮抗响应中的作用铺垫了基础,也为筛选抗旱植物提供了新的思路。
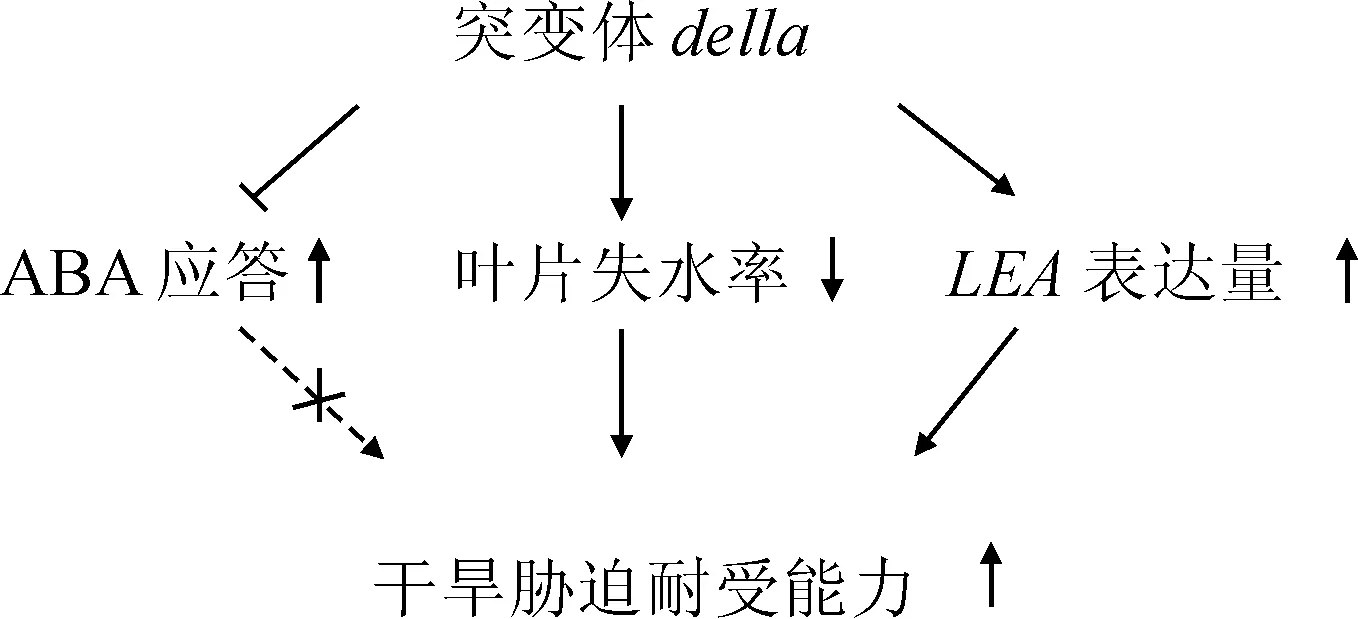
图7 della突变体增强干旱胁迫耐受性的模式图Fig.7 A model showing the della enhancing drought tolerance
参考文献:
[1] PISKUREWICZ U, JIKUMARU Y, KINOSHITA N,etal. The gibberellic acid signaling repressor RGL2 inhibitsArabidopsisseed germination by stimulating abscisic acid synthesis and ABI5 activity[J].PlantCell, 2008,20(10): 2 729-2 745.
[2] ACHARD P, GUSTI A, CHEMINANT S,etal. Gibberellin signaling controls cell proliferation rate inArabidopsis[J].CurrentBiology, 2009,19(14): 1 188-1 193.
[3] PLACKETT A R, THOMAS S G, WILSON Z A,etal. Gibberellin control of stamen development: a fertile field[J].TrendsinPlantScience, 2011,16(10): 568-578.
[4] TURNBULL C. Long-distance regulation of flowering time[J].JournalofExperimentalBotany, 2011,62(13): 4 399-4 413.
[5] OLSZEWSKI N, SUN T P,GUBLER F. Gibberellin signaling: biosynthesis, catabolism, and response pathways[J].PlantCell, 2002, 14 Suppl: S61-80.
[6] CAO D, CHENG H, WU W,etal. Gibberellin mobilizes distinct DELLA-dependent transcriptomes to regulate seed germination and floral development inArabidopsis[J].PlantPhysiology, 2006,142(2): 509-525.
[7] WANG W, ZHANG J, QIN Q,etal. The six conserved serine/threonine sites of REPRESSOR OFga1-3 protein are important for its functionality and stability in gibberellin signaling inArabidopsis[J].Planta, 2014,240(4): 763-779.
[8] COLEBROOK E H, THOMAS S G, PHILLIPS A L,etal. The role of gibberellin signalling in plant responses to abiotic stress[J].JournalofExperimentalBotany, 2014,217(Pt 1): 67-75.
[9] LIN Q, WU F, SHENG P,etal. The SnRK2-APC/C(TE) regulatory module mediates the antagonistic action of gibberellic acid and abscisic acid pathways[J].NatureCommunications, 2015, 6: 7 981.
[10] ACHARD P, CHENG H, DE GRAUWE L,etal. Integration of plant responses to environmentally activated phytohormonal signals[J].Science, 2006,311(5 757): 91-94.
[11] ACHARD P, GONG F, CHEMINANT S,etal. The cold-inducible CBF1 factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gibberellin metabolism[J].PlantCell, 2008,20(8): 2 117-2 129.
[12] NIR I, MOSHELION M,WEISS D. TheArabidopsisgibberellin methyl transferase 1 suppresses gibberellin activity, reduces whole-plant transpiration and promotes drought tolerance in transgenic tomato[J].PlantCellandEnvironment, 2014,37(1): 113-123.
[13] QIN F, KODAIRA K S, MARUYAMA K,etal.SPINDLY, a negative regulator of gibberellic acid signaling, is involved in the plant abiotic stress response[J].PlantPhysiology, 2011,157(4): 1 900-1 913.
[14] XU J, XING X J, TIAN Y S,etal. TransgenicArabidopsisplants expressing tomato glutathione S-transferase showed enhanced resistance to salt and drought stress[J].PLoSOne, 2015,10(9): e0136960.
[15] PANTIN F, MONNET F, JANNAUD D,etal. The dual effect of abscisic acid on stomata[J].NewPhytologist, 2013,197(1): 65-72.
[16] CLAEYS H, SKIRYCZ A, MALEUX K,etal. DELLA signaling mediates stress-induced cell differentiation inArabidopsisleaves through modulation of anaphase-promoting complex/cyclosome activity[J].PlantPhysiology, 2012,159(2): 739-747.
[17] ACHARYA B R, JEON B W, ZHANG W,etal. Open Stomata 1 (OST1) is limiting in abscisic acid responses ofArabidopsisguard cells[J].NewPhytologist, 2013,200(4): 1 049-1 063.

