3种外源诱导剂预处理对甜瓜抗病特征及其Fom-2和CHT基因表达的影响
郭海艳,刘 璐,孙宇蛟,沙彤芸,王学征*
(1 农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨150030;2 东北农业大学 园艺园林学院,哈尔滨150030; 3 东北农业大学 生命科学学院,哈尔滨150030)
甜瓜(CucumismeloL.)是深受人们喜爱的一种水果型蔬菜,味道甜美,营养丰富,在世界各地均有种植。然而,枯萎病严重制约着中国甜瓜产业的健康发展,因此提高甜瓜枯萎病抗性迫在眉睫。防治甜瓜枯萎病最常用的方法是施用农药,但施用农药同时也对生态环境和人类生命安全构成了一定的潜在威胁。水果农药残留是影响其食用安全的重要因素之一,农药最高残留限量也成为国际上各贸易国之间重要的技术壁垒[1]。因此,切实提高甜瓜自身抗病性是防治甜瓜枯萎病最环保有效的方式。
甜瓜枯萎病抗性相关基因有Fom-2、CHT、cab-1和Prv2等[2]。Fom-2在1973年被Risser研究发现,抗枯萎病生理 小种 0 和 1 感 生理小种2,由Silberstein 等在2003 年用分子标记将此基因定位在甜瓜遗传图谱上,直到 2004 年 Tarek分离克隆了甜瓜抗尖镰孢枯萎病菌的Fom-2基因,并验证其对该病菌的 0 和 1 型 生理小种有专化抗性[2]。目前为止此基因是世界公认的甜瓜抗枯萎病基因。
CHT为几丁质酶基因,能够调控几丁质酶的含量,几丁质酶对立枯丝核菌等20多种病原真菌和非病原真菌的菌丝生长或孢子萌发具有抑制作用。除抗真菌外,几丁质酶对细菌、昆虫、螨等也表现出一定抗性[3],Schlumbaum A等[4]最先研究发现,菜豆积累的几丁质酶经过提纯,在体外能够强烈地抑制绿色木霉(Trichodermaviride)菌丝的生长。Marchant R等[5]利用基因枪法,将一种水稻碱性几丁质酶基因转入感蔷薇黑斑病的蔷薇Glad Tidings品种中,结果该转基因蔷薇使黑斑病的严重度降低了13%~43%。
研究发现,茉莉酸甲酯[4-6]、水杨酸[7]、钙离子在调控植物生长发育、抗逆、抗病反应方面都具有重要作用。茉莉酸甲酯(methyl jasmonate,MeJA)是高等植物体内天然存在的生长调节因子,外源 MeJA处理能够诱导黄瓜[8-9]、玉米[10]、水稻[11]等作物的抗病性。研究表明,外源MeJA处理能够诱导果实中抗病基因的表达、提高防御酶的活性、活化次生代谢途径等[8,12-14]。张智慧等[15]使用外源MeJA显著减轻了抗性水稻的稻瘟病害,宾金华等[16]证明MeJA处理烟草幼苗不仅可以提高幼苗抗炭疽病的能力,同时显著上调PR-1、PR-2、PR-5和TA-JA2等抗性基因的表达量,向妙莲等[17]研究表明MeJA浸种可有效减轻水稻幼苗白叶枯病的发生。
水杨酸(salicylic acid,即SA)为邻羟基苯甲酸,在植物体内合成,含量很低,可以在韧皮部运输,并起着独特的作用,是一种新的植物内源激素[7]。SA能够加速被侵染部位细胞的死亡,诱导系统抗性产生,诱导某些抗性基因及抗性相关蛋白的表达,进而影响植株的某些抗性生理反应。范存斐等[18]研究表明,采后水杨酸处理能够通过诱导厚皮甜瓜的苯丙烷代谢增强果实对采后病害的抗性。曾凯芳等[19]认为,SA处理能显著抑制果实病斑扩展,有效降低果实的接种发病率, 提高绿熟芒果对炭疽病的抗病性。
本实验以甜瓜抗枯萎病品种MR-1、感枯萎病品种M1-15为试验材料,应用SA、MeJA和Ca2+作为外源诱导剂,无菌水作为对照。采用荧光定量PCR技术分析抗病相关基因Fom-2、CHT的差异表达,试图通过诱导提高甜瓜抗病基因Fom-2、CHT的表达水平来防御甜瓜枯萎病菌侵染,以期找到防治甜瓜枯萎病的高效新方法。
1 材料和方法
1.1 试验材料
甜瓜枯萎菌(Fusariumoxysporumf.sp.melonis)生理小种Race 1由东北农业大学西甜瓜分子育种实验室分离、鉴定、保存。抗枯萎病甜瓜品种MR-1、感枯萎病甜瓜品种M1-15种子由东北农业大学西甜瓜分子育种实验室提供。PDA培养基组分: 马铃薯400 g,葡萄糖40 g,琼脂40 g,蒸馏水2 L[20]。Armstrong培养基组分:葡萄糖 20 g,蒸馏水 1 L,KH2PO41.1 g, KCl 1.6 g,ZnSO40.2 mg,Ca(NO3)25.9 g,MgSO4·7H2O 0.4 g,FeCl30.2 mg[21]。反转录试剂盒由全式金公司提供,荧光定量PCR引物由上海生工合成。
1.2 外源诱导及病原菌接种
1.2.1甜瓜枯萎病菌培养利用 PAD培养基活化病原菌,接种于Armstrong培养基上,震动培养2~3 d(28 ℃、120 r/min)。取出后,用4层无菌纱布过滤培养液,再用无菌水稀释,制成孢子悬浮液。镜检,孢子浓度为1×106个孢子/mL[22]。
1.2.2种子处理选取饱满无伤甜瓜种子,进行常规消毒,经25~28 ℃恒温催芽,待露白后播种于经过121 ℃高温高压灭菌2 h的育苗土中,待2片真叶时进行外源诱导处理。
1.2.3幼苗处理根据前期试验[23]选出的最适浓度为1 mmol/L SA、1.2 mmol/L MeJA、220 mg/L Ca2+分别喷施处理甜瓜幼苗,每个处理10株苗,3次重复,无菌水作为对照。在喷施2 d后接种甜瓜枯萎菌,扣小棚保持温度在25~28 ℃,相对湿度大于90%,保温保湿5 d后,观察发病情况,进行病情调查,计算病情指数。分别于接种后1、3、5、7、9 d取甜瓜叶片,测定相关抗性基因表达量的变化。
1.2.4叶片病情分级甜瓜枯萎病病情分级参照《中华人民共和国农业行业标准》中的相关规程。病情分级标准为:0级,无病症;1级,子叶萎蔫或部分子叶与真叶轻微萎蔫;2级,1片真叶萎蔫或子叶较重萎蔫;3级,子叶及部分真叶萎蔫;4级,整株轻度萎蔫,部分枯死;5级,整株严重萎蔫并枯死。病情指数计算公式为:病情指数(%)=∑(级别×株数)/(总株数×最高代表级数)×100。
1.3 Fom-2、CHT基因差异表达分析
甜瓜叶片总RNA的提取采用改进的Trizol法[24],在液氮条件下,将样品研磨成粉末,取50~100 g粉末样品加入预先装有1 mL Trizol 试剂的离心管中,充分振荡15 s,充分乳化后,在室温下静置5 min。加入200 μL氯仿,充分振荡15 s,充分乳化后,常温下静置2~3 min。于4 ℃下,12 000 r条件下离心15 min。取上层清液,加入等体积异丙醇。颠倒混匀,-20 ℃冰箱静置10 min。在管壁出现胶状沉淀,即为RNA。于4 ℃下,12 000 r离心10 min,弃去上清。向沉淀中加入1 mL 75%DEPC乙醇,缓慢地沿管壁加入,轻轻上下颠倒洗涤离心管壁。于4 ℃下,7 500 r离心5 min,弃去上清,重复一次。在超净工作台将RNA样品晾干3~10 min,不可以离心或者加热。干燥后加入50 μL的DEPC水溶解RNA,置于-80 ℃保存。
以总 RNA 为模板,按照由全式金公司反转录试剂盒合成cDNA,-20 ℃保存备用。实时荧光定量PCR目标基因Fom-2、CHT和内参基因Cm-Actin的扩增引物由上海生工合成(表1)。荧光定量PCR总体系20 μL:10 μL 2×SYBR qPCR Mix,1 μL cDNA,上下游引物各0.5 μL,8.2 μL水。反应程序为:94 ℃预变性 30 s, 94 ℃变性 5 s,50 ℃退火 15 s,72 ℃延伸10 s, 40个循环。每个样品重复3次,反应结束后,进行溶解曲线分析。
1.4 甜瓜的病情指数与抗病基因的相关性分析
分别记录抗病甜瓜和感病甜瓜在几种外源诱导剂预处理后不同时期病情指数与其相应时期的Fom-2和CHT基因表达量。使用SPSS22.0软件进行相关性分析。
1.5 数据处理
采用Excel 2015进行试验数据统计,采用SPSS22.0软件进行差异显著性分析,2-ΔΔCT法[25]进行基因表达相对变化分析。
2 结果与分析
2.1 外源预处理对接种后2品种病情指数的影响
不同抗感甜瓜品种MR-1、M1-15在外源预处理后,枯萎病病情指数均有不同程度降低(表2),不同时间和不同外源预处理对甜瓜枯萎病的诱导效果不同(图1),总体表现出一定的时间效应。其中,MeJA和SA处理下的病情指数显著低于对照,且随着处理时间延长,病情指数呈下降趋势,表明MeJA和SA具有提高甜瓜枯萎病抗性的作用。而Ca2+处理后,植株的病情指数与对照无显著差异,诱导效果不明显。
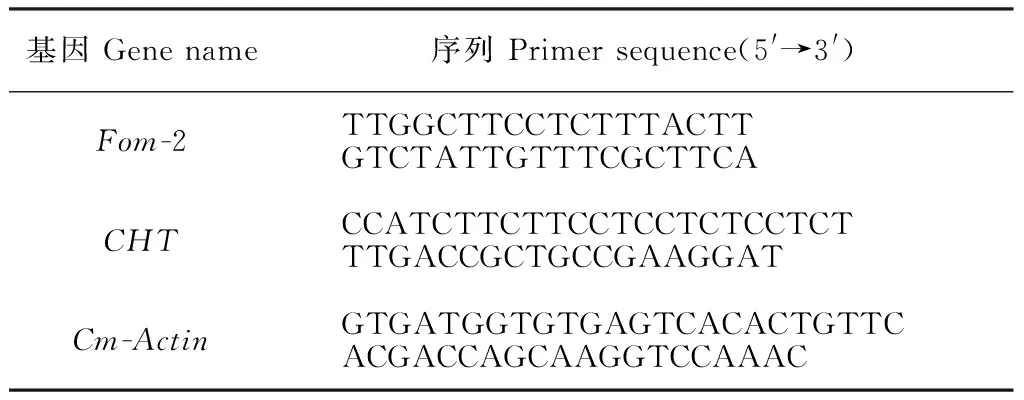
表1 扩增引物序列Table1 Target gene sequences of primers
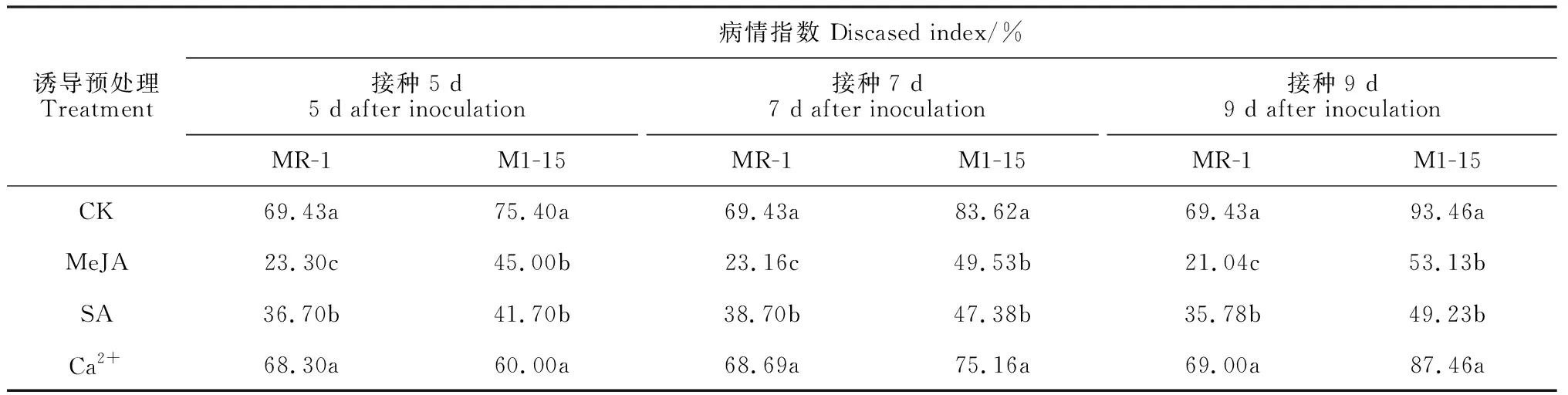
表2 外源预处理对甜瓜枯萎病病情指数的影响Table 2 Effect of different treatments on Fusarium wilt disease index in melon

A.抗病甜瓜品种(MR-1);B.感病甜瓜品种(M1-15);CK.接种枯萎病(对照); MeJA.外源MeJA预处理后接种甜瓜枯萎病;SA. 外源SA预处理后接种枯萎病; Ca2+.外源Ca2+预处理后接种枯萎病A. Resistant melon(MR-1); B. Susceptible melon (M1-15); CK. Inoculation blight control; MeJA. Inoculation of melon wilt after pretreatment with exogenous MeJA; SA. Inoculation of fusarium wilt after exogenous SA pretreatment; Ca2+. Inoculation of fusarium wilt after pretreatment with exogenous Ca2+
2.2 甜瓜叶片总RNA提取
使用Trizol法提取甜瓜叶片中总RNA,其凝胶电泳如图2,28S和18S带型清晰,没有拖带现象,5S带较浅,总RNA完整性较好。可以反转录,进行定量分析。
2.3 外源预处理诱导下甜瓜叶片Fom-2基因表达分析
经外源诱导处理后,抗病甜瓜品种MR-1植株叶片中Fom-2基因出现差异表达,如图3所示,接种后1、3和5 d时,MeJA和SA处理的植株叶片中Fom-2基因表达均显著高于Ca2+处理和对照,1和5 d时Ca2+处理与对照无显著差异,3 d 时Ca2+处理显著低于对照;接种后的7~9 d,MeJA处理的叶片中Fom-2基因表达显著高于其他3个处理,SA处理显著高于Ca2+处理和对照,7 d时Ca2+处理显著低于对照,9 d时Ca2+处理与对照无显著差异;MeJA和SA处理后,接种9 d时叶片中Fom-2基因表达整体呈先上升再下降趋势,分别在7、5 d时达到峰值,且均显著高于其他时期,是其他时期的1.41~11.02倍和2.89~9.589倍,接种Ca2+处理和对照组均整体呈平缓趋势。
1、2、3分别表示甜瓜材料叶片总RNA1, 2 and 3 indicate total RNA of melon leaf

不同大写字母表示同一处理不同时间的差异显著(P≤0.05);不同小写字母表示同一时间不同处理间差异显著(P≤0.05);下同The different capital letters indicate significant differences in the same treatment at different times (P≤0.05);The different normal letters indicate significant differences between different treatments at the same time (P≤0.05); Same as below
经外源诱导处理后,感病甜瓜品种M1-15植株叶片中Fom-2基因出现差异表达。如图4所示,接种后所有时期,MeJA处理的叶片中Fom-2基因表达显著高于其他3个处理,SA处理显著高于Ca2+处理和对照,Ca2+处理与对照无显著差异。MeJA和SA处理后,接种9 d时叶片中Fom-2基因的表达整体呈上升趋势,均在9 d时达到峰值,且显著高于其他时期,分别是其他时期的3.88~8.9倍和1.99~6.5倍;Ca2+处理和对照组均整体呈平缓趋势,7~9 d时Ca2+处理的Fom-2基因的表达急剧上升,达到峰值,显著高于其他时期,是其他时期的1.72~2.62倍。
结果表明,不同外源诱导后抗病品种MR-1、感病品种M1-15中Fom-2基因均出现差异表达。其中,SA、MeJA可以诱导其上调表达,而Ca2+诱导其上调表达无显著效果。
2.4 外源预处理诱导下甜瓜叶片CHT基因表达量分析
经不同外源诱导处理下,抗病甜瓜MR-1叶片中CHT基因表达出现不同变化,如图5所示:接种后1、3和5 d,MeJA和SA处理叶片中CHT基因表达均显著高于Ca2+处理和对照,1、5 d时Ca2+处理与对照无显著差异,3 d 时Ca2+处理显著低于对照;接种后7~9 d,MeJA处理的叶片中CHT基因的表达显著高于其他3个处理,SA处理显著高于Ca2+处理和对照,7 d时Ca2+处理显著高于对照,9 d时Ca2+处理与对照无显著差异; MeJA处理后,接种9 d内叶片中CHT基因表达整体呈先上升再下降再上升趋势,3 d时达到第一个峰值,显著高于其他时期,是其他时期的0.21~6.32倍,7 d时达到第二个峰值,显著高于1、3、5 d三个时期;SA处理后,接种9 d内整体呈上升趋势,7 d时达到峰值,显著高于其他时期,是其他时期的2.32~22.19倍, Ca2+处理和对照组均整体呈平缓趋势。

图4 不同诱导预处理对接种后感病甜瓜M1-15叶片中的Fom-2 基因表达的影响Fig.4 Effect of different induced pretreatments on the expression of Fom-2 gene in Muskmelon M1-15 leaves post inoculation
经不同外源处理诱导后,感病甜瓜M1-15植株叶片中CHT基因表达出现不同变化,如图6所示:接种后所有时期,MeJA处理的植株叶片中CHT基因表达显著高于其他3个处理,SA处理显著高于Ca2+处理和对照,1、3、5 d时Ca2+处理与对照无显著差异,3 d时Ca2+处理显著低于对照,7 d时Ca2+处理显著高于对照。MeJA和SA处理后,接种9 d时叶片中CHT基因表达整体呈上升趋势,分别在9、7 d时达到峰值,且均显著高于其他时期,分别是是其他时期的2.66~12.45倍和1.90~10.60倍, Ca2+处理和对照组均整体呈平缓趋势,7~9 d时Ca2+处理CHT基因表达急剧上升,达到峰值,显著高于其他时期,是其他时期的0.94~1.90倍。
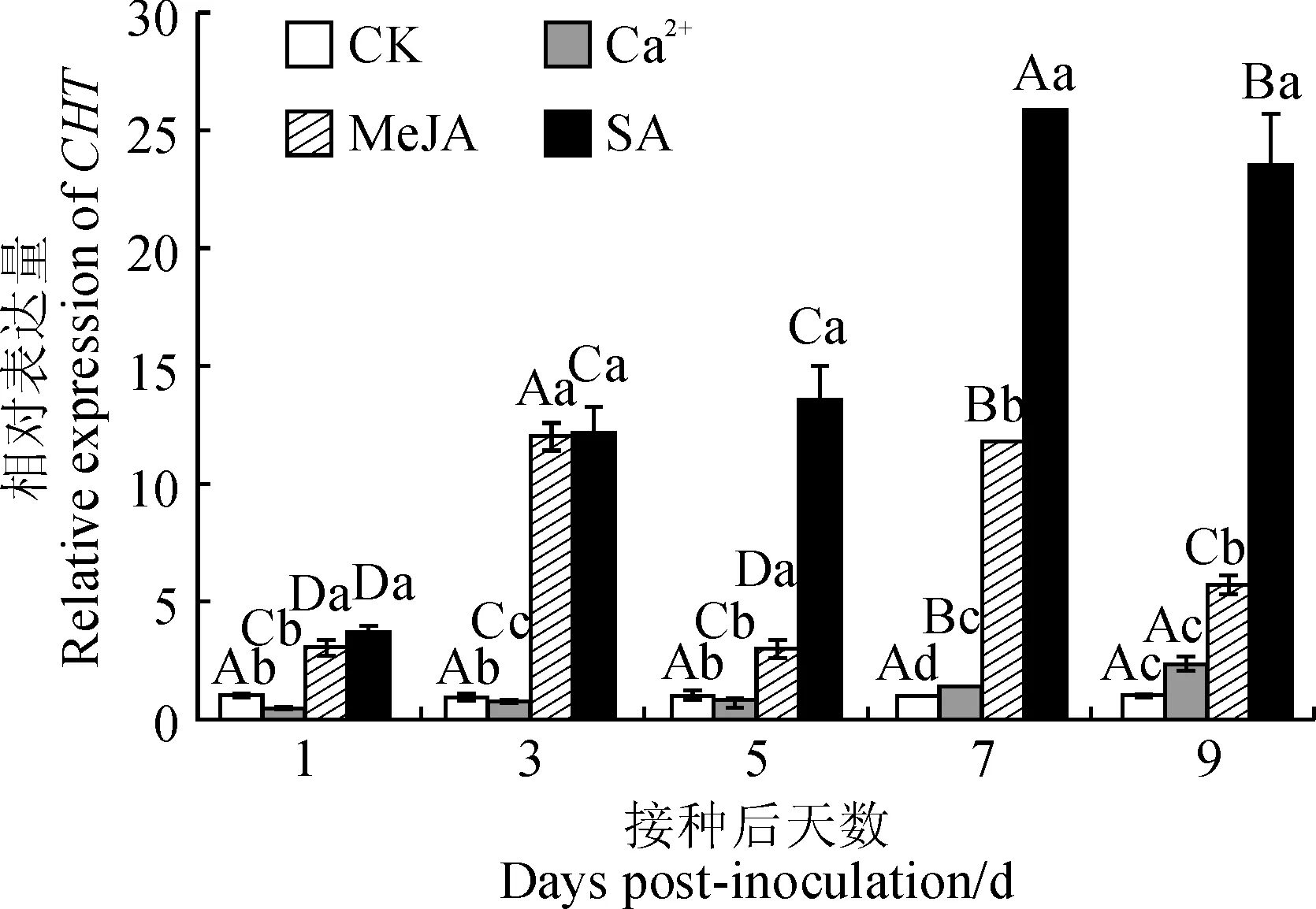
图5 不同诱导预处理对接种后甜瓜MR-1叶片中的CHT基因表达的影响Fig.5 Effect of different induced pretreatments on the expression of CHT gene in Muskmelon MR-1 leaves post inoculation

图6 不同诱导预处理对接种后甜瓜M1-15叶片=中的CHT基因表达的影响Fig.6 Effect of different induced pretreatments on the expression of CHT gene in Muskmelon M1-15 leaves post inoculation
结果显示:SA、MeJA可诱导甜瓜抗病品种MR-1和感病品种M1-15叶片中的CHT基因上调表达,而Ca2+对CHT基因上调表达无显著作用。
2.5 外源预处理后接种的甜瓜抗病性与基因表达的相关分析
如表3所示:抗病甜瓜MR-1的病情指数与Fom-2和CHT表达均呈极显著性负相关关系,相关系数分别为-0.926和-0.552;感病甜瓜M1-15的病情指数与Fom-2和CHT表达均呈极显著负相关关系,相关系数分别为-0.739和-0.734;表明Fom-2和CHT基因表达均与甜瓜的抗病性极显著相关,因此通过外源诱导提高甜瓜的Fom-2和CHT表达量能够提高甜瓜的抗病性。
3 讨 论
甜瓜枯萎病是甜瓜主要病害之一,严重制约着甜瓜产业的发展,目前甜瓜枯萎病的研究主要集中在抗性基因上,利用分子选择育种技术发现与甜瓜抗枯萎病相关的基因有Fom-2、CHT、cab-1和Prv2等,通过相关抗病基因的研究,揭示了甜瓜抗病的内在调控机理,但目前通过施用外源物质提高调控基因表达量来提高甜瓜抗病性鲜有研究。本实验结果
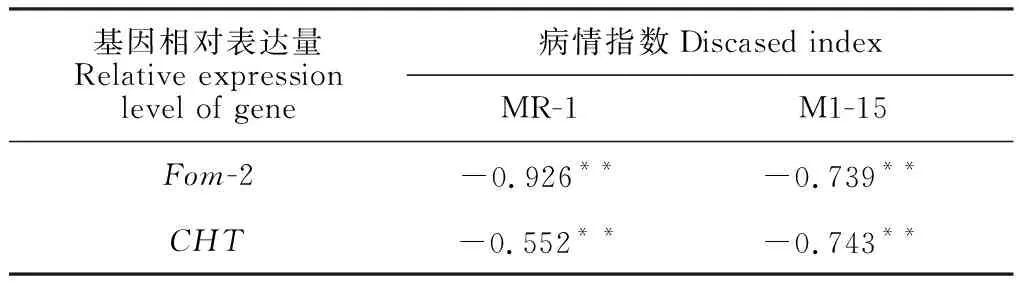
表3 抗病甜瓜(MR-1)和感病甜瓜(M1-15)病情指数与基因表达的相关性分析Table 3 Correlation analysis of disease index and gene expression in disease-resistant muskmelon (MR-1) and susceptible melon (M1-15)
表明:接种甜瓜枯萎病菌后,抗病甜瓜和感病甜瓜的抗病基因Fom-2、CHT的表达均与甜瓜的病情指数呈极显著负相关关系,提高Fom-2、CHT的表达能够有效提高甜瓜的抗枯萎病能力。
前人研究表明,SA诱导过程中为过氧化氢酶提供一个电子,使其进行过氧化反应,自身被转变为处于氧化态的自由基,由SA自由基细胞脂质进行攻击,诱导脂质过氧化物启动各种抗病反应[26-27]。也有研究认为,SA通过在调控基因水平转录,完成诱导植物对生物胁迫产生抗性过程[28],本实验研发现,经SA预处理诱导后接种的抗、感病甜瓜品种均在实验期抗间枯萎病基因Fom-2、CHT的表达量整体高于对照,且病情指数显著低于对照组,说明施用外源诱导剂SA能够有效提高甜瓜抗病能力,结果与任春林等[29]对白桦树的研究结果一致。
前人研究表明,MeJA一方面促进植物叶片中纤维素及木质素等物质的合成,使细胞壁结构稳定,阻碍病原菌的侵入;另一方面,诱导一些低分子量酚类前体的合成,在多聚作用时产生游离基,以钝化病菌毒害作用[30-31]。另外,MeJA活化基因表达,产生抗病蛋白来抵抗病原菌,是启动细胞保卫系统的信号分子之一[32]。本实验研究发现,经MeJA诱导预处理后接种,抗感病甜瓜在实验期间抗枯萎病基因Fom-2、CHT表达量有所变化,但总体上显著高于对照,且病情指数显著低于对照组。说明施用外源诱导剂MeJA能够有效提高甜瓜抗枯萎病病能力。结果与Benedetti 等对拟南芥的研究结果一致[33]
综上所述:外源MeJA和SA预处理具有能够提高甜瓜抗枯萎病基因Fom-2、CHT的表达量,进而提高甜瓜的抗枯萎病能力的功效;而Ca2+没有提高抗病性的效果。这一结果丰富了甜瓜枯萎病的防治技术途径,为减少农药防治污染提供了新的思路。
参考文献:
[1] 许丽娟. 山西省水果农药残留现状及对品质影响研究[D]. 太原:山西大学, 2011.
[2] 赵惠新,李 冠,李金玉,等. 甜瓜抗病基因的研究进展及其应用前景[J]. 分子植物育种,2005,(2): 249-254.
ZHAO H X, LI G, LI J Y,etal. Development of research about resistance genes cloning in melon (CucumismeloL.) and the applications foreground[J].MolecularPlantBreeding, 2005,(2): 249-254.
[3] 陈爱葵,庄文宋,陈冬梅. 植物几丁质酶及其基因工程研究进展[J]. 广东教育学院学报,2010,30(3): 47-53.
CHEN A K, ZHUANG W S, CHEN D M. Development of Research about chitinase and its genetic engineering in plant[J].JournalofGuangdongEducationInstitute, 2010,30(3): 47-53.
[4] SCHLUMBAUM A, MAUCH F, VOGELI U,etal. Plant chitinas-es are potentinhibitors of fungal growth[J].Nature,1986,324(27): 365- 367.
[5] MARCHENT R, DAVERY MR,LUCAS JA,etal. Expression of achitinase transgene in rose (RosahybridaL.) reduces de-velopment of blackspot disease (Diplocarponrosaewolf)[J].MolecularBreeding,1998,4(3): 187- 194.
[6] TURNER J G, ELLIS C, DEVOTO A. The jasmonate signal pathway[J].PlantCell, 2002,14(Suppl): S153.
[7] RASKIN I. Role of salicylic acid in plants[J].Annu.Rev.PlantPhysiol.PlantMol.Biol., 2003,43: 439-463.
[8] LIECHTI R, FARMER E E. The jasmonate pathway[J].Science, 2002,296(5 573): 1 649.
[9] 石延霞, 于 洋, 傅俊范,等.病原菌诱导后黄瓜叶片中脂氧合酶活性与茉莉酸积累的关系[J]. 植物保护学报, 2008,35(6): 486-490.
SHI Y X, YU Y, FU J F,etal. Relationship between LOX activity and JA accumulations in cucumber leaves induced by pathogen[J].JournalofPlantProtection, 2008,35(6): 486-490.
[10] 冯远娇, 王建武, 苏贻娟,等. 茉莉酸在玉米地上部与地下部系统性诱导防御反应中的作用[J]. 中国农业科学, 2009,42(8): 2 726-2 735.
FENG Y J, WANG J W, SU Y J,etal. The role of jasmonic acid in the systemic induced defense response of aboveground and underground in corn (Zeamays) [J].ScientiaAgricultureSinica, 2009,42(8): 2 726-2 735.
[11] 吴国昭, 谢丽君, 宋圆圆,等. 外源信号物质诱导广东高州普通野生稻抗稻瘟病的生理生化机理[J]. 西北农业学报, 2009,18(3): 254-258.
WU G Z, XIE L J, SONG Y Y,etal. The physiological and biochemical mechanism of disease resistance ofOryzarufipogongriff in digenous to Gaozhou, Guangdong againstPyriculariagriseainduced by exogenousily applied plant signal compounds(in Chinese)[J].ActaAgriculturaeBoreali-occidentalisSinica, 2009,18(3): 254-258.
[12] 张建成, 范永山, 董金皋. 玉米大斑病菌毒素对玉米叶肉细胞脂氧合酶活性的影响[J]. 植物病理学报, 2003,33(5): 421-424.
ZHANG J C, FAN Y S, DONG J G,etal. Effects of HT-toxin produced byExserohilumturcicumon lip oxygenase activity in corn leaf cells[J].ActaPhytopathologicaSinica, 2003,33(5): 421-424.
[13] SCHAFFRATH U, SCHEINPFLUG H, REISENER H J. An elicitor fromPyriculariaoryzaeinduces resistance responses in rice: isolation, characterization and physiological properties[J].ActaPhytopathologicaSinica, 1995,46(4): 293-307.
[14] 陈利锋, 聂 理. 抗感赤霉病小麦品系超氧化物歧化酶和过氧化氢酶的活性比较[J]. 植物病理学报, 1997,27(3): 209-212.
CHEN L F, NIE L. Comparison of Scab Resistant and susceptible wheat varieties of superoxide dismutase and catalase activity[J].ActaPhytopathologicaSinica, 1997,27(3): 209-212.
[15] 张智慧, 聂燕芳, 何 磊,等. 外源茉莉酸甲酯诱导水稻抗瘟性相关防御酶和内源水杨酸的变化[J]. 植物病理学报, 2010,40(4): 395-403.
ZHANG Z H, NIE Y F, HE L,etal. Resisance -related defense enzymes and endogenous salicylic acid induced by exogenous methyl jasmonae in rice against blast disease[J].ActaPhytopathologicaSinica, 2010,40(4): 395-403.
[16] 宾金华,姜 胜,黄胜琴,等. 茉莉酸甲酯诱导烟草幼苗抗炭疽病与PAL活性及细胞壁物质的关系[J]. 植物生理学报, 2000,26(1): 2-7.
BIN J H, JIANG S, HUANG S Q,etal. Relationship between anthracnose resistance and PAL activity and cell wall substance in tobacco seedlings induced by methyl jasmonate [J].Physiological&MolecularPlantPathology, 2000,26(1): 2-7.
[17] 向妙莲,付永琦,何永明,等. 茉莉酸甲酯浸种对水稻幼苗白叶枯病抗性及抗氧化酶活性的影响[J]. 中国水稻科学, 2014,28(4): 419-426.
XIANG M L, FU Y Q, HE Y M,etal. Effects of seed soaking with MethylJasmonateon resistance to bacterial leaf blight and antioxidant enzyme activities of rice seedlings[J].ChineseJournalofRiceScience, 2014,28(4): 419-426.
[18] 范存斐, 毕 阳, 王云飞, 等. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J]. 中国农业科学, 2012,45(3): 584-589.
FAN C F,BI Y,WANG Y F,etal. Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid pathway in muskmelon fruits[J].ScientiaAgriculturaSinica, 2012,45(3): 584-589.
[19] 曾凯芳, 姜微波. 水杨酸处理对采后绿熟芒果炭疽病抗病性的诱导[J]. 中国农业大学学报, 2005,10(2): 36-40.
ZENG K F, JIANG W B. Induced resistance to anthracnose (Colletotichumgloeosporioides) in mango fruit by postharvest treatment with salicylic acid[J].JournalofChinaAgriculturalUniversity, 2005,10(2): 36-40.
[20] 徐丙寅.甜瓜抗枯萎病基因Fom-2的表达特性分析与功能验证[D]. 哈尔滨:东北农业大学,2013.
[21] 武兴丽. 瓜类枯萎病的发生与防治[J]. 北方园艺, 2003, (5): 51.
WU X L. Occurrence and control of cucurbit wilt disease[J].NorthernHorticulture. 2003, (5): 51.
[22] 包海清,许 勇,杜永臣,等.海南三亚地区地区葫芦科作物白粉病菌生理小种分化的鉴定[J].长江蔬菜,2008 , (1): 49-51.
BAO H Q, XU Y, DU Y C,etal. Identification of physiological races of powdery mildew on cucurbits in Sanya, Hainan[J].JournalofChangjiangVegetables, 2008, (1): 49-51.
[23] 刘 璐, 孙 蕾, 张志鹏, 等. 外源物质诱导对甜瓜枯萎病抗性和防御酶活性的影响[J]. 北方园艺, 2016, (14): 122-126.
LIU L, SUN L, ZHANG Z P,etal. Effects of exogenous substance induction onFusariumwilt resistance and defense enzyme activity in melon[J].NorthernHorticulture, 2016, (14): 122-126.
[24] 王舒藜,吴沙沙,吕英民. 改良Trizol法快速高效提取香石竹总RNA [J]. 分子植物育种,2010,8(5): 987-990.
WANG S L, WU S S, LÜ Y M. Quick and high efficient extraction of total RNA from carnation with improved Trizol method[J].MolecularPlantBreeding, 2010,8(5): 987-990.
[25] LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25: 402-408.
[26] YU D Q,CEN C, YANG M L,etal. Studies on the salicylic acid inducted lipid peroxidation and defense gene expression in tobacco cell culture[J].ActaBotanicaSinica, 1999,41(9): 977-983.
[27] LEON J, ROJO E, SANCHEZ-SERRANO JJ. Wound signaling in plants[J].Exp.Bot., 2001,52: 1-9.
[28] 王慧敏. 紫花苜蓿MsRBP基因的克隆及其功能鉴定[D]. 南京:南京农业大学, 2012.
[29] 任春林. 诱导子组合对白桦三萜合成调控及MeJA抑制性消减文库分析[D].哈尔滨:东北林业大学,2012.
[30] 刘春燕.小麦抗叶锈病近等基因系TcLr45分子标记开发与凝集素类受体蛋白激酶基因的克隆[D]. 河北保定:河北农业大学,2011.
[31] 蔡新忠,郑 重. 水杨酸对水稻幼苗抗瘟性的诱导作用[J]. 植物病理学报,1996,26(1): 7-12.
CAI X Z, ZHENG Z, Inducing effect of salicylic acid on blast resistance of rice seedlings[J].ActaPhytopathologicaSinica, 1996,26(1): 7-12.
[32] 张 莉, 冯晓元, 丁立孝, 等. 黄柏提取物对采后梨果实PAL、CHT及GLU的诱导[J]. 食品研究与开发, 2007,28(2): 28-31.
ZHANG L, FENG X Y, DING L X,etal. Ex-phellodendri extracts of pear fruit after dishPAL,CHTandGLUinduced[J].FoodResearchandDevelopment, 2007,28(2): 28-31.
[33] BENEDETTI CE,COSTACL,TURCINELLI S R,etal. Differenctial expression of a novel gene in response to coronatine,methyl jasmonate and wounding in the Coi1 mutant of Arabidopsis[J].PlantPhysiol., 1998,116: 1 037-1 042.

