干旱对紫色小白菜光合特性及营养品质的影响
杨碧云,钟凤林,林义章
(福建农林大学 园艺学院,福州 350002)
干旱是影响植物正常生长发育的一个重要逆境因子,有关干旱胁迫对蔬菜及农作物生长发育和生理过程的影响研究也一直是逆境研究的热点之一。研究表明,干旱对番茄[1]、黑米[2]、玉米[3]、紫叶矮樱[4]、沙枣幼苗[5]等植物的光合作用及很多生理过程造成破坏,而其中的气孔传导度关系到光合和呼吸中CO2的传导和水分的蒸腾,叶绿素和类胡萝卜素则是光合作用中光能的受体或保护色素[6-7],从而引起植物一系列生理生化的变化[8]。
紫色小白菜(Brassicacampestrisssp.chinensisvar.communisTsen et Lee)是小白菜的变种,其叶片正面呈紫色,富含花青苷,可作为蔬菜色拉直接食用,深受消费者的青睐。目前对紫色小白菜的研究主要集中在栽培技术[9-10]以及花青苷提取[11-12]和相关基因分析[12-13]等方面。其中,沈露露[14]以‘紫冠 1 号’紫色不结球白菜为材料,利用聚乙二醇(PEG 6000) 溶液进行模拟干旱胁迫处理,表明短期的干旱胁迫处理有利于紫色不结球白菜花色苷的积累,且发现了 2 个在干旱胁迫下对诱导花色苷基因表达有重要作用的基因。目前,关于紫色小白菜在干旱胁迫下响应机理方面的研究尚处于起步阶段,但有研究表明,适度的干旱处理会提高紫色小白菜[14]、黑米[2]、紫叶矮樱[4]中花青苷含量,而紫色小白菜作为一种富含花青苷的彩色蔬菜,不同程度干旱胁迫对其花青苷等品质指标和光合作用的影响效应尚不明了。因此,本试验采用盆栽控水方法,对紫色小白菜进行不同程度干旱处理,测定其花青苷等品质指标含量的变化,及其光合参数和叶绿素荧光参数的响应特征,以期通过控制水分供应来生产出优质紫色小白菜,为紫色小白菜的高产栽培以及干旱胁迫逆境下的生理生化特征研究奠定实践理论基础,为后人研究提供一定的理论依据。
1 材料和方法
1.1 试验材料
供试材料为不结球紫色小白菜品种‘紫薇’,种子购自北京京域威尔农业科技有限公司。
1.2 试验设计
试验于 2013 年10~12月在福建农林大学园艺学院蔬菜研究所实验室通过盆栽方法进行。试验设置4个处理水平(正常水分供应至轻度亏缺),具体为正常水分供应(对照,CK)处理、轻度干旱(T1)处理、中度干旱(T2)处理和重度干旱(T3)处理。试验土壤含水量控制操作参考李云飞[4]方法,稍有改动:采用称重量法及插孔补水法的方法控制盆土实际含水量分别维持在(16.675±0.575)%、(13.225± 0.575)%、(9.775±0.575)%和(6.325±0.575)%。将用温水消毒后的种子置于54 cm×28 cm的穴盘中,待幼苗长至两叶一心时,移苗至同一规格的塑料盆中(直径30 cm,高28 cm),盆中分别装有基质7.5 kg(园土、草炭土、珍珠岩按照体积比5∶7∶3混匀,有机质含量20%),营养液采用华南农业大学的叶菜B营养液配方[15],每5 d浇1次营养液,其他同常规管理。待幼苗长到四叶一心期时,选择长势一致的新苗,采取自然干旱的办法控水,每日18:00用感量0.5 g的电子称称重,并均匀补充当天失去的水分,控制土壤含水率在设定范围,并记录耗水量,采用土壤水分速测仪(MP-406型,海安县新晨机电厂制造)测定含水量。每个处理重复30盆,每盆种植1株,常规管理,随机区组排列。干旱处理15 d后,取紫色小白菜新鲜叶片,一部分立即进行相关生理指标离体测定,一部分置于冻干机中冻干,并备份样品于-80 ℃冰箱中。
1.3 测定项目与方法
1.3.1叶绿素荧光参数在晴天上午9:30~11:30,将CO2浓度设定为环境浓度,光强度为903~1 003 μmol·m-2·s-1,测定时的叶面温度为(25±0.5) ℃,相对湿度为(56.1±0.6)%。分别选取每处理植株顶端下生长良好的完全展开叶片,采用CI-340 便携式光合作用仪测定其净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr) 和胞间CO2浓度(Ci)等光合生理指标,重复测定3次,并计算瞬时水分利用效率(WUE=Pn/Tr)。在暗适应20 min后,利用Handy PEA 便携式植物效率分析仪(Hansatech Instruments Limited, Norfolk, UK)分别测定各处理植株顶端下生长良好的完全展开叶片叶绿素荧光参数,叶绿素荧光是由3个发光二极管提供的3 400 μmol·m-2·s-1左右的红光(峰值650 nm)均匀地照射在直径4 mm的叶片上诱导的,从照光开始后的前300 μs,每10 μs读取数据1次,随着荧光动力学信号变慢,数据读取的时间间隔变长,所有测定均在室温下进行,重复测定3次。测定的叶绿素荧光参数指标详见表1。
1.3.2品质指标花青苷采用杨碧云等[11]方法提取,pH示差法[16]测定含量。类黄酮含量的测定用超声波辅助萃取的方法,参考王英豪等[17]提取马齿苋总黄酮的方法,并进行了改良:乙醇浓度60%、料液比1∶25、超声时间30 min、超声温度35 ℃、超声功率70 W,采用亚硝酸钠-硝酸铝-氢氧化钠法[18]测定含量;可溶性蛋白质含量采用Folin-酚试剂法[18]测定;可溶性糖含量采用硫酸蒽酮比色法[18]测定;维生素C含量采用2,6-二氯酚靛酚比色法[18]测定;叶绿素、类胡萝卜素含量测定采用丙酮提取法,比色法测定[18]。所有指标均重复测定3次。

表1 测定的叶绿素荧光参数及其计算公式Table 1 The design formulas of chlorophyll fluorescence parameters
1.4 数据处理
采用Excel 2003和Origin 9.0软件进行数据分析及作图,并用DPS(V3.01)进行单因素方差分析、LSD检验法进行多重比较,差异显著水平取a=0.05。
2 结果与分析
2.1 干旱处理对紫色小白菜品质指标的影响
由图1可知,紫色小白菜花青苷的含量变化表现为随干旱胁迫程度的加重先升高后下降,且处理间均存在显著差异(P<0.05)。其中,T1和T2处理分别比CK处理显著增加38.22%和13.84%,而T3处理比CK处理显著降低18.34%。说明适当的干旱胁迫处理能够显著增加紫色小白菜叶片中花青苷的含量。
同时,紫色小白菜叶片可溶性蛋白、可溶性糖、类黄酮和维生素C等其他品质指标也随干旱胁迫程度的加重而呈先升高后降低的变化趋势,并均在T1处理下达到最大值且显著高于CK,在T2和T3处理下显著低于CK,各处理间均存在显著差异(图2)。其中,与对照相比,紫色小白菜叶片可溶性蛋白、可溶性糖、类黄酮和维生素C含量在T1处理下分别显著增加8.96%、8.74%、15.52%和8.69%,而在T3处理下分别显著减少了22.06%、36.12%、26.96%和33.29%。说明适度的干旱胁迫能够显著促进紫色小白菜叶片中营养物质的积累,同时可以帮助其在逆境中生长,过度干旱胁迫则产生相反作用。
2.2 干旱处理对紫色小白菜光合色素含量及比值的影响
由图3可知,紫色小白菜叶绿素a、叶绿素b、叶绿素(a+b)和类胡萝卜素含量均随干旱处理程度的加重而呈现先上升后下降的变化规律,并均在T1处理下达到最大值且显著高于相应对照,而T2和T3处理均显著低于对照;与CK处理相比,T1处理叶绿素a、叶绿素b、叶绿素(a+b)和类胡萝卜素含量分别显著增加了8.87%、11.96%、9.66%和5.59%,而T3处理则分别显著下降了43.31%、53.58%、45.93%和29.46%。同时,由于叶绿素b的增加和降低幅度都高于相应叶绿素a,导致了叶绿素a/b值呈现了先下降后上升的变化趋势。可见,适度干旱胁迫能显著促进紫色小白菜叶片光合色素含量增加,且叶绿素b对干旱处理的反应较叶绿素a敏感。
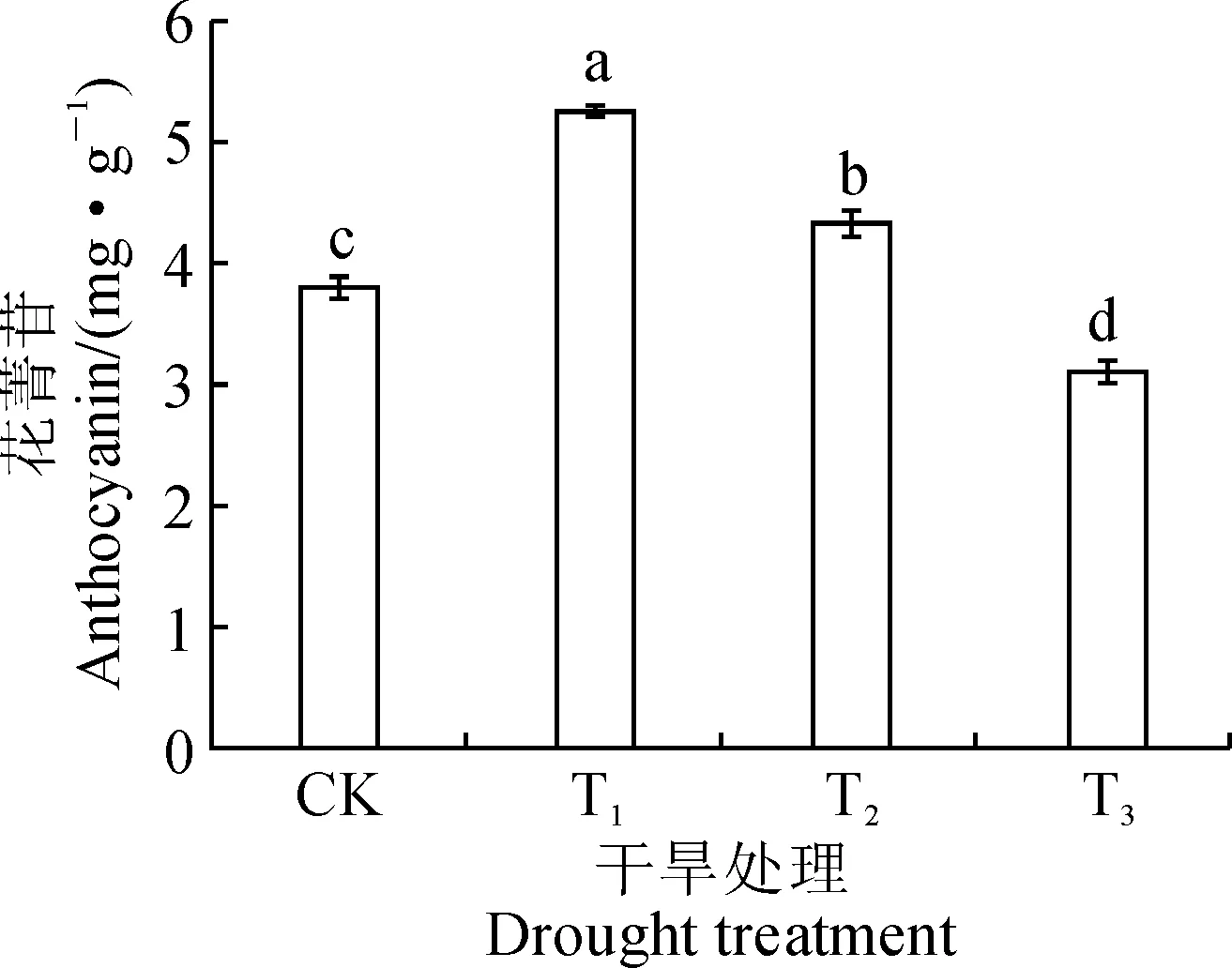
CK、T1、T2、T3分别为正常供水(16.675%)、轻度干旱(13.225%)、中度干旱(9.775 %)和重度干旱(6.325%)处理;图中不同字母表示处理间在0.05水平存在显著性差异 (P<0.05);下同CK, T1, T2, T3 stand for normal irrigation(16.675%), light drought (13.225%), moderate drought (9.775 %) and severe drought (6.325%) treatments, respectively; Different letters in the figure indicate significant difference among treatments at 0.05 level. The same as below
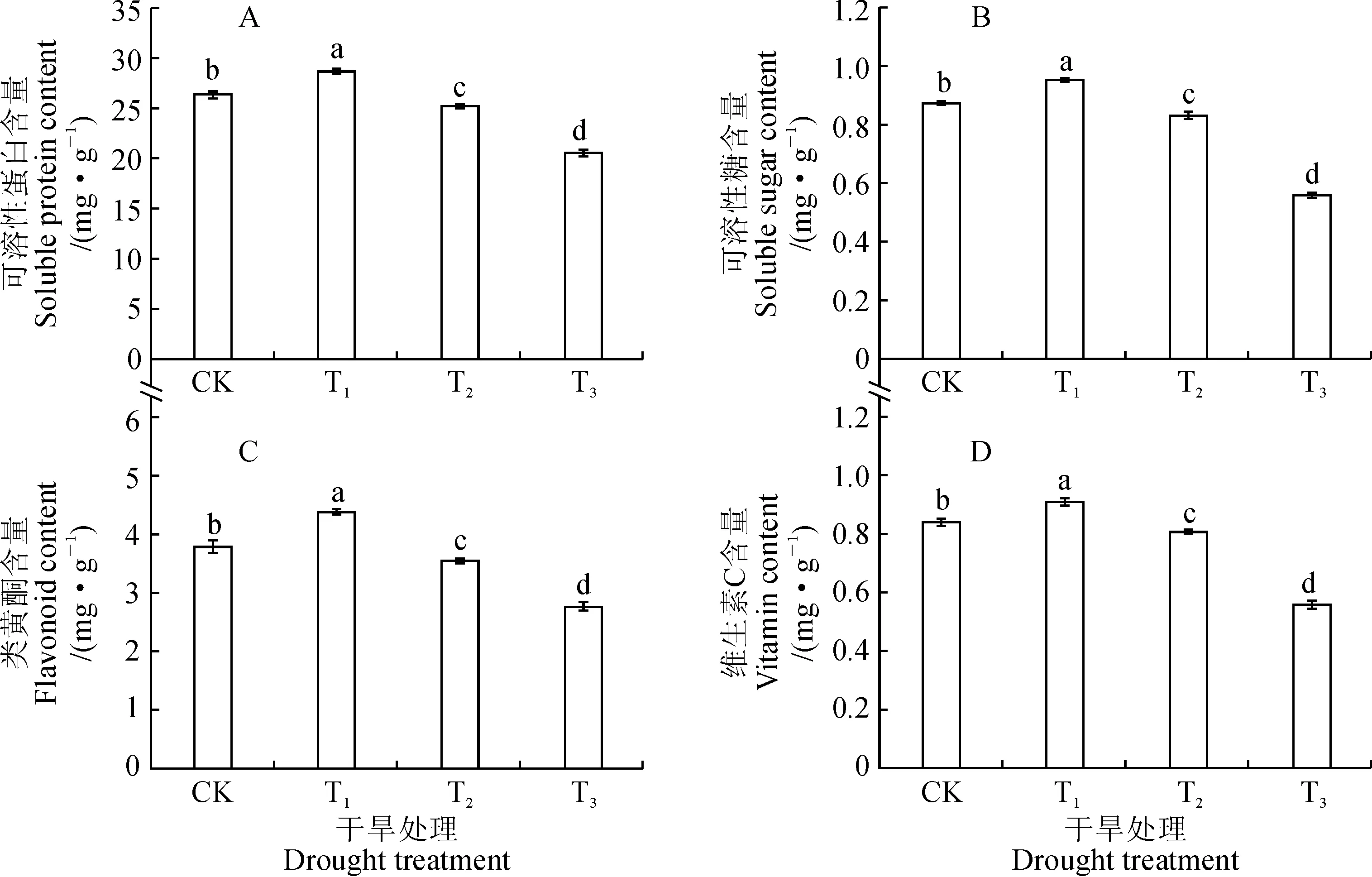
图2 干旱处理下紫色小白菜叶片品质指标的变化Fig.2 The photosynthetic quality indexes in leaves of purple cabbage under drought treatments
2.3 干旱处理对紫色小白菜光合气体交换参数的影响
图4显示,随着干旱处理程度的加重,紫色小白菜叶片Pn、Tr和Gs均呈现出逐渐下降的趋势,且它们在T1处理下与CK处理相比下降不显著,幅度仅1.93%左右,而在T2和T3处理后均大幅度显著下降,T3处理相对于CK处理分别显著下降了73.62%、75.44%和84.03%;同时,紫色小白菜叶片Ci则随着干旱处理程度呈现出逐渐显著上升趋势,T1、T2和T3处理分别比对照处理显著增加了7.48%、42.13%和145.19%(图4,A-D)。另外, WUE用来衡量水分消耗与CO2固定能力的关系。由图4。E可知,紫色小白菜叶片WUE随着干旱胁迫强度增加表现出先升后降的趋势,并在 T2处理时最大值,此时WUE相对于CK处理显著提高了72.90%,而T3处理比CK仅增加了7.52%。以上结果说明紫色小白菜的光合效率在轻度干旱胁迫不会受到显著影响,其水分利用效率在适度干旱处理下显著提高,但其光合器官结构和功能在重度干旱下受到一定程度上破坏。

图4 干旱处理下紫色小白菜光合气体交换参数的变化Fig.4 The photosynthetic parameters in leaves of purple cabbage under drought treatments
2.4 干旱处理对紫色小白菜叶绿素荧光参数的影响
2.4.1光合性能指数PIABS图5显示,紫色小白菜叶片PIABS随着干旱胁迫程度的加重而逐渐降低,与CK处理对比,轻度(T1)、中度(T2)和重度(T3)干旱胁迫处理分别显著下降了6.92%、33.38%和57.30%。
2.4.2单位反应中心(RC)能量流由图6可得,以有活性的反应中心(RC)为基础的叶绿素荧光参数表明,紫色小白菜叶片ABS/RC、TRO/RC、ETO/RC、DIO/RC则均随着干旱胁迫程度的加重而呈现逐渐上升的趋势,但它们在轻度干旱胁迫(T1)下升高并不显著,而在中度干旱处理(T2)下分别比CK处理显著提高23.12%、18.82%、18.29%和41.05%,而在重度干旱胁迫(T3)下分别显著提高65.59%、47.89%、52.63%和140.00%。
2.4.3单位面积(CS)能量流图7表明,以单位受光面积(CS)为基础的叶绿素荧光参数表明,紫色小白菜叶片单位面积捕获的光能(TRO/CS)、单位面积的热耗散(DIO/CS)均随干旱处理的加重而呈现逐渐上升的趋势,两者在T3处理下分别比CK处理显著高出51.93%和41.53%;而同期叶片单位面积电子传递的量子产额(ETO/CS)和叶片单位面积上有活性的反应中心数量(RC/CSO)则都呈现出逐渐降低的变化规律,T1、T2、T3处理的ETO/CS分别比CK处理显著降低了7.37%、18.55%、29.73%,它们的RC/CSO则分别比CK处理显著降低了6.97%、11.52%和24.26%。
2.4.4量子产率参数不同程度干旱胁迫致使紫色小白菜叶片各荧光参数表现出不同的变化趋势(图8)。其中,紫色小白菜叶片ψPO、ΨO、ψEO值在T1处理下变化均不明显,分别仅比CK处理下降了1.87%、1.44%和2.24%,而在T2处理下则分别显著下降了8.01%、10.58%和14.95%,在T3处理后分别显著下降了23.39%、24.68%和26.04%。同时,在干旱胁迫程度不断加重条件下, T1、T2、T3处理叶片供体侧性能参数WK分别比CK处理增加了1.50%、15.66%和26.85%,它们受体侧性能参数VJ分别增加了3.33%、25.05%和39.73%。 另外,紫色小白菜叶片MO也随干旱处理程度增加呈现出上升的趋势,其在T3处理下比CK处理提高了32.33%。可见,在干旱胁迫条件下,紫色小白菜叶片VJ增幅比WK大, PSⅡ受体侧受到的胁迫伤害大于供体侧;同时,MO值的上升又说明QA逐渐被还原,QA-向下传递电子的能力受到抑制。
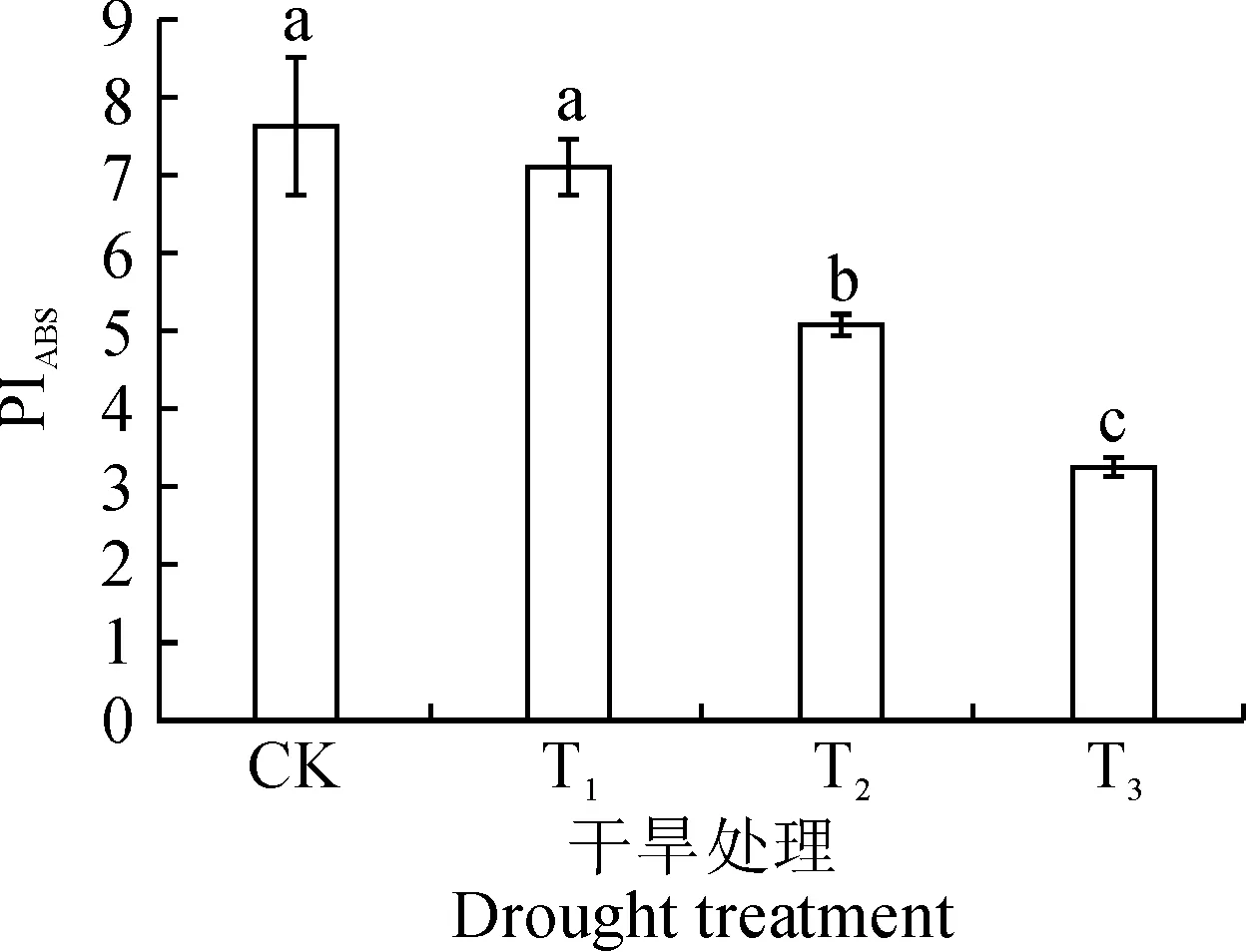
图5 干旱处理下紫色小白菜光合性能指数(PIABS)的变化Fig.5 The photosynthetic performance index (PIABS) of purple cabbage under drought treatments

图6 干旱处理下紫色小白菜单位反应中心(RC)能量流的变化Fig.6 The specific energy fluxes per RC of purple cabbage under drought treatments

图7 干旱处理下紫色小白菜荧光参数单位面积(CS)能量流的变化Fig.7 The phenomenological fluxes per CS in leaves of purple cabbage under drought treatments

图8 干旱处理下紫色小白菜量子产率参数的变化Fig.8 The quantum yield parameters in leaves of purple cabbage under drought treatments
3 讨 论
3.1 紫色小白菜品质性状对干旱胁迫的响应
色素是彩叶蔬菜叶片呈色的物质基础,干旱胁迫对植物色素含量会产生明显影响。本研究结果表明,随着干旱胁迫程度的加重,紫色小白菜叶片花青苷含量呈先增加后降低的趋势,这说明适当的干旱胁迫可使紫色小白菜花青苷含量增加,但当干旱程度超过一定限度时花青苷含量便开始下降,这与黑米[2]、紫叶矮樱[4]对干旱胁迫响应的研究结果一致,这也验证了适度的干旱可以增加花青苷的含量这一结论[4,19]。花青苷属于生物类黄酮物质,本研究中随着干旱处理程度的加重紫色小白菜类黄酮含量变化趋势与花青苷相似,呈先增加后降低的规律,说明适度的干旱也有利于紫色小白菜类黄酮物质的积累,这与酸枣[20]、紫叶矮樱[4]的相关研究结果基本一致。在适度的干旱条件下,大量的光合产物积累在体内,植物可能利用这些“过剩”的光合产物合成含碳的次生代谢产物,基于这一原因类黄酮物质的含量有所增加。而重度干旱处理后紫色小白菜叶片中类黄酮物质含量显著减少,可能是因为重度干旱胁迫处理致使类黄酮物质发生了降解,或者是重度干旱处理导致光合作用受限,使植物含碳次生代谢物质的合成受到减少,次而表现为类黄酮物质含量的减少[20]。此外,本试验结果表明, T1处理紫色小白菜叶片可溶性糖、可溶性蛋白、维生素C含量均高于对照处理,但其又随着胁迫程度不断加重而迅速下降,这与干旱胁迫下花生幼苗可溶性蛋白含量[21]、苜蓿叶片中可溶性蛋白含量[22]、白桦叶片可溶性蛋白和可溶性糖含量[23]以及桔梗幼苗中维生素C[24]的表现一致,说明轻度干旱胁迫处理可增加紫色小白菜可溶性糖、可溶性蛋白和维生素C含量,在一定程度上利于其品质的改善。此外,可溶性糖和可溶性蛋白的积累也被认为是植物适应干旱胁迫的一种适应和自我保护的反应[25-26],维持了植物体生长发育的水分需求,使植物具有较强的抗逆性能力。但有研究[27-30]表明,干旱处理会造成植株生长减缓,叶片数量减少,生物量降低,产量下降等,影响植株相关酶的种类及活性表达。因此,后续研究将进一步依据紫色小白菜生物量在不同干旱逆境下的变化,深入探讨相关酶活性及相关基因表达水平的响应特征,以探明紫色小白菜对干旱处理的分子响应机制。
3.2 紫色小白菜光合特性对干旱胁迫的响应
光合色素是植物光合作用的载体,其含量的变化在一定程度上反映出植物的光合特性。本研究表明,随着干旱胁迫的加重,紫色小白菜叶绿素a含量、叶绿素b、叶绿素(a+b)、类胡萝卜素含量均呈现先上升后下降的变化规律,且叶绿素a/b值变化趋势与其相反,这与李云飞对紫叶矮樱[4]、孙景宽[5]对沙枣幼苗、吴婧舒[31]对平榛所做的试验结果一致。轻度干旱胁迫下紫色小白菜光合色素含量的增加可能与胁迫条件下叶片含水量减少有关。但随着干旱胁迫加重,光合色素含量急剧下降可能是由于干旱胁迫使紫色小白菜叶片中的色素合成过程减弱,抑制了光合作用中光能的吸收与转化,从而表现出叶绿素含量下降[32]。同时也可能是因为干旱胁迫加重导致类胡萝卜素含量的降低,从而减少了其对活性氧的淬灭能力,加快了叶绿素的分解速度,使得叶片中叶绿素含量急剧下降。
光合作用作为植物最基本的生命活动对干旱胁迫反应非常敏感,植物受到干旱胁迫后光合速率会出现不同程度下降的现象[33]。干旱处理下引起植物叶片光合效率降低的植物自身因素主要有气孔部分关闭导致的气孔限制和叶肉细胞光合活性下降导致的非气孔限制两类[34]。本试验结果表明,不同程度的干旱胁迫处理下,紫色小白菜叶片Pn、Gs均呈现下降趋势,但Ci呈现出升高趋势,表明叶片Pn的下降并非气孔关闭所导致,而是由于叶肉细胞光合能力降低的原因,这可能是因为胁迫程度过重导致植物中一些代谢途径受到抑制,从而成为限制其光合作用的主要原因。植物生物量积累过程中耗水量的多少决定了水分利用效率的高低,一般在给定耗水量的条件下,水分利用效率会随着生物量积累增加而上升,本试验结果还发现,紫色小白菜叶片 WUE随干旱胁迫处理程度加重而呈先上升后下降的趋势,这与紫叶矮樱叶片[4]对干旱响应的结果一致。
叶绿素荧光动力学参数是检验植物胁迫伤害程度的指标[10,35]。由于干旱胁迫导致PSⅡ结构的破坏,紫色小白菜叶片电子传递和能量转化均受到了较大影响。PIABS随着干旱处理程度的加重而降低,可能是光合结构的功能受到干旱处理的伤害,降低了叶片光能转化效率,从而限制了紫色小白菜叶片光合作用的正常进行,这与周帅[36]、王振兴[37]所做的干旱处理研究结果一致。由于单位面积有活性的反应中心数目RC/CSO减少的原因,ABS/RC、TRO/RC、ETO/RC、DIO/RC随着干旱处理的加重而上升,在此过程中,紫色小白菜叶片叶绿体吸收和捕获的光能急剧增加了DIO/RC和DIO/CS,并没有增加单位面积用于电子传递的能量ETO/CS,说明紫色小白菜叶片里反应中心吸收和捕获的光能大部分都以热量的形式耗散,这可能是紫色小白菜叶片在干旱条件下的一种自我保护机制,能量的传递失衡进而影响了电子的传递。本试验研究结果表明,随着干旱处理程度的加重,QA-大量积累,MO呈现出显著升高的趋势,从而进一步阻碍电子向下传递的能力,出现ΨO、ψEO下降的趋势,ΨO、ψEO下调的目的是为了减少光合电子传递到氧的几率,从而使活性氧的产生达到最少量,减轻胁迫对植物造成的伤害[38]。MO、ΨO、ψEO、VJ主要反映PSⅡ受体侧的变化,而WK主要反映PSⅡ供体侧的变化,从本研究结果可知PSⅡ受体侧的荧光参数变化幅度大于供体侧的变化量,由此可以推测紫色小白菜叶片PSⅡ受体侧受到的伤害比供体侧大,这与张兴华[39]对玉米所做的研究结果一致。可见,随着干旱处理程度的加重,紫色小白菜叶片的光合色素含量、Pn呈现出显著下降的趋势,PSⅡ反应中心出现部分失活现象,反应中心电子供体侧和受体侧电子均受到损伤,这是紫色小白菜叶片光合能力随着干旱胁迫程度的加重而呈现下降趋势的原因之一[8]。
综上,水分是植物生长发育的重要环境因子之一,影响着植物体内碳水化合物的合成、色素合成相关酶的活性等,使植物光合作用受到抑制,进而影响植物的正常生长和叶色表现[4, 6]。综合上述分析,轻度干旱处理能增加紫色小白菜花青苷及其光合色素的含量,并提高了光合速率,进而改善了植株营养品质。在生产实践上,可以利用控制水分供给来调节蔬菜次生代谢物的合成与代谢,将对蔬菜品质的提升有着积极的作用。然而植物的正常生长不仅受到水分的影响,还受限于其他外界环境因子,且重度的干旱胁迫将对蔬菜造成巨大的损害,因而在实践生产中,还应结合实际的栽培条件进一步深入探讨相关措施。
参考文献:
[1] 程智慧,孟焕文,Stephen A. Rolfe,等. 水分胁迫对番茄叶片气孔传导及光合色素的影响[J]. 西北农林科技大学学报(自然科学版), 2002,(6): 93-96.
CHENG Z H, MENG H W, STEPHEN A R,etal. Impact of water stress on stomata conductance and photosynthetic pigment content in tomato plant[J].Jour.ofNorthwestSci-TechUniv.ofAgri.andFor. (Nat. Sci. Ed.). 2002,(6): 93-96.
[2] 陈应鹏,刘广娜,闫月新,等. 干旱胁迫对黑米花青素含量和PAL活性的影响[J]. 吉林农业科技学院学报. 2012,(1): 8-10.
CHEN Y P, LIU G N, YAN Y X,etal. Effect of drought stress on anthocyanidin content and PAL activity in semen trigone[J].JournalofJilinAgriculturalScienceandTechnologyUniversity, 2012,(1): 8-10.
[3] 张仁和,郑友军,马国胜,等. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报, 2011,(5): 1 303-1 311.
ZHANG R H,ZHENG Y J,MA G S,etal. Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding[J].ActaEcologicaSinica, 2011,(5): 1 303-1 311.
[4] 李云飞,李彦慧,王中华,等. 土壤干旱胁迫对紫叶矮樱叶片呈色的影响[J]. 生态学报, 2009,29(7): 3 678-3 684.
LI Y F, LI Y H, WANG Z H,etal. Effect of soil drought stress on leaf coloration-emerging ofPrunuscistenenacv.pissardii[J].ActaEcologicaSinica, 2009,29(7): 3 678-3 684.
[5] 孙景宽,李 田,夏江宝,等. 干旱胁迫对沙枣幼苗根茎叶生长及光合色素的影响[J]. 水土保持通报, 2011,(1): 68-71.
SUN J K, LI T, XIA J B,etal. Effects of drought stress on photosynthetic pigment and on root, stem and leaf growth characteristics ofElaeagnusangustifoliaseedlings[J].BulletinofSoilandWaterConservation, 2011,(1): 68-71.
[6] RAJASEKAR M, RABERT G A, MANIVANNAN P. The effect of triazole induced photosynthetic pigments and biochemical constituents ofZeamaysL. (maize) under drought stress[J].AppliedNanoscience, 2016,6(5): 727-735.
[7] HOSSEINZADEH S R, AMIRI H, ISMAILI A. Effect of vermicompost fertilizer on photosynthetic characteristics of chickpea (CicerarietinumL.) under drought stress[J]. Photosynthetica, 2016,54(1): 87-92.
[8] HARN J S, KIL K C, CHOI C. Physiological responses to drought stress of transgenic Chinese cabbage expressingArabidopsisH+-pyrophosphatase[J].JournalofPlantBiotechnology, 2013,40(3): 156-162.
[9] 李正德,辛学锐,丛培军,等. 紫色小白菜——好地紫罗兰[J]. 中国蔬菜,2011,(11): 35.
LI Z D, XIN X R, CONG P J,etal. Purple cabbage - Pak Choy, Horti- Violet[J].ChinaVegetables, 2011,(11): 35.
[10] YANG B Y, ZHOU X Z, XU R,etal. Comprehensive analysis of photosynthetic characteristics and quality improvement of purple cabbage under different combinations of monochromatic light[J].FrontiersinPlantScinence, 2016,7: 1 788.
[11] 杨碧云,叶丽萍,林琳琳,等. 响应面法优化超声辅助提取紫色小白菜花青苷的工艺研究[J]. 热带亚热带植物学报,2014,(4): 373-382.
YANG B Y, YE L P, LIN L L,etal. Ultrasonic condition optimization for anthocyanin extraction from purple cabbage by using response surface methodology (RSM)[J].JournalofTropicalandSubtropicalBotany, 2014,(4): 373-382.
[12] HE Q, ZHANG Z, ZHANG L. Anthocyanin accumulation, antioxidant ability and stability, and a transcriptional analysis of anthocyanin biosynthesis in purple heading Chinese cabbage (BrassicarapaL. ssp.pekinensis)[J].JAgricFoodChem, 2016,64(1): 132-145.
[13] 刘 瑾,汪维红,张德双,等. 控制白菜叶片紫色的pur基因初步定位[J]. 华北农学报, 2013,(1): 49-53.
LIU J, WANG W H, ZHANG D S,etal. Primary mapping ofpur, a gene controlling purple leaf color inBrassicarapa[J].AcatAgriculturaeBoreali-Sinica, 2013,(1): 49-53.
[14] 沈露露,胡春梅,许玉超,等. 水分胁迫对紫色不结球白菜花色苷合成及相关基因表达的影响[J]. 西北农业学报,2016,25(4): 588-594.
SHEN L L, HU C M, XU Y C,etal. Anthocyanins biosythesis and gene expression changes of non-heading chinese cabbage under water stress[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2016,25(4): 588-594.
[15] 郭世荣. 无土栽培学[M]. 北京: 中国农业出版社, 2003: 111-116.
[16] WROLSTAD R E, DURST R W, LEE J. Tracking color and pigment changes in anthocyanin products[J].TrendsinFoodScience&Technology, 2005,16(9): 423-428.
[17] 王英豪,魏国强,张理平. 马齿苋总黄酮含量测定方法的建立[J]. 福建中医药大学学报,2012,(2): 44-46.
WANG Y H, WEI G Q, ZHANG L P. Establishment of determination method of total flavonoids inPortolacaoleraceaL.[J].JournalofFujianUniversityofTCMApril, 2012,(2): 44-46.
[18] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[19] 孙明霞,王宝增,范 海,等. 叶片中的花色素苷及其对植物适应环境的意义[J]. 植物生理学通讯, 2003,(6): 688-694.
SUN M X, WANG B Z, FAN H,etal. Anthocyanins of leaves and their enviromental significance in plant stress responses[J].PlantPhysiologyCommunications, 2003,(6): 688-694.
[20] 王改利,魏 忠,贺少轩,等. 土壤干旱胁迫对酸枣叶片黄酮类代谢及某些生长和生理指标的影响[J]. 植物资源与环境学报, 2011,(3): 1-8.
WANG G L, WEI Z, HE S X,etal. Effects of drought stress in soil on flavonoids metabolism in leaf and some growth and physiological indexes ofZiziphusjujubavar.spinosa[J].JournalofPlantResourcesandEnvironment, 2011,(3): 1-8.
[21] 严美玲,李向东,林英杰,等. 苗期干旱胁迫对不同抗旱花生品种生理特性、产量和品质的影响[J]. 作物学报, 2007, (1): 113-119.
YAN M L, LI X D, LIN Y J,etal. Effects of drought during seedling stage on physiological traits, yield and quality of different peanut cultivars[J].AactAgronomicaSinica, 2007, (1): 113-119.
[22] 康俊梅,杨青川,樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响[J]. 草地学报, 2005, (3): 199-202.
KANG J M, YANG Q C, FAN F C. Effects of drought stress on induced protein in the different drought resistance alfalfa leaf[J].ActaAgrestiaSinica, 2005,(3): 199-202.
[23] 薛建鹏,王秋玉,任 欢. 干旱胁迫下白桦主要生理指标的变化及相互关系[J]. 东北林业大学学报, 2007,35(8): 12-15.
XUE J P, WANG Q Y, REN H. Drought stress-induced responses of physiological indices ofBetulaplatyphylla[J].JournalofNortheastForestryUniversity, 2007,35(8): 12-15.
[24] 王 姗,王竹承. 干旱胁迫对桔梗幼苗生长及生理特性的影响[J]. 西北农业学报, 2014,23(7): 160-165.
WANG S, WANG Z C. Effect of drought stress on growth and physiological characteristics of platycodon grandiflorus seedling[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2014,23(7): 160-165.
[25] HESSINI K, PABLO MARTINEZ J, GANDOUR M,etal. Effect of water stress on growth, osmotic adjustment, cell wall elasticity and water-use efficiency inSpartinaalterniflora[J].EnvironmentalandExperimentalBotany, 2009,67(2): 312-319.
[26] 刘爱华,王永飞. 土壤水分胁迫对生菜幼苗部分生理指标的影响[J]. 西北农业学报, 2010, (6): 144-147.
LIU A H, WANG Y F. Effects of soil water stress on the physiological and biochemical indexes ofLactvcasativaL. during seedling stage[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2010,(6): 144-147.
[27] 姚小兰,周 琳,冯茂松,等.干旱胁迫对不同基质网袋桢楠幼苗生长及生物量的影响[J].植物研究,2018,(1):81-90.
YAO X L, ZHOU L, FENG M S,etal. Effects of drought stress on the growth and biomass ofPhoebezhennan’ seedling in different substrates net container[J].BulletinofBotanicalResearch, 2018,(1): 81-90.
[28] 高桐梅,吴 寅,李 丰,等.苗期水分胁迫对芝麻生长和生理特性的影响[J].核农学报,2017,(11): 2 229-2 235.
GAO T M, WU Y, LI F,etal. Effects of water stress on physiological characteristics and growth under water stress in seedling of sesame[J].JournalofNuclearAgriculturalSciences, 2017, (11): 2 229-2 235.
[29] 白丽荣,时丽冉,郭晓丽,等.水分胁迫对不同基因型小黑麦和黑麦苗期生理特性的影响[J].作物杂志,2016, (4): 118-122.
BAI L R, SHI L R, GUO X L,etal. Effects of water stress on physiological characteristics of different genotypes of triticale and rye seedlings[J].Crops, 2016, (4): 118-122.
[30] 王 颖,潘 杰,狄松巍,等.水分胁迫对玉簪的影响[J].林业科技,2018, (1): 22-25.
WANG Y, PAN J, DI S W,etal. Effect of water stress onHosbaplantagine[J].ForestryScience&Technology, 2018, (1): 22-25.
[31] 吴婧舒,周广柱,周金峰. 运用生理生化指标对平榛抗旱性的综合评价[J]. 湖北农业科学, 2010,49(1): 56-59.
WU J S, ZHOU G Z, ZHOU J F.Comprehensive evaluation of drought resistance inCorylusheterphyllawith physiological and biochemical indices[J].HubeiAgriculturalSciences, 2010,49(1): 56-59.
[32] 艾克拜尔,伊垃洪,周抑强,等. 土壤水分对不同品种棉花叶绿素含量及光合速率的影响[J]. 中国棉花, 2000,27(2): 21-22.
AIKEBAIER, YILAHONG, ZHOU Y Q,etal. Effects of soil water on chlorophyll content and photosynthetic rate of cotton in different varieties[J].ChinaCotton, 2000,27(2): 21-22.
[33] 魏爱丽,王志敏,翟志席,等. 土壤干旱对小麦旗叶和穗器官C4光合酶活性的影响[J]. 中国农业科学, 2003,36(5): 508-512.
WEI A L, WANG Z M, ZHAI Z X,etal. Effect of soil drought on C4photosynthesis enzyme activities of flag leaf and ear in wheat[J].ScientiaAgriculturaSinica, 2003,36(5): 508-512.
[34] 许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯,1997,33(4): 241-244.
XU D Q. Some problemsint somatal limitation analysis of photosynthesis[J].PlantPhysiologyCommunications, 1997,33(4): 241-244.
[35] 马 清,楼洁琼,王锁民. Na+对渗透胁迫下霸王幼苗光合特性的影响[J]. 草业学报, 2010, (3): 198-203.
MA Q, LOU J Q, WANG S M. Effect of Na+on photosynthetic characteristics ofZygophyllumxanthonylomseedlings under osmotic stress[J].ActaPrataculturaeSinica, 2010, (3): 198-203.
[36] 周 帅. 非生物胁迫对香樟挥发物及荧光特性的影响[D]. 杭州:浙江农林大学, 2012.
[37] 王振兴,陈 丽,艾 军,等. 不同干旱胁迫对山葡萄的光合作用和光系统Ⅱ活性的影响[J]. 植物生理学报, 2014,50(8): 1 171-1 176.
WANG Z X, CHEN L, AI J,etal. Effects of different drought stress on photosynthesis and activity of photosystem Ⅱ in leaves of amur grape (Vitisamurensis)[J].PlantPhysiologyJournal, 2014,50(8): 1 171-1 176.
[38] GOLDING A J, JOHNSON G N. Down-regulation of linear and activation of cyclic electron transport during drought[J].Planta, 2003,218(1): 107-114.
[39] 张兴华,高 杰,杜伟莉,等. 干旱胁迫对玉米品种苗期叶片光合特性的影响[J]. 作物学报, 2015,41(1): 154-159.
ZHANG X H, GAO J, DU W L,etal. Effects of drought stress on photosynthetic characteristics of maize hybrids at seedling stage[J].TheCropJournal, 2015,41(1): 154-159.

