2个石榴品种果皮花色苷合成相关基因表达分析
招雪晴,苑兆和
(南京林业大学 南方现代林业协同创新中心, 南京 210037; 南京林业大学 林学院, 南京 210037)
石榴(PunicagranatumL.)属于千屈菜科石榴属[1],是人类较早栽培的果树之一,原产于伊朗、阿富汗等中亚地区,后向东传入印度和中国,往西传入地中海国家(土耳其、埃及、突尼斯、摩洛哥、西班牙等),现在热带、亚热带、暖温带等地区都有广泛栽培。石榴种质资源丰富,全世界品种和类型超过1 000多个。2 000多年以前,石榴沿丝绸之路传入中国,形成了丰富的遗传多样性[2-3],许多不同花色、不同果色的品种成为石榴研究的重要材料。
色泽是果实外观品质的重要指标,花色苷是决定果实色泽的主要物质。目前,花色苷生物合成途径已经比较清楚(图1),花色苷与原花色素、黄酮醇等类黄酮物质共享底物及上游代谢路径,是类黄酮途径的一个分支[4-6]。花色苷合成的转录调控在玉米(ZeamaysL.)、金鱼草(AntirrhinummajusL.)、矮牵牛(Petuniahybrida)等模式植物上研究已比较深入[7]。目前,苹果(MaluspumilaMill.)、葡萄(VitisviniferaL.)等果树中花色苷合成调控研究已取得了重要研究进展。苹果中有多个MYB基因控制花色苷的合成,其中,MdMYBA[8]和MdMYB1[9]控制果皮着色,MdMYB10控制果肉的颜色[10];白皮葡萄UFGT基因不表达,不能合成花色苷,但白皮葡萄和红皮葡萄中UFGT基因的序列并未发生变化[11],Kobayashi等[12]发现白皮葡萄之所以不能合成花色苷是由于控制UFGT基因表达的调节基因发生了突变。目前,虽然也有石榴果实花色苷合成相关基因的分离与表达分析报道[13-16],但花色苷合成基因在不同色泽品种间的表达差异未见有比较研究。由于基因表达的差异可能反映了不同的花色苷合成调控机制,本研究选取了2个不同红色石榴品种为材料,对果皮花色苷合成相关基因进行表达分析,研究这些基因的表达特性及差异,分析它们在果实着色中可能的作用,以期为石榴果实红色色泽调控研究奠定基础。
1 材料和方法
1.1 材 料
本研究以2个石榴品种‘红宝石’和‘墨石榴’为试验材料。‘墨石榴’俗称‘紫石榴’,自幼果时果皮即呈紫红色,具有极高的观赏价值,是著名的观花观果品种;‘红宝石’是‘大红袍’的优异芽变品种,果实成熟时呈大红色[17]。‘红宝石’、‘墨石榴’样品采自山东省枣庄市峄城区万亩石榴园内。分别在7月15日到9月13日采样,共采样7次,具体采样时间为7月15、25日,8月4、14、24日和9月3、13日,每次各品种分别采8个果样。为减少采样误差,采样时选取长势基本一致的植株,在树冠的东、南、西、北四个方位均匀采摘。果实放在冰壶内运到实验室后,取果实外果皮混匀,液氮速冻后放入-80 ℃冰箱备用。
1.2 方 法
1.2.1果皮总花色苷的提取取样品0.2 g,加入5 mL 0.1% HCl-甲醇溶液4 ℃浸提过夜后,10 000 r/min离心15 min,将上清液转移到新的离心管中,利用岛津UV-1601分光光度计分别测定530 nm、657 nm处的吸光值A530和A657,按照Mehrtens 等[18]的方法计算总花色苷含量(Q):Q =(A530-0.25×A657)/样品重量,每次均准确称量0.2 g样品,以吸光度值(A530-0.25×A657)的变化表示果皮总花色苷含量的变化。重复3次。
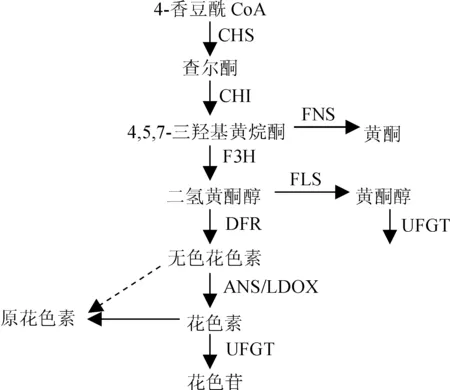
CHS. 查尓酮合成酶; CHI. 查尓酮异构酶; FNS.黄酮合成酶; F3H. 黄烷酮-3-羟化酶; FLS. 黄酮醇合成酶; DFR. 二氢黄酮醇-4-还原酶; ANS. 花青素合成酶; LDOX. 花色素双加氧酶; UFGT. 类黄酮糖基转移酶CHS. Chalcone synthase; CHI. Chalcone isomerase; FNS. Flavone synthase; F3H. Flavanone 3-hydroxylase; FLS. Flavonol synthase; DFR. Dihydroflavonol 4-reductase; ANS. Anthocyanidin synthase; LDOX. Leucoanthocyanidin dioxygenase; UFGT. UDP-glucose-flavonoid 3-O-glucosyltransferase
1.2.2实时荧光定量PCR(qRT-PCR) 提取石榴果皮总RNA(RNAprep Pure Plant Kit,天根,北京),并进行反转录。反转录程序参照Thermo scientific公司的反转录试剂盒RevertAid First Strand cDNA Synthesis Kit进行。获得的cDNA稀释10倍后作为qRT-PCR模板。qRT-PCR采用SuperReal PreMix Plus试剂盒 (天根,北京),在Bio-Rad iQ5 real time PCR systems完成。根据课题组前期克隆到的石榴果皮花色苷合成基因CHS、CHI、F3H、DFR、ANS、UFGT的cDNA序列,利用Primer Premier software 6.0设计荧光定量PCR特异引物(表1)。每个样品进行3次重复。
qRT-PCR的反应体系为 20.0 μL ,其中的SYBR Green为10 μL(SuperReal PreMix Plus, 天根,北京,中国),上下游引物各0.6 μL (10 μmol·L-1), cDNA为1 μL, RNase-free水为7.8 μL。反应程序为:95 ℃预变性 15 min; 95 ℃ 10 min; 58 ℃ 20 s; 72 ℃ 30 s,共 40个循环;以PgActin(GenBank登录号GU376750)为内参。数据分析采用2-ΔΔCT方法[19],以‘红宝石’7月15日样品为对照,设定基因的表达量为1,得出各基因的相对表达量。同一时期果皮取样3次,分别提取果皮RNA后反转录进行qRT -PCR,每个样品设3个重复,取平均值。
1.2.3数据分析及相关性评价采用SPSS 19.0统计软件对数据进行分析,用Pearson相关系数评价花色苷含量与各基因表达量之间的相关关系。
2 结果与分析
2.1 总花色苷含量的变化
图 2显示, ‘红宝石’石榴果实发育过程中,果皮色泽逐渐变红,是一个典型的花色苷逐渐积累的过程。从图3中可以看出,‘红宝石’果皮中总花色苷含量随着果实发育不断增加,与果皮颜色不断加深的变化(图2)相一致;‘墨石榴’果皮颜色在整个发育期内都呈紫红色,没有明显色泽变化,但其果皮总花色苷含量有明显的波动,初期时总花色苷含量较高,而后迅速下降,后期时花色苷含量则基本维持在较低水平(图3)。在整个果实发育过程中‘墨石榴’的花色苷含量水平明显高于‘红宝石’(图3)。
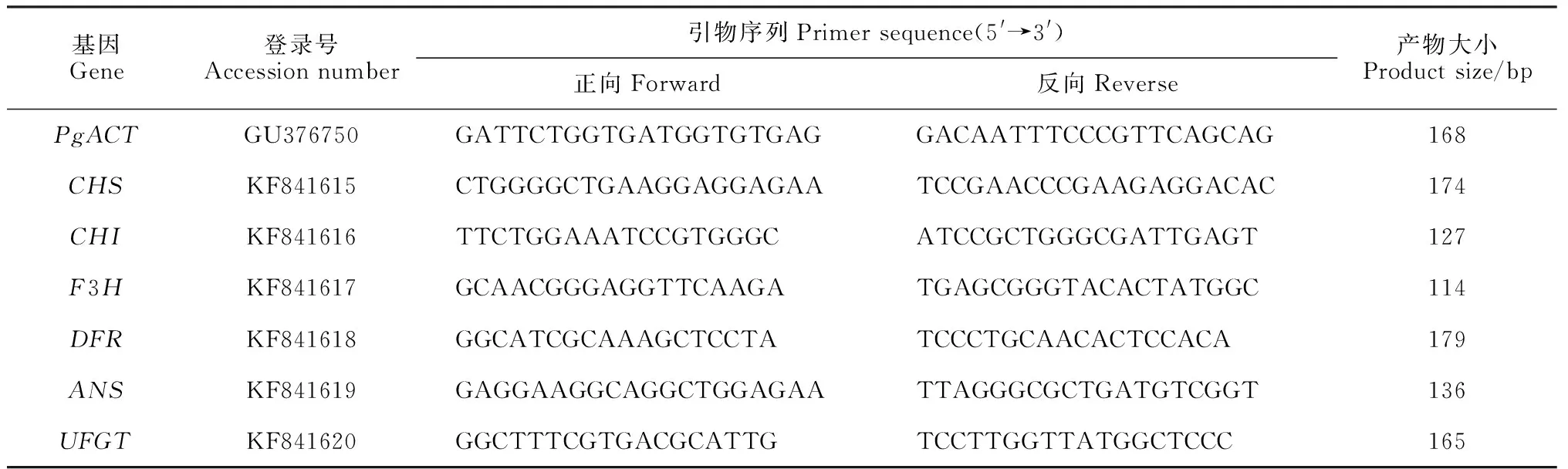
表1 实时荧光定量PCR引物

图2 不同采样时期 ‘墨石榴’和‘红宝石’的果皮色泽Fig.2 Fruit peel color of ‘Moshiliu’ and ‘Hongbaoshi’ pomegranate in different sampling dates
2.2 花色苷合成相关基因的表达特性
采用qRT-PCR方法,分别对花色苷合成相关的CHS、CHI、F3H、DFR、ANS、UFGT等6个基因在果实发育过程中的相对表达量进行了研究,结果如图4所示。
在‘红宝石’石榴中,CHS、F3H、DFR、UFGT等4个基因在初期表达量逐渐升高,在8月4日时到达一个小高峰后迅速下降,而后又逐渐升高,在后期9月13日时又出现一个表达高峰;CHI基因的表达高峰首先出现在7月25日,之后其转录水平下降,然后又不断升高,后期到9月13日时又达到表达高峰,即CHS、CHI、F3H、DFR、UFGT等5个基因有前期和后期2个表达高峰;而ANS的转录水平在整个果实发育期内逐渐增加,在9月13日到达表达高峰;在‘墨石榴’中,CHS、CHI、F3H、DFR、ANS5个基因一开始的表达量最高,而后出现下降,中后期的表达水平虽然有所升高,但仍不及初期时的水平,在果实发育后期(从9月3日到9月13日),这5个基因的表达水平都出现了较大幅度的下降;UFGT基因在‘墨石榴’中的表达模式与其他几个基因有差异,其转录水平先是不断下降,然后又快速升高,到8月14日时出现一个表达高峰,其后表达量又缓慢下降。
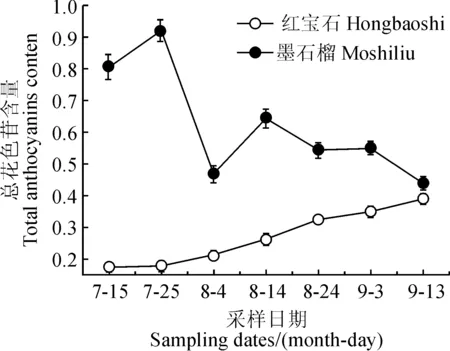
图3 2个石榴品种在果实发育过程中总花色苷含量的动态变化Fig.3 Changes of total anthocyanins content in two pomegranate cultivars during fruit deuelopment
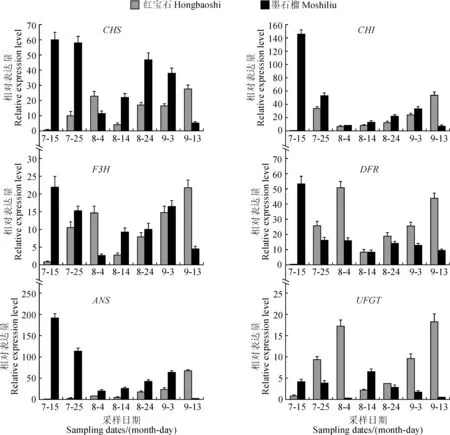
图4 2个石榴品种在果实发育过程中各基因的相对表达量(均值±SD)Fig.4 Relative expression levels of anthocyanin genes in two pomegranate cultivars during fruit development (mean value±SD)
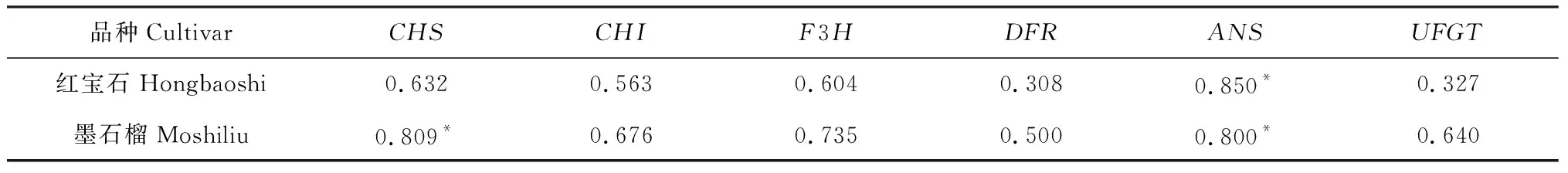
表2 基因表达量与总花色苷含量的Pearson相关系数Table 2 Pearson correlation coefficient between total anthocyanins content and gene expression levels
结果显示,参与花色苷合成的相关基因在2个红色石榴品种中具有不同的表达模式。‘红宝石’中CHS、CHI、F3H、DFR、ANS、UFGT等6个基因的末期表达量明显高于‘墨石榴’;‘墨石榴’中CHS、CHI、F3H、DFR、ANS等5个基因的表达水平在初期即明显高于‘红宝石’,两者完全不同的基因表达模式可能是2个石榴品种色泽差异的原因所在。
2.3 总花色苷含量与基因表达的相关性
对2个石榴品种果实发育期内总花色苷含量与花色苷相关基因的表达量进行了相关性评价。表2列出了表征相关性的Pearson相关系数。从中可以看出,在‘红宝石’果实发育期内,ANS基因的表达量与花色苷含量相关系数达到0.850,呈显著正相关;在‘墨石榴’中,CHS和ANS2个基因的表达水平与花色苷含量相关系数分别为0.809和0.800,均为显著正相关。这表明ANS基因与‘红宝石’石榴中花色苷合成关系密切,CHS和ANS2个基因与‘墨石榴’中花色苷合成联系紧密。
3 讨 论
花色苷是石榴果皮呈红色的主要色素物质[13,20]。花色苷含量差异是‘红宝石’和‘墨石榴’2个品种色泽差异的物质基础。花色苷合成相关基因的表达直接决定了花色苷的积累。在‘红宝石’着色的过程中,花色苷合成相关基因CHI、CHS、DFR、F3H、UFGT等都出现了早期和晚期2个表达高峰,类似基因表达模式在葡萄[21]、越橘(Vacciniummyrtillus)[22]、野苹果(MalussylvestrisL.)[23]、桃(PrunuspersicaL.)[24]等果树的花色苷合成中都有报道。进一步对比后发现,‘红宝石’中这些花色苷相关基因的表达模式与总花色苷含量逐渐累积的变化趋势有很大不同。石榴果皮中含有大量的酚类物质,花色苷、黄酮、黄酮醇、原花色素(缩合单宁)都经由类黄酮途径来完成,在合成过程中共用一些酶催化反应。我们推测,在石榴果实色泽发育的早期,这些基因表达量的升高很可能主要参与催化合成黄酮类和原花色素等物质,而后期的转录表达高峰则主要是进行花色苷的大量合成。例如,草莓(Fragaria×ananassaDuch.)中DFR基因在绿果期和花色苷积累初期有2个表达高峰,果实成熟期时的高表达与花色苷合成有关,而在早期的高表达则与缩合单宁的积累有关[25]。
在‘墨石榴’中,这些基因呈现出与‘红宝石’不同的表达模式。除UFGT基因外,其他5个基因在初期的表达量很高,而中后期含量有所下降。这种表达模式与果皮总花色苷含量的变化模式有一定的相似性,这些基因很可能协同参与了‘墨石榴’果皮花色苷的合成。CHS、CHI、F3H、DFR、ANS等基因早期的高位运行,说明它们在转录和催化反应中比较活跃,在发育初期就积累了大量底物用于花色苷的合成,这大概是‘墨石榴’果皮在早期就呈现紫红色的原因所在。另外,UFGT是基因超家族,反应底物广泛,能够催化花色苷、黄酮、黄酮醇等多种物质的糖基化反应[26],因而,‘墨石榴’中UFGT基因很可能不仅仅负责花色苷合成,还同时参与了其他类黄酮物质的催化反应。
通过比较分析发现,‘红宝石’中CHS、CHI、F3H、DFR、ANS、UFGT等6个基因的末期表达量明显高于‘墨石榴’;‘墨石榴’的CHS、CHI、F3H、DFR、ANS等基因初期表达水平明显高于‘红宝石’,说明这些花色苷合成基因在初期和末期的表达水平差异与石榴果皮色泽差异密切相关。‘红宝石’和‘墨石榴’的着色模式完全不同,基因表达差异表明两者可能具有不同的花色苷调控机制。
目前在许多物种中已经发现了花色苷合成的关键基因。在苹果[27-29]、杨梅(Myricarubra)[30]、荔枝(LitchichinensisSonn.)[31]、菊花(Dendranthemagrandiflorum)[32]等的研究中发现,DFR和UFGT的基因表达与花色苷含量的积累一致;DFR和ANS可能是云南红梨(Pyruspyrifolia)‘早白蜜’果皮着色的限制因子[33]。而UFGT基因的表达与否则决定了红葡萄与白葡萄不同的表型[11];CHS与DFR是桃花色苷合成中的关键基因[24]。本研究中的相关性分析表明,ANS基因在‘红宝石’石榴花色苷合成过程中起重要作用,ANS和CHS基因与‘墨石榴’花色苷合成关系也很密切。Ben-Simhon等[13]对2个不同红石榴类型进行的研究中发现,主要花色苷含量与转录调控因子WD40、MYB和结构基因DFR、ANS的表达具有较高的相关性,转录调控因子很可能通过特异调控DFR和ANS基因来控制矢车菊素(主要花色苷)的合成;最近的研究发现,ANS基因编码区变异导致白皮石榴花色苷合成受阻[34],这些结果表明ANS基因是石榴花色苷合成的关键。本研究虽未发现DFR基因与花色苷合成之间的相关性联系,但结果也表明了ANS基因在石榴花色苷合成中的重要作用。
选育优质的红色石榴品种是石榴育种的一个重要目标,深入研究石榴花色苷合成调控机制是育种的理论基础。本研究选择2个果皮着色有突出差异的品种为研究试材,分析了两者花色苷合成相关基因的表达差异。由于不同品种间遗传背景的差异,ANS和CHS是否为2个石榴品种花色苷合成的关键基因,以及它们是否与花色苷合成调节转录因子存在互作关系,还需要进一步功能验证研究。
4 结 论
‘红宝石’和‘墨石榴’2个石榴品种表现出不同的花色苷积累规律,‘红宝石’中CHS、CHI、F3H、DFR、ANS、UFGT等6个基因的末期表达量明显高于‘墨石榴’,‘墨石榴’的CHS、CHI、F3H、DFR、ANS等基因初期表达水平明显高于‘红宝石’,这些花色苷合成基因表达水平在初期和末期的显著差异可能是造成2个品种着色差异的原因。ANS基因是‘红宝石’花色苷合成中的关键,而CHS和ANS基因在‘墨石榴’花色苷合成中扮演重要角色。
参考文献:
[1] YUAN Z, FANG Y, ZHANG T,etal. The pomegranate (PuniagranatumL.) genome provides insights into fruit quality and ovule developmental biology[J].PlantBiotechnologyJournal, 2018, doi:10.1111/pbi.12875.
[2] YUAN Z, YIN Y, QU J,etal. Population genetic diversity in Chinese pomegranate (PunicagranatumL.) cultivars revealed by fluorescent-AFLP markers[J].JournalofGeneticsandGenomics, 2007,34(12): 1 061-1 071.
[3] 苑兆和, 尹燕雷, 朱丽琴, 等. 山东石榴品种遗传多样性与亲缘关系的荧光AFLP分析[J].园艺学报, 2008,35(1): 107-112.
YUAN Z H, YIN Y L, ZHU L Q,etal. Genetic diversity and relationship in pomegranate (PunicagranatumL.) cultivars in Shandong revealed by fluorescent-AFLP markers[J].ActaHorticulturaeSinica, 2008,35(1): 107-112.
[4] WINKEL-SHIRLEY B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology[J].PlantPhysiology, 2001,126(2): 485-493.
[5] 于晓南, 张启翔. 观赏植物的花色素苷与花色[J]. 林业科学, 2002,38(3): 147-153.
YU X N, ZHANG Q X. Anthocyanin in ornamental plant and color express[J].ScientiaSilvaeSinicae, 2002,38(3): 147-153.
[6] TANAKA Y, OHMIYA A. Seeing is believing: engineering anthocyanin and carotenoid biosynthetic pathways[J].CurrentOpinionBiotechnology,2008,19(2): 190-197.
[7] 刘晓芬, 李 方, 殷学仁, 等. 花青苷生物合成转录调控研究进展[J]. 园艺学报, 2013,40(11): 2 295-2 306.
LIU X F, LI F, YIN X R,etal. Recent advances in the transcriptional regulation of anthocyanin biosynthesis[J].ActaHorticulturaeSinica, 2013,40(11): 2 295-2 306.
[8] BAN Y, HONDA C, HATSUYAMA Y,etal. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J].Plant&CellPhysiology, 2007,48(7): 958-970.
[9] TAKOS A M, JAFFÉ F W, JACOB S R,etal. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J].PlantPhysiology, 2006,142(3): 1 216-1 232.
[10] ESPLEY R V, HELLENS R P, PUTTERILL J,etal. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYB10[J].PlantJournal, 2007,49(3): 414-427.
[11] BOSS P K, DAVIES C, ROBINSON S P. Expression of anthocyanin biosynthesis pathway genes in red and white grapes[J].PlantMolecularBiology, 1996,32(3): 565-569.
[12] KOBAYASHI S, GOTO-YAMAMOTO N, HIROCHIKA H. Retrotransposon- induced mutations in grape skin color[J].Science, 2004,304(5 673): 982.
[13] BEN-SIMHON Z, JUDEINSTEIN S, NADLER-HASSAR T,etal. A pomegranate (PunicagranatumL.) WD40-repeat gene is a functional homologue of Arabidopsis TTG1 and is involved in the regulation of anthocyanin biosynthesis during pomegranate fruit development[J].Planta, 2011,234(5): 865-881.
[14] ZHAO X, YUAN Z, FENG L,etal. Cloning and expression of anthocyanin biosynthetic genes in red and white pomegranate[J].JouranlofPlantResearch, 2015,128(4): 687-696
[15] 关晓弯, 陈 磊, 涂佳丽, 等. 石榴果肉PgF3′5′H基因克隆及不同温度处理下的表达分析[J]. 西北植物学报, 2016,36(3): 435-443.
GUAN X W, CHEN L, TU J L,etal. Clone ofPgF3′5′Hgene in pomegranate pulp and its expression under different temperature treatments[J].ActaBotanicaBoreali-OccidentaliaSinica, 2016,36(3): 435-443.
[16] 招雪晴, 李 勃, 苑兆和. 石榴PgUFGT基因克隆及表达分析[J]. 西北植物学报, 2017,37(4): 646-653.
ZHAO X Q, LI B, YUAN Z H. Cloning and expression analysis ofPgUFGTgene fromPunicagranatumL.[J].ActaBotanicaBoreali-OccidentaliaSinica, 2017,37(4): 646-653.
[17] 苑兆和, 招雪晴, 尹燕雷, 等. 石榴新品种 ‘红宝石’[J]. 园艺学报, 2012,39(6): 1 211-1 212.
YUAN Z H, ZHAO X Q, YIN Y L,etal. A new pomegranate cultivar ‘Hongbaoshi’[J].ActaHorticulturaeSinica, 2012,39(6): 1 211-1 212.
[18] MEHRTENS F, KRANZ H, BEDNAREK P,etal. The Arabidopsis transcription factor MYB12 is a flavonol-specific regulator of phenylpropanoid biosynthesis[J].PlantPhysiology, 2005,138(2): 1 083-1 096.
[19] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001,25(4): 402-408.
[20] ZHAO X, YUAN Z, FANG Y,etal. Characterization and evaluation of major anthocyanins in pomegranate (PunicagranatumL.) peel of different cultivars and their development phases[J].EuropeanFoodResearch&Technology, 2013,236(1): 109-117.
[21] BOSS P K, DAVIES C, ROBINSON S P. Analysis of the expression of anthocyanin pathway genes in developingVitisviniferaL. cv Shiraz grape berries and the implications for pathway regulation[J].PlantPhysiolology, 1996,111(4): 1 059-1 066.
[22] JAAKOLA L, MAATTA K, PIRTTILA A M,etal. Expression of genes involved in anthocyanin biosynthesis in relation to anthocyanin, proanthocyanidin, and flavonol levels during bilberry fruit development[J].PlantPhysiology, 2002,130(2): 729-739.
[23] KONDO S, HIRAOKA K, KOBAYASHI S,etal. Changes in the expression of anthocyanin biosynthetic genes during apple development[J].JournaloftheAmericanSocietyforHorticulturalScience, 2002,127(6): 971-976.
[24] TSUDA T, YAMAGUCHI M, HONDA C,etal. Expression of anthocyanin biosynthesis genes in the skin of peach and nectarine fruit[J].JournaloftheAmericanSocietyforHorticulturalScience, 2004,129(6): 857-862.
[25] MOYANO E, PORTERO-ROBLES I, MEDINA-ESCOBAR N,etal. A fruit--specific putative dihydroflavonol 4-reductase gene is differentially expressed in strawberry during the ripening process[J].PlantPhysiology, 1998,117(2): 711-716.
[26] 王 军, 于 淼. 葡萄次生代谢UDP-糖基转移酶研究进展[J]. 园艺学报, 2010,37(1): 141-150.
WANG J, YU M. Research progress on UDP-glycosyltransferases in grape secondary metabolism pathway[J].ActaHorticulturaeSinica, 2010,37(1): 141-150.
[27] HONDA C, KOTODA N, WADA M,etal. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin[J].PlantPhysiology&Biochemistry, 2002,40(11): 955-962.
[28] TAKOS A M, JAFFÉ F W, JACOB S R,etal. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J].PlantPhysiolology, 2006,142(3): 1 216-1 232.
[29] ESPLEY RV, BRENDOLISE C, CHAGNÉ D,etal. Multiple repeats of a promoter segment causes transcription factor autoregulation in red apples[J].PlantCell, 2009,21(1): 168-183.
[30] NIU S, XU C, ZHANG W,etal. Coordinated regulation of anthocyanin biosynthesis in Chinese bayberry (Myricarubra) fruit by a R2R3MYB transpription factor[J].Planta, 2010,231(4): 887-899.
[31] WEI Y Z, HU F C, HU G B,etal. Differential expression of anthocyanin biosynthetic genes in relation to anthocyanin accumulation in the pericarp ofLitchichinensisSonn[J].PLoSOne, 2011,6(4): e19455.
[32] 陈素梅, 朱喜荣, 陈发棣, 等. 不同花色菊花品种花色素结构基因的表达特性[J]. 西北植物学报, 2010,30(3): 453-458.
CHEN S M, ZHU X R, CHEN F D,etal. Expression profiles of anthocyanin biosynthetic genes in Chrysanthemum cultivars with different flower colors[J].ActaBotanicaBoreali-OccidentaliaSinica, 2010,30(3): 453-458.
[33] ZHANG X, ALLAN A C, YI Q,etal. Differential gene expression analysis of Yunnan red pear,Pyruspyrifolia, during fruit skin coloration[J].PlantMolecularBiologyReporter, 2011,29(2): 305-314.
[34] BEN-SIMHON Z, JUDEINSTEIN S, TRAININ T,etal. A ‘white’ anthocyanin-less pomegranate (PunicagranatumL.) caused by an insertion in the coding region of the leucoanthocyanidin dioxygenase (LDOX; ANS) gene[J].PloSOne, 2015,10(11): e0142777.

