多指标正交试验优选菟杞强肾口服液提取工艺*
陶松 ,刘玲 ,魏筱华 ,潘德城 ,周健 ,段舟萍
(1、南昌大学第一附属医院药学部,南昌 330006;2、江西省人民医院药学部,南昌 330008)
菟杞强肾口服液是根据古人治疗不孕不育经验的基础,汲取了五子衍宗丸[1]的组方特点,结合肾亏引起的不育不孕的病因病机和自身的临床经验所立的经验方,是我院传统方剂。该方由枸杞子、菟丝子、覆盆子、车前子、五味子、桑葚子,韭菜子及淫羊藿八味中药组成,本方枸杞子、菟丝子为方中之君药,主要活性成分为为枸杞多糖、菟丝子多糖[2,3]。 覆盆子、五味子、桑椹子、淫羊藿、韭菜子为臣药;车前子渗利湿热,起着“反佐”作用,可以达到补中泻,涩中有利,泻中寓补,并治尿后余沥不尽,为本方之佐药。诸药合用共奏益肾补精,助阳止遗的功效。其中淫羊藿含有主要有效成分为多糖和黄酮类化合物,还含有生物碱类、酚苷类、微量元素和有机酸等[4],它们是菟杞强肾口服液发挥药效的重要物质基础,且主要有效成分易溶于水,本试验采用正交试验设计,以淫羊藿苷、干膏得率、总黄酮、总多糖的含量为考察指标,采用多指标综合评分法[5]优选菟杞强肾口服液提取工艺。
1 仪器与试药
UV-1206紫外分光光度计;TDE5-WS多管架自动平衡离心机;岛津AUW220十万分之一电子天平;AB104-N型万分之一天平;KDM型调温电热套 (山东鄄城华鲁电热仪器有限公司);Agilent 1100 高效液相色谱仪 (Agilent,USA);SK5200H 型数控超声波清洗器;超纯水机;10ml具塞试管;所用玻璃仪器均为天玻牌A级。
芦丁对照品(批号:100080-200707,含量测定用,中国药品生物制品检定所);D-无水葡萄糖对照品(批号:110833-200503,含量测定用,中国药品生物制品检定所);淫羊藿苷对照品(中国药品生物制品检定所,供含量测定用,批号:110737-200312);实验所用药材购自江西江中武宁中药有限公司,经本院中药专家鉴定均为合格品;甲醇(色谱纯,山东禹王实验有限公司化工分公司);其余试剂均为分析纯。
2 方法与结果
2.1 试验设计 根据此方的传统服用方法,采用水为溶媒,试验以提取时间、提取次数、加水量为考察因素,以干膏得率、淫羊藿苷、总黄酮及多糖的含量作为考察指标,正交试验因素水平设计见表1。
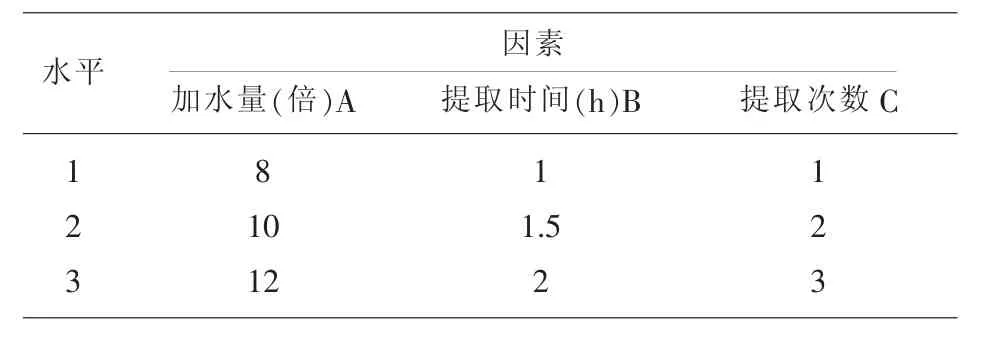
表1 因素水平表
2.2 淫羊藿苷含量测定
2.2.1 色谱条件 ZORBAX SB-C18色谱柱(250mm×4.6mm,5μm);流动相:甲醇-水(63:37);体积流量:1.0ml/min;检测波长:270nm;柱温:25℃;进样量:10μl。
2.2.2 溶液制备 对照品溶液的制备:取淫羊藿苷对照品2.24mg,精密称定,置10ml容量瓶中,用甲醇定容至刻度,摇匀,精密吸取1ml,置10ml量瓶中,用甲醇定容至刻度,摇匀即得对照品溶液。供试品溶液的制备:精密吸取菟杞强肾口服液2ml置于25ml量瓶中,加甲醇超声处理30min,冷却至室温,用甲醇稀释至刻度,摇匀,经0.45μm滤膜过滤,取续滤液,即得。
2.2.3 标准曲线绘制 精密吸取淫羊藿苷对照品溶液 1、5、10、15、20μl注入高效液相色谱仪, 记录色谱峰面积,以对照品浓度(X)为横坐标对峰面积(Y)为纵坐标绘制标准曲线,得线性回归方程为:y=1318.1x+13.923,相关系数r=0.9999。线性范围在0.0224-0.448μg,呈良好的线性关系。
2.2.4 精密度试验 精密吸取淫羊藿苷对照品溶液(0.0224mg/ml),重复进样 6 次,每次进样 10μl,按色谱条件测定,计算,结果淫羊藿苷的峰面积平均值为314.6,RSD值为1.12%,表明仪器的精密度良好。
2.2.5 溶液稳定性试验 按“2.2.2”项下制备供试品溶液,放置 0、2、4、8、12、24h 后,按上述色谱条件进行HPLC分析。记录峰面积,计算,结果淫羊藿苷峰面积的RSD值为1.43%,表明供试品溶液在24h内基本稳定。
2.2.6 重复性试验 取同一批号样品各6份,按“2.2.2”项下方法制备样品溶液,按上述色谱条件进行HPLC分析,以淫羊藿苷峰面积平均值计算含量,结果平均含量为0.2083mg/ml,含量的RSD值为1.39%,表明该方法重复性较好。
2.2.7 加样回收率试验 精密吸取已知含量的本品溶液(批号:20170721)2ml,各 6 份,分别精密吸取淫羊藿苷对照品溶液 2ml(0.224mg/ml),摇匀,按样品的处理方法将其制成供试品溶液,按上述液相色谱条件测定,计算加样回收率,结果淫羊藿苷的平均回收率为100.08%,RSD为1.25%,该法回收率较高。
2.3 菟杞强肾口服液中总黄酮含量测定
2.3.1 对照品溶液的制备 精密称取在120℃干燥至恒重的芦丁对照品22.00mg,置于100ml容量瓶中,加60%乙醇适量超声溶解,再加60%乙醇至刻度,摇匀,即得每1ml含无水芦丁0.22mg的对照品溶液。
2.3.2 供试品溶液的制备 精密吸取本品溶液1.0ml于10ml容量瓶中,加无水乙醇至刻度,边加边摇,待沉淀完全后,移至10ml离心管中,离心10min,取上清液即得供试品溶液。
2.3.3 测定波长的选择 用芦丁对照品溶液测定菟杞强肾口服液中总黄酮的含量。精密吸取对照品溶液、样品溶液各4.0ml,分别置于25ml量瓶中,按2.3.4标准曲线的制备项下方法操作,并在400-600nm范围内扫描,结果在510nm处有最大吸收波长,其它成分对测定法无干扰,因此本试验以510nm作为测定波长。
2.3.4 标准曲线的制备 使用10ml刻度吸管,精密吸取芦丁对照品溶液 1.0,2.0,3.0,4.0,5.0,6.0,7.0ml,分别置于25ml量瓶中,分别加入5%亚硝酸钠1.0ml,混匀,放置6min,然后加入10%硝酸铝1.0ml,混匀,再放置6min;加入1mol/L氢氧化钠溶液10.0ml,用60%乙醇稀释至刻度,混匀,放置15min,以相应的试剂为空白,照紫外-可见分光光度法于510nm处测定吸光度,以芦丁对照品溶液浓度(mg/ml)为横坐标,吸光度为纵坐标,绘制标准曲线。结果表明,芦丁对照品浓度在0.0088-0.0616mg/ml范围内与吸光度呈良好线性关系,其回归方程为:y=12.817x-0.0211,r=0.9999。
2.3.5 方法学考察
2.3.5.1 精密度与重现性考察 取同一批样品溶液,精密吸取2.5ml各6份置于25ml容量瓶中,按2.3.2方法制备供试品溶液,得6份25ml样品溶液,每份各取4ml 3份,按2.3.4方法测定吸光度,代入回归方程计算总黄酮含量,结果平均RSD为1.34%,说明该方法的精密度和重复性良好。
2.3.5.2 显色稳定性考察 精密吸取样品溶液4ml于25ml容量瓶中,按2.3.4的方法测定吸光度。当显色体系反应完全后,每隔5min记录一次吸光度值,连续25min考察显色稳定性。结果在25min内样品溶液吸光度变化不大,RSD为0.57%,故本实验选择在显色体系反应完全后25min内测定吸光度值。
2.3.5.3 加样回收率考察 精密移取已知总黄酮含量(2.5442mg/ml)成品溶液 5ml各6份,按样品含量与加入对照品含量(1:1)的比例加入芦丁对照品,按2.3.2项下方法制备供试品溶液并测定吸光度,计算加样回收率,结果平均回收率99.34%,RSD为1.65%,该方法回收率较高。
2.4 菟杞强肾口服液中总多糖含量测定
2.4.1 对照品溶液的制备 精密称取105℃干燥至恒重的葡萄糖标品8.35mg置于100ml容量瓶中,加水溶解并稀释至刻度,摇匀,即得每1ml含葡萄糖标品0.0835mg的标准工作溶液。
2.4.2 供试品溶液的制备 精密吸取样品溶液1ml,加无水乙醇 4ml,离心(4000r/min)10min,弃去上清液,沉淀用80%乙醇溶液洗涤2-3次,每次8ml,离心10min,弃去洗液,残渣用沸水提取5次,每次5ml,合并提取液至50ml容量瓶中,加蒸馏水至刻度,摇匀即得。
2.4.3 测定波长的选择 精密吸取0.8ml葡萄糖对照品溶液(0.0835mg/ml)于10ml具塞试管中,分别加水补至2.0ml,再分别加入6%苯酚1.0ml,摇匀,再迅速沿壁滴加浓硫酸5.0ml,摇匀,沸水浴中加热15min ml,取出,迅速冷却至室温(冰水浴中)。以试剂为空白,进行比色测定,在400-800nm范围内扫描,结果在490nm处有最大吸收,因此本试验以490nm作为测定波长。
2.4.4 标准曲线的绘制 精密吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.5ml, 置于 10ml具塞试管中,分别加水补至2.0ml,再分别加入6%苯酚1.0ml,摇匀,再迅速沿壁滴加浓硫酸5.0ml,摇匀,沸水浴中加热15min,取出,迅速冷却至室温(冰水浴中)。以试剂为空白,于490nm波长处测吸光度A,以葡萄糖溶液浓度(mg/ml)为横坐标,吸收度A为纵坐标,绘制标准曲线,求得标准曲线的回归方程为A=55.041X+0.0251,相关系数 r=0.9999;结果表明,葡萄糖在0.0021mg/ml-0.0157mg/ml范围内与吸收度具有良好的线性关系。
2.4.5 精密度试验 按 “2.4.2供试品溶液的制备”项下制备菟杞强肾口服液样品溶液一份,参照标准曲线绘制项下的方法进行测定,连续测定6次,记录其吸光度值,结果RSD为0.33%(n=6),说明仪器精密度良好。
2.4.6 显色稳定性试验 精密吸取供试品溶液0.2ml,置于10ml具塞试管中,分别加水补至2.0ml,再分别加入6%苯酚1.0ml,摇匀,再迅速沿壁滴加浓硫酸5.0ml,摇匀,沸水浴中加热15min,取出,迅速冷却至室温(冰水浴中)。另以2.0ml蒸馏水作为空白对照同上平行操作,每隔5min于490nm波长处测定吸光度值,连续测定30min考察显色稳定性,结果平均吸光度为0.273,RSD为1.13%,说明样品在显色后30min内吸光度基本不变,显色稳定性良好。
2.4.7 重复性试验 按 “2.4.2供试品溶液的制备”项下制备菟杞强肾口服液样品溶液6份,参照标准曲线绘制项下的方法进行测定,记录其吸光度值,结果菟杞强肾口服液样品中总多糖平均含量为9.0139,RSD=1.98%(n=6), 说明该方法重复性良好。
2.4.8 加样回收率考察 精密移取已知总多糖含量(9.0139mg/ml)成品溶液 1ml各6份,按样品含量与加入对照品含量(1:1)的比例加入葡萄糖对照品,按“2.4.2供试品溶液的制备”项下方法制备供试品溶液,按标准曲线的测定条件测定吸光度,计算加样回收率,结果菟杞强肾口服液平均回收率为 100.25%,RSD=1.47(n=6),该方法回收率较高。
2.5 干膏得率的测定 照 《中华人民共和国药典》(2015年版一部)附录XA浸出物测定法,精密量取提取定容液25ml,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3h,移置干燥器中,冷却30min,迅速精密称定重量,以干燥品计算供试品中浸出物的含量。按下列公式计算干膏得率。
2.6 正交试验结果与分析 按1/10处方量称取36g药材,共9份,结合生产实际,考察加水量、提取时间、提取次数进行提取。分别按L9(34)正交试验表安排实验,煎煮药液定容至100ml,取样测定干膏得率、淫羊藿苷、总黄酮及总多糖的含量。本试验采用综合评分法对菟杞强肾口服液提取工艺进行评价,结果见表2,方差分析见表3。
通过SPSS软件,测定结果进行直观分析和方差分析,结果表明直观因素中,综合值:C>B>A。因此影响提取工艺的因素顺序为C(提取次数)>B(提取时间)>A(加水量)。方差分析中,C因素对有效成分含量及干膏得率有显著性影响。所以仅提取次数对试验结果有显著性影响,加水量和提取时间对试验结果均没有显著性影响,根据直观分析确定最佳提取工艺为A2B3C3,但因加水量和煎煮时间均无显著性影响,从实际生产节约成本考虑可初步确定提取工艺为:加水量10倍,煎煮3次,每次2h或加水量10倍,煎煮3次,第一次2h,第二、三次各1h,以下试验进一步考察这两种提取条件的差异,以最终确定最佳提取工艺。
2.7 验证试验 工艺1:称取1/10处方量药材共36g,共3份,加10倍水煎煮3次,每次2h,合并煎煮液,过滤,减压浓缩,定容至一定体积,备用。工艺2:称取 1/10处方量药材共 36g,共 3份,加 10倍水煎煮3次,第一次2h,第二、三次各1h,合并煎煮液,过滤,减压浓缩,定容至一定体积,备用。取以上6个样品分别测定其淫羊藿苷、干膏得率、总黄酮及多糖的含量。结果见表4,可以看出,工艺一和工艺二的结果无明显差异,从生产中节约成本和缩短生产周期考虑,选择以工艺二即加水量10倍,煎煮三次,第一次2h,第二、三次各1h作为最终提取工艺。RSD均符合要求,表明优选出的工艺条件稳定可靠。
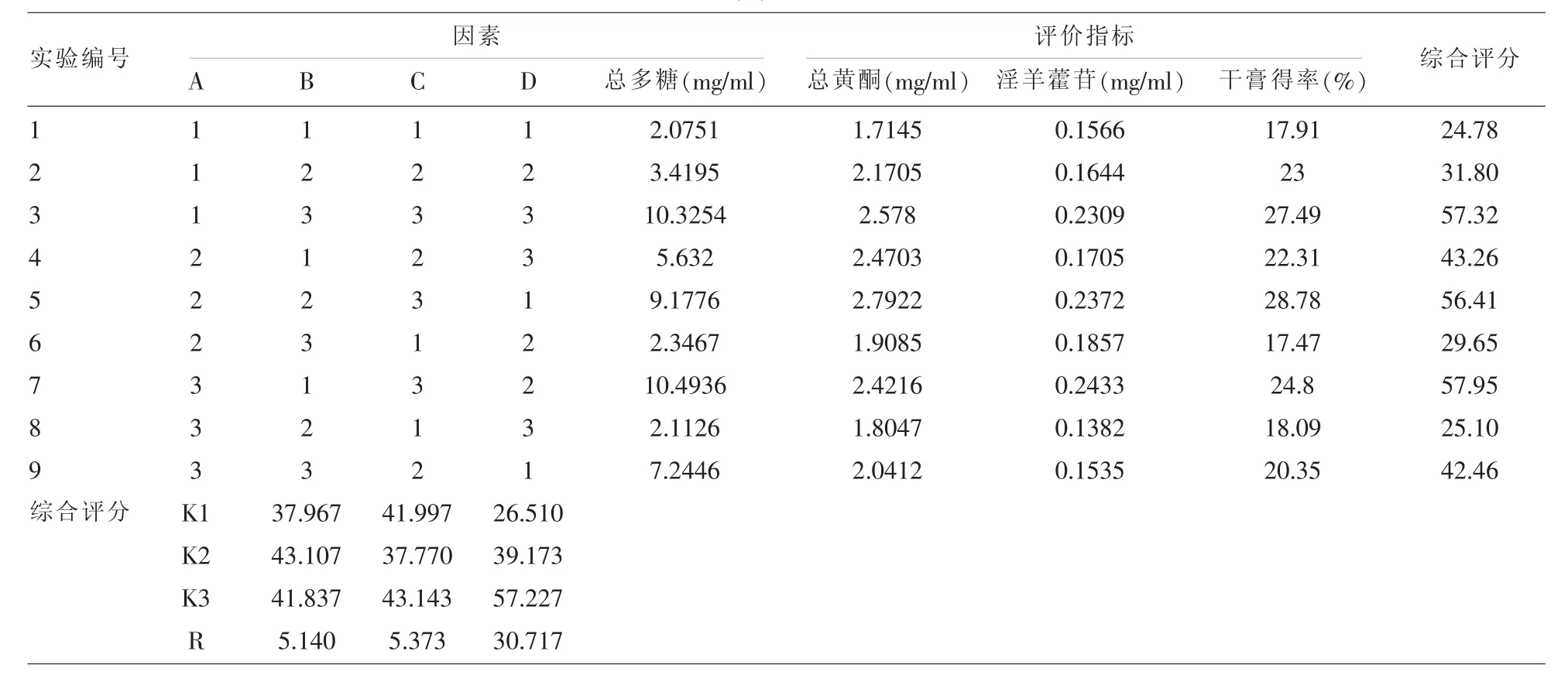
表2 L9(34)正交实验结果
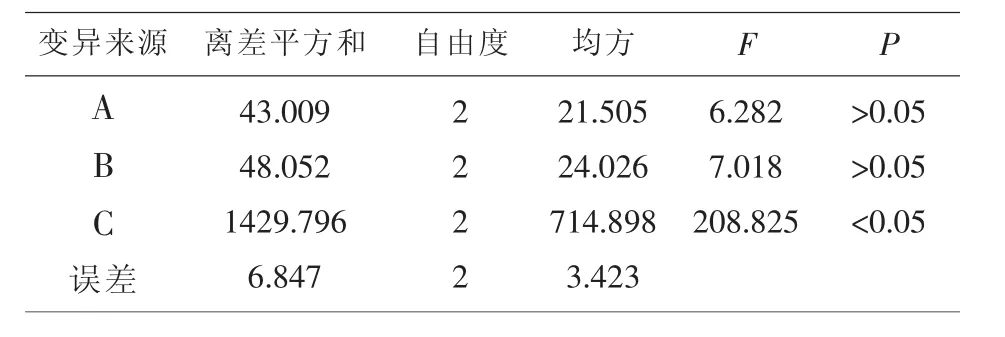
表3 方差分析表
3 讨论
菟杞强肾口服液的处方是江西省中医院伍炳彩教授根据古人治疗不孕不育经验的基础,汲取了五子衍宗丸的组方特点,结合肾亏引起的不育不孕的病因病机和自身的临床经验所立的经验方。菟杞强肾口服液是根据伍炳彩教授的临床验方开发的,主要针对肾亏引起的不孕不育,适应证突出,明确,具有治愈肾虚精少、阳痿早泄、遗精、精冷、余沥不清等功效。现已在临床广泛应用,疗效好,受到患者的一致好评。
考虑到此方为传统汤剂,通过文献检索枸杞子、菟丝子、覆盆子、车前子、五味子、桑葚子,韭菜子及淫羊藿八味中药化学成分得知有效成分水溶性成分较多,故采取水提法。本方枸杞子、菟丝子为方中之君药。覆盆子、五味子、桑椹子、淫羊藿、韭菜子为臣药,故以活性成分总黄酮、总多糖、淫羊藿苷、干膏得率为考察指标,进行多指标综合评价分析。据对预期影响大小赋予不同权重,行加权求和而转化为单一指标进行评价。将总多糖含量和总黄酮含量的权重系数定为0.3,淫羊藿苷和干膏得率的权重系数定为0.2,保证分析选取指标全面性,通过该方法确定最佳提取工艺,证明了优选的工艺确实合理可行。

表4 验证试验结果
[1]张泰,窦桂芳,王学美,等.RP-HPLC法同时测定加味五子衍宗方汤剂3种活性成分的含量[J].药物分析杂志,2011,31(1):22-26.
[2]黄琳娟,林颖,田庚元,等.枸杞子中免疫活性成分的分离、纯化及物理化学性质的研究[J].药学学报,1998,33(7):512-516.
[3]刘利萍,刘建,陈海丰,等.中药菟丝子的研究进展[J].中药材,2001,24(11):839-843.
[4]谢娟平,孙文基.淫羊藿属植物化学成分及药理研究进展[J].海峡药学,2006,18(5):17-20.
[5]刘立民,侯雄军,汤韶明,等.多指标正交试验优选桉芩止咳糖浆提取工艺[J].江西中医药大学学报,2016,28(2):59-62.
[6]曹蕾,单丽芳,杨红梅,等.金水涤痰口服液的提取工艺考察[J].中国实验方剂学杂志,2016,22(7):31-34.
[7]刘弘,王俊杰,张玲昂,等.加权综合评分法优化心得宁口服液提取工艺的研究[J].中医学报,2014,29(1):76-78.
[8]刘弘,张振巍,姬志强.多指标综合评分法优选清热解毒口服液提取工艺[J].中药材,2012,35(8):1326-1329.
[9]蒋霞,向雪芳,黄李平,等.祛风安脑口服液的制备工艺研究[J].中国医院用药评价与分析,2017,17(11):1468-1470.
[10]崔思娇,杨光照,于士龙,等.蛹虫草口服液提取工艺的研究[J].中医药导报,2017,23(19):53-54.
[11]张礼仲.清咽凉茶的提取工艺研究[J].江西医药,2015,50(6):579-581.
[12]王宏顺,严喜鸾.超声波辅助提取山银花中绿原酸工艺的研究[J].江西医药,2017,52(9):854-857.

