载去甲斑蝥素介孔二氧化硅纳米粒的制备及体外释药研究*
★ 熊友香 马瑞 汤红霞 李范珠
(浙江中医药大学药学院 杭州 310053)
去甲斑蝥素(Norcantharidin,NCTD),是经鞘翅目芫青科昆虫斑蝥的抗癌有效成分斑蝥素(cantharidin,CTD)结构改造而来,是当前国际上第一个有升高白细胞作用的抗癌药物,也是我国首次合成的抗肿瘤药物[1]。NCTD 具有较强的抗肿瘤活性,且抑瘤谱广,其在临床上主要用于治疗消化道肿瘤,尤其是原发性肝癌[2-5]。尽管NCTD在治疗作用方面具有很大潜力,但其对泌尿系统的毒性仍然限制了它的应用[6-7]。由于NCTD的半衰期很短,甚至较高剂量都无法长时间保持最低有效浓度[8-10]。为达到NCTD“增效减毒”的目的,必须提高NCTD在肝肿瘤部位的分布,持续缓慢释放。因此,构建一个对NCTD具有一个缓控释作用的递药系统,是十分有意义的。
介孔二氧化硅纳米粒(Mesoporous Silica Nanoparticles,MSN)具类蜂窝状多孔结构,孔径2 ~ 50 nm,安全、稳定、表面易修饰。以MSN作为药物载体,具有较高载药量,介孔结构可控制药物释药过程,达到药物缓控释目的[11-12]。
本实验以介孔二氧化硅为载体材料,制备载去甲斑蝥素纳米粒,并对其进行表征及制剂学评价。
1 仪器与材料
GZX-9140MBE数显鼓风干燥箱(上海博迅实业有限公司);Mill-Q超纯水仪(美国Millpore公司);KQ 5200DE型数控超声波清洗器(昆山市超声仪器有限公司);CP225D电子天平(北京赛多利斯仪器系统有限公司);pH 酸度计(瑞士Mettler-Toledo 公司);DF-101S集热式恒温加热磁力搅拌器(郑州科创仪器有限公司); TGL-16B高速台式离心机(上海安亭科学仪器厂);Optima MAX超速低温离心机(美国Beckman有限公司);SX3-1.5-10马弗炉(杭州卓驰仪器有限公司);Nano-ZS90激光粒度分析仪(英国Malvern仪器有限公司);TRISTARⅡ3020全自动比表面和孔隙分析仪(美国Micromeritics仪器公司);JEM-1200EX 透射电子显微镜(日本JEOL公司)。
十六烷基三甲基溴化铵(CTAB,分析纯);正硅酸四乙酯(TEOS,美国Sigma-Aldrich公司);25% 氨水(上海阿拉丁试剂有限公司);无水乙醇(天津市永大化学试剂有限公司);氢氧化钠(天津市永大化学试剂有限公司);甲醇(分析纯);磷酸二氢钾(天津市永大化学试剂公司);磷酸(国药集团化学试剂公司);去甲斑蝥素标准品(NCTD,中国食品药品检定研究所提供,批号:100414-2005);去甲斑蝥素原料药(宝康市国康生物科技有限公司,批号:ZL20140510A,纯度:99.16%)。水为纯化水。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent ZORBAX SB-C18(4.6mm×250 mm,5μm);流动相:0.025mol/L磷酸二氢钾溶液-甲醇(85∶15),用磷酸调pH值到3.0;柱温:30℃;流速:1.0 mL/min;检测波长:210 nm;进样量:20μl。以去甲斑蝥素的峰面积为纵坐标(Y),其浓度为横坐标(X)进行线性回归,得回归方程为:Y=833.05X+0.64527,r=0.9996,表明NCTD在4~128μg/mL范围内线性关系良好。考察其高、中、低3种浓度溶液的日内和日间精密度RSD均小于2%。
2.2 MSN的制备及表征 采用改良的经典Stober法。精密称取CTAB 0.45 g,加入乙醇45 mL并于300 mL去离子水超声溶解,25 % 氨水调pH值到11.5,搅拌升温到75 ℃,加入适量TEOS,恒温高速持续搅拌2 h,反应结束后室温下静置熟化24 h。将样品用水和乙醇交替洗涤多次,离心(12000 r/min ,15 min)得到白色固体,放入烘箱干燥获得有机无机复合物;将干燥好的样品置于550 ℃马弗炉程序煅烧6h去除模板剂,即得到白色粉末状介孔二氧化硅纳米粒。
通过TEM观察, MSN呈圆整球形,形态规整,分散性良好,无团聚现象。由于介孔的存在,MSN表面粗糙,并且高倍镜下可以清晰观察到高度有序的六角形排列介孔结构(见图1)。经激光粒度分析仪测定后,除模板剂之后MSN粒径为140 nm(PDI 0.15),Zeta电位为35mV。如图所示,用N2吸-脱附等温线分析MSN的比表面积和平均孔径,根据IUPAC分型,该BET曲线在相对压力P/P00.3~0.7段明显符合IV型分布,说明MSN有均匀的介孔结构,孔径集中在2.857nm。BET测定结果表明, MSN的比表面积达1165.542m2/g,孔容积为2.159cm3/g。

图1 MSN透射电镜图
2.3 MSN-NCTD的制备 采用反复饱和溶液吸附法:精密称取适量NCTD样品(记为W1)于圆底烧瓶中,并加入适量纯化水配制NCTD饱和溶液,热水条件下使之溶解,再将同等重量干燥至恒重的MSN,再加入一定浓度的乙醇,放置恒温水浴锅中25℃下搅拌2 h,同时每隔10 min超声1 min,然后在15 000 r/min下离心30 min,得到白色稠状物置于烘箱(80℃)中干燥,得到白色粉末,离心后得到的上清液精密吸取0.1 ml置于10 mL容量瓶中定容记为A11,同时在精密吸取相同体积的溶液进行补液。NCTD饱和溶液反复利用,重复以上步骤,记为A12、A13、A14……An(n=8)。即得到去甲斑蝥素介孔二氧化硅纳米粒(MSN-NCTD)。同样,做空白对照,将一定量MSN记为W2分散到纯化水中,方法同上,空白MSN上清液只取一次记为A01。载药量=(纳米粒中药物的质量/总质量的比值)×100%。MSN-NCTD的载药量高达12.88%,见图2。
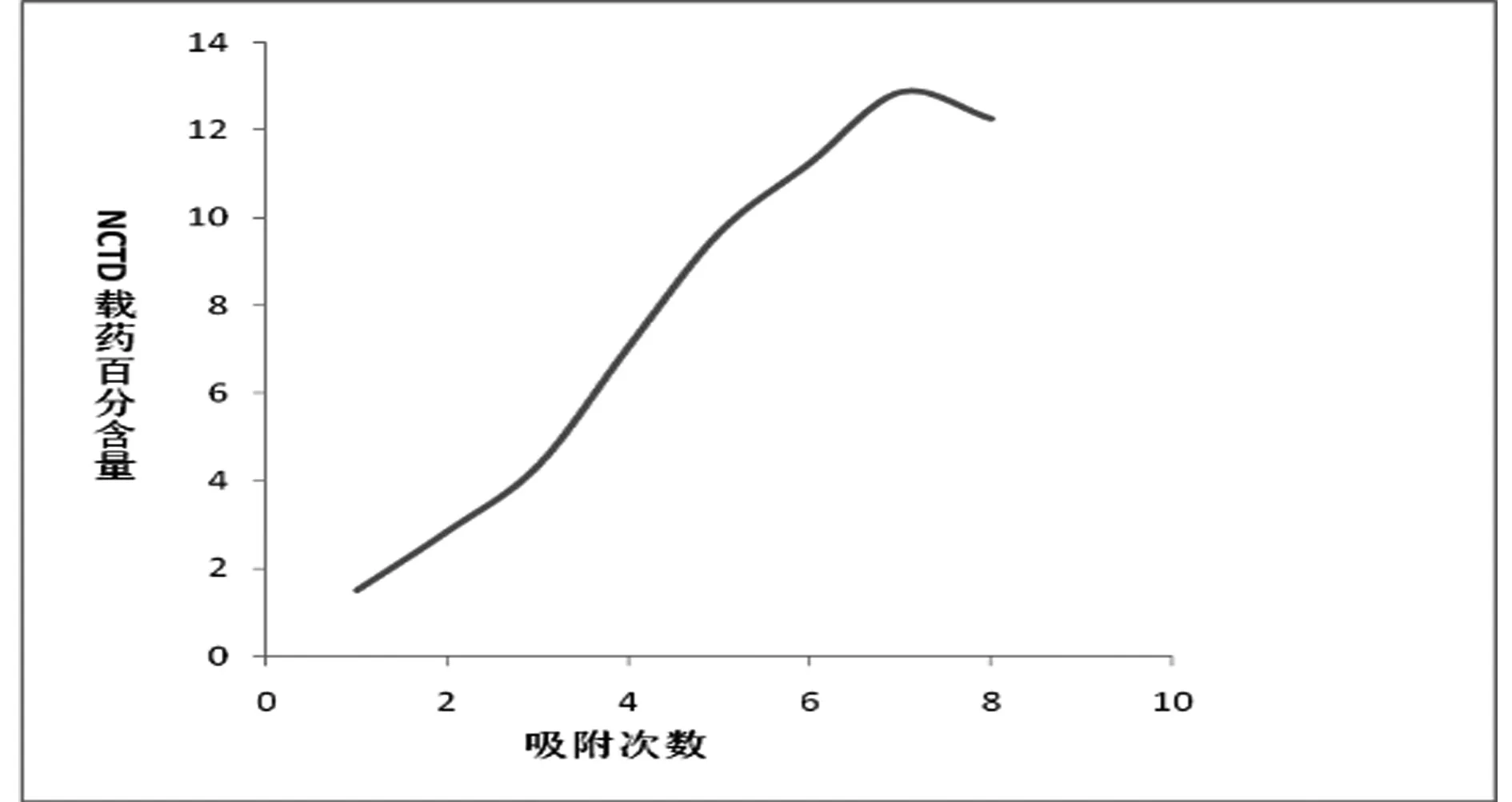
图2 MSN载NCTD吸附次数研究
2.4 体外释放 采用透析法。精密吸取已知含量的MSN-NCTD,置于处理好的透析袋内,扎紧后置于锥形瓶中,以100mL PBS缓冲液(pH=7.4)为释放介质,将其放入恒温振荡箱中,于(37±0.5)℃,100r/min条件下进行释放试验,分别于0、0.25、0.5、0.75、1、2、4、6、8、12、24、48h取样0.5 mL,并补加等体积等温释放介质。样品过0.45μm微孔滤膜,续滤液经HPLC测定NCTD浓度,计算相应累计释放度,同法考察NCTD原料药的释放情况。体外释放曲线见图3。MSN-NCTD与NCTD相比,呈现出明显的缓释特性。NCTD释放迅速,4h内释放量高达90.6%,MSN-NCTD在12h趋于平缓,累计释放量为83.34%,显示出纳米粒的缓释特性。

图3 NCTD和MSN-NCTD体外释放
3 讨论
MSN的制备方法有模板法(Stober法)、沉淀法和水热合成法等,其中Stober法是最为常用的一种,主要是以表面活性剂为模板,在其上交替吸附相反电荷电解质的硅原料,在经过酸性乙醇萃取或煅烧去除模板剂,得到MSN。传统的Stober法制备工艺周期长,所得到MSN均一性差,模板剂残留多,介孔较小影响载药等问题。本文采用改良Stober法,在原工艺的基础上,加入适量的乙醇减少MSN团聚,增加反应体系的温度,加快反应进程,选用适宜的碱调节反应的pH值,用蒸馏水和乙醇反复洗涤去除模板剂,在通过550 ℃煅烧去除模板剂,最终得到介孔孔径和粒径均一、分散性好的MSN。
反复饱和溶液吸附法是一种非常有效的载药方法,与其他载药方法如浸渍法、共轭结合法、酸碱吸附法等相比较,反复饱和溶液吸附法操作简单、重现性好,无需贵重仪器设备,最重要的是随着吸附次数的增加,可以显著的提高药物的载药量,可有效的解决了纳米递药系统载药量低的问题,但该方法也仅限于具有刚性结构的无机载体材料,如MSN、介孔二氧化钛等材料,但在反复吸附的过程中也存在着总量的损失及药物的释放问题。因此有吸附最大量的考察,本文通过反复吸附实验,绘制吸附曲线图,最终确定最佳的吸附次数,为同类实验的进行可提供一定的实验参考。
[1]Bertini I, Calderone V, Fragai M, et al. Structural basis of serine/threonine phosphatase inhibition by the archetypal small molecules cantharidin and norcantharidin[J].J Med Chem, 2009, 52(15): 4 838-4 843.
[2]Chang C, Zhu Y, Tang X, et al. The anti-proliferative effects of norcantharidin on human HepG2 cells in cell culture[J].Mol Biol Rep, 2011, 38(1): 163-169.
[3]Lu S, Gao Y, Huang X, et al. Cantharidin exerts anti-hepatocellular carcinoma by miR-214 modulating macrophage polarization[J]. Int J Biol Sci, 2014, 10(4):415-425.
[4]Deng L, Dong J, Wang W. Exploiting protein phosphatase inhibitors based on cantharidin analogues for cancer drug discovery[J].Mini Rev Med Chem, 2013, 13(8):1 166-1 176.
[5]Wang Y, Xu M, Di ZH, et al. Regulation of demethylation and re-expression of RASSF1A gene in hepatocellular carcinoma cell lines treated with NCTD in vitro[J].J Cancer Res Ther, 2015, 11(4):818-822.
[6]Liu XH, Blazsek I, Comisso M, et al. Effects of norcantharidin, a protein phosphatase type-2A inhibitor, on the growth of normal and malignant haemopoietic cells[J].Eur J Cancer, 1995, 31(6): 953-963.
[7]Hill TA, Stewart SG, Ackland SP, et al. Norcantharimides, synthesis and anticancer activity: Synthesis of new norcantharidin analogues and their anticancer evaluation[J].Bioorg Med Chem, 2007, 15(18): 6 126-6 134.
[8]Lixin W, Haibing H, Xing T, et al. A less irritant norcantharidin lipid microspheres: formulation and drug distribution[J]. Int J Pharm, 2006, 323(1-2): 161-167.
[9]Li DC, Zhong XK, Zeng ZP, et al. Application of targeted drug delivery system in Chinese medicine[J].J Control Release, 2009, 138(2): 103-112.
[10]Bei YY, Chen XY, Liu Y, et al. Novel norcantharidin-loaded liver targeting chitosan nanoparticles to enhance intestinal absorption[J].Int J Nanomedicine, 2012(7): 1 819-1 827.
[11]Nan A, Bai X, Son SJ, et al. Cellular Uptake and Cytotoxicity of Silica Nanotubes[J].Nano Lett, 2008, 8(8): 2 150-2 154.
[12]Tang FQ, Li LL, Chen D. Mesoporous Silica Nanoparticles: Synthesis, Biocompatibility and Drug Delivery[J].Adv Mater, 2012, 24(12):1 504-1 534.

