针刺足三里对端粒酶基因敲除小鼠免疫细胞因子表达影响的研究*
★ 卜婉萍 杨晓婷 林燊 张志灿 林栋
(福建中医药大学 福州 350122)
端粒酶基因敲除小鼠(telomerase-deficient,Terc-/-)是由于端粒酶基因的缺失导致其无法正常表达而出现衰老及免疫功能下降的表现。众所皆知针刺足三里具有强身健体、延年益寿之效,而现代医学研究认为其抗衰老的机制与调节免疫、内分泌功能及调控相关衰老基因的表达等相关[1]。细胞因子在炎症及免疫反应过程具有调节作用,表现出局部性及短暂性的特点但生物学效应强[2]。本次实验通过检测端粒酶基因敲除小鼠外周血清相关免疫细胞因子的表达以研究针刺足三里调节免疫功能的机制。
1 材料与方法
1.1 实验动物 实验动物采用Terc-/-小鼠,此模型动物是端粒酶表达缺失,通过新霉素片段替换了野生型C57BL/6J小鼠3号染色体的端粒酶基因而产生,(https://www.jax.org/strain/023535)。此模型动物引进于美国Jackson Laboratory(Stock#004132),由上海茂生衍生物科技有限公司代理引进(货号No.MS13-127)。保种、育种于福建中医药大学动物实验研究中心无特定病原体级转基因动物室(SPF级),实验动物通过福建中医药大学动物伦理委员会的审核标准。本实验选用第4代端粒酶基因敲除(Generation4Terc-/-)小鼠(SPF级),由于基因片段的缺失,Terc-/-小鼠到第三代之后会出现早衰现象,故选用第四代做动物模型。实验动物在实验全过程中均严格按照国际动物保护及使用指南相关规定进行。
1.2 PCR法鉴定Terc-/-小鼠基因表型 待小鼠3周龄时进行腮丛静脉采血,从其血液中提取DNA,运用聚合酶链式反应(polymerase chain reaction,PCR)法鉴定基因型。PCR反应体系为5×PCR Buffer 2.4μl,10mmol/L dNTPs 0.24μl,20μmol/L引物各0.3μl,TaqDNA聚合酶(2.5U/μl)0.05μl,DNA模板2μl,双蒸水4.85μl。引物为:Mutant Forward:ATT TGT CAC GTC CTG CAC GACG Wild Forward:GCA CTC CTT ACA AGG GAC GA Common:CTT CAA TTT CCT TGG CTT CG(引物序列及反应体系由美国Jackson Laboratory提供.https://www.jax.org/strain/023535)。PCR反应条件:预变性95℃3min;变性94℃ 30s;退火58℃35s;延伸72℃40S;修复延伸72℃8min;35个循环,目的片段为180bp和350bp,引物由生工生物工程(上海)股份有限公司合成。
1.3 动物分组与干预方法 入组的Terc-/-小鼠共18只,3月龄,随机分为空白组、足三里组、非经非穴组,每组6只小鼠。空白组仅模拟抓握;足三里组针刺双侧足三里穴,针刺深度约1.5mm,干预时间为30分钟且每5分钟行一次捻转手法(平补平泻法),连续干预4天,1天1次。非经非穴组针刺双侧非穴(位于小鼠尾根与肛门之间凹陷旁开3mm的臀部肌肉);针刺深度约1.5mm,干预时间为30分钟且每5分钟行一次捻转手法(平补平泻法),连续干预4天,1天1次。小鼠穴位定位均参照《实验针灸学》[3]中“常用实验动物针灸穴位图”。干预过程中使用富有弹性的塑料网对小鼠进行固定,使小鼠所受的压力最小化,干预针具选择苏州华佗牌针灸针(0.30 mm × 13 mm)。
1.4 取材 在第4天干预结束后半小时进行取材,在小鼠麻醉后,充分暴露小鼠心脏,用注射器从小鼠心脏取出1ml血液,经高速离心机3000转/分钟/15分钟分离出血清,将血清用于细胞因子芯片检测。
1.5 细胞因子芯片检测血清中细胞因子表达量 采用美国Raybiotech公司的鼠细胞因子抗体芯片,按照试剂盒说明书进行实验操作。(1)每个样本分别取100μl血清,依次加入芯片检测孔内,孵育2h后进行清洗。(2)加入生物素连接的抗体,继续进行孵育后清洗。(3)加入荧光染料,再一次进行孵育后清洗。(4)待玻璃芯片完全晾干,用LuxScan-10K/A微阵列芯片扫描仪进行荧光扫描并读取数据进行分析。
1.6 统计学分析 实验数据用统计学软件SPSS 20.0对进行统计分析,组间比较采用单因素方差分析,P<0.05表示具有统计学意义。
2 结果
2.1 Terc-/-小鼠基因表型鉴定 实验中入组的干预动物(Terc-/-小鼠)转基因350bp为PCR产物长度。图1中泳道1、4、5、7、8显示的目的片段在350bp,因此其基因型为纯合子(Gene knockout)。
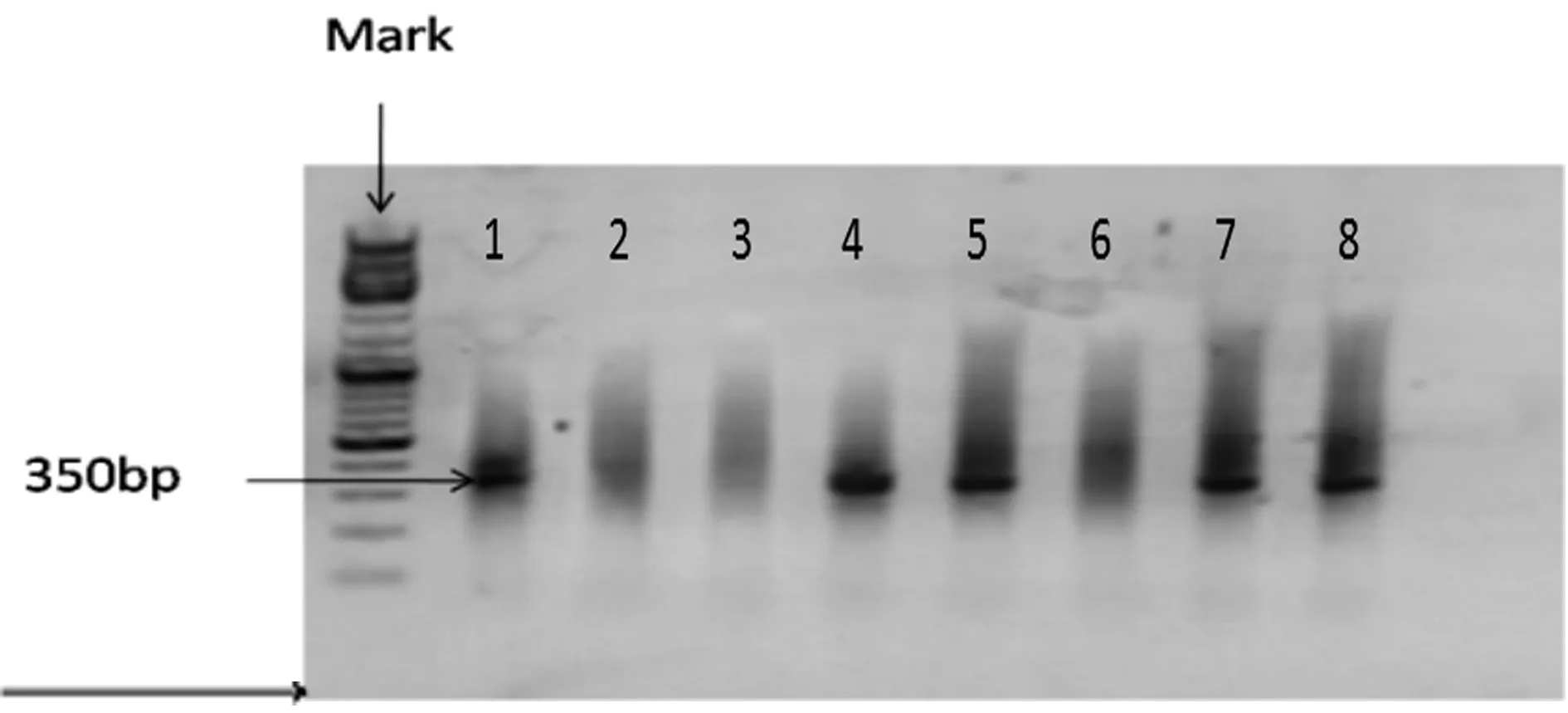
图1 Terc-/-小鼠PCR鉴定结果
2.2 细胞因子芯片检测血清中细胞因子表达量结果 在图2可见,针刺足三里组细胞因子IP-10表达升高(P<0.05);针刺组(包括足三里穴组及非经非穴组)细胞因子IL-6表达大于空白组(P<0.05);针刺足三里和空白组细胞因子mcp-1表达差异不明显,非穴组表达下降(P<0.05);针刺足三里组细胞因子KC表达下降(P<0.05);以上具有统计学意义。图2中细胞因子IFN-γ及G-CSF组别间差异不明显(P>0.05),以上无统计学意义。

图2 细胞因子芯片检测血清中细胞因子表达量结果
3 讨论
端粒酶活性的下降会直接引起细胞凋亡的[4],因此端粒酶基因敲除小鼠随着时间的推移会出现全身性神经系统的自然衰老及免疫功能的下降。Engelhard[5]等研究表明外周血端粒酶也具有活性,因此通过细胞因子芯片技术检测外周血免疫细胞因子可进一步了解端粒酶与衰老及免疫调节的关系。现代研究相关实验表明针灸足三里可改变血液的流变性[6],亦可改善衰老模型鼠的学习及记忆能力[7]。相关研究也表明针灸足三里穴具有调节免疫功能、神经递质、内分泌系统及调控衰老基因的作用[1]。李佳[8]等通过动物实验表明电针足三里可延缓模型鼠的衰老症状。
细胞因子是研究免疫效应的重要指标,机体内不同种类的细胞作用与细胞因子受体而出现重叠的调节作用会形成细胞因子网络[2]。白介素-6(Interleukin-6,IL-6)、粒细胞集落因子(Granulocyte Colony-Stimulating Factor,G-CSF)产生高调节作用而干扰素-γ(Interferon-γ,IFN-γ)是低调节作用[2]。IL-6参与了机体免疫-神经-内分泌网络的调节,其活性的过度增强会加剧细胞的肿胀坏死[9-10],但有相关研究表明IL-6可扩张血管,具有改善微循环的作用[11],及诱导神经细胞分化生长,有助于神经损伤后的修复[12]。实验检测结果提示针刺组IL-6较空白组呈现出相似的上调趋势。IFN-γ与细胞免疫调节密切相关[13],实验结果显明IFN-γ针刺组的表达趋势与空白组相当,呈现低调节但针刺足三里穴组与其他组别差异性不明显还有待进一步实验研究。G-CSF对造血具有重要的调控作用,维持着外周血粒细胞的数量及功能的稳定[14],血清中G-CSF的诱导与急性感染、炎症反应密切相关[15]。因此G-CSF的调节是机体重要的自我保护反馈[15]。细胞因子芯片检测结果表明针刺组与非针刺组差异不明显,与针刺创伤性较小有关。
趋化因子10(Interferon-inducible protein-10,IP-10)、单核细胞趋化蛋白-1(Monocyte Chemoattractant Protein-1,MCP-1)及角蛋白趋化因子(Keratinocytechemoattractant,KC)作用于白细胞的趋化及免疫功能,且与免疫细胞在循环系统及器官间的定向迁移密切相关[13]。因此针刺足三里穴抗衰老与MCP-1间接参与的免疫调节有一定相关性。实验结果表明针刺足三里穴组MCP-1的表达水平与空白组之间无统计学差异,这提示针刺足三里穴可能不会促进MCP-1的表达,但是针刺非经非穴组MCP-1表达量呈现下调趋势可能与针刺效应相关还有待进一步研究。KC的表达量急剧增加会使中枢神经系统的小胶质细胞活化从而导致炎性反应加剧[16]。实验结果表明针刺足三里穴组KC表达量略低于空白组,而非经非穴组表达量上调,因此针刺足三里穴与KC细胞参与免疫调节反应相关。
本次实验结果IFN-γ、G-CSF差异性不明显不具有统计学意义可能与以下原因相关,细胞因子对机体的免疫调节或炎性反应具有瞬时性并且其分泌是短暂的自限性过程[2]。而本次实验是在连续干预4天并在第4天干预结束30分钟后取外周血清,可能错过了细胞因子分泌的最佳时效期。今后,课题组将进一步展开对时效性以及其他组织细胞因子表达的研究,以进一步丰富针灸抗衰老的机制研究。毋庸置疑,针刺足三里穴参与并介导了细胞因子的免疫及炎性过程,对衰老症状的改善具有深远意义。
[1]王玉琳,金泽,孙忠人,等. 针刺抗衰老作用的研究进展[J].中华中医药学刊,2011,30(12):2 723-2 725.
[2]邢杰,王淑芬,翁福海. 细胞因子与炎症[J].天津医科大学学报,2001,7(1):146-148.
[3]方剑乔,郭义. 实验针灸学[M].北京: 中国中医药出版社,2012.
[4]Bodnar A G, Ouellette M, Frolkis M, et al. Extension of life-span by introduction of telomerase into normal human cells[J].Science,1998,279(5349):349-352.
[5]Engelhardt M, Kumar R, Albanell J, et al. Telomerase regulation, cell cycle, and telomere stability in primitive hematopoietic cells[J].Blood,1997,90(1):182-193.
[6]姜小英. 艾灸足三里、关元穴对血液流变性的影响[J].四川中医,2001,19(3):75.
[7]赵利华,陈尚杰,文建军. 艾炷灸足三里、悬钟穴对D-半乳糖致衰老小鼠学习记忆能力的影响[J].广西中医药,2010,33(3):54-55.
[8]李佳,刘建民,刘溪泉,等. 电针“强壮”穴对亚急性衰老大鼠神经免疫调节的影响[J].中国针灸,2009,29(11):905-909.
[9]李丽红,李丽,赵志恩,等. 艾灸、中药对衰老模型大鼠线粒体DNA、血清IL-2、IL-6含量的影响[J].中国针灸,2008,28(9):681-684.
[10]贾玉玲,卞华. 针灸对脑瘫患儿血清IL-6、TNF-α水平的影响[J].中国实用医药,2010,5(34):99-100.
[11]Dihne M, Block F. Focal ischemia induces transient expression of IL-6 in the substantia nigra pars reticulata[J].Brain Res,2001,889(1-2):165-173.
[12]Penkowa M, Giralt M, Lago N, et al. Astrocyte-targeted expression of IL-6 protects the CNS against a focal brain injury[J].Exp Neurol,2003,181(2):130-148.
[13]苏青和. 趋化因子与免疫调节性细胞因子[J].免疫学杂志,2003,19(2):158-161.
[14]吴文,孙关林.慢性肾功能衰竭患者血清粒系集落刺激因子水平观察[J].中华肾脏病杂志,1995,114(6):323-325.
[15]刘寿荣. 肝硬化患者外周血G-CSF及其受体表达状况研究[J].医学研究杂志,2006,35(2):24-26.
[16]Barichello T, Dos S I, Savi G D, et al. TNF-alpha, IL-1beta, IL-6, and cinc-1 levels in rat brain after meningitis induced by Streptococcus pneumoniae[J].J Neuroimmunol,2010,221(1-2):42-45.

