血管内介入栓塞术对颅内动脉瘤患者术后恢复影响
王幸伟 韩玉慧
(河南省巩义市人民医院神经内科 巩义 451200)
颅内动脉瘤的发生率占自发性蛛网膜下腔出血的70%左右,是导致蛛网膜下腔出血的高危因素[1]。颅内动脉瘤起病隐袭,破裂出血前无典型症状及体征,临床治疗难度较高。既往临床多采用开颅夹闭术治疗颅内动脉瘤,但由于其存在手术创伤大、术中出血量多和并发症多等弊端,不利于患者的术后康复。有研究显示,开颅夹闭术受患者的身体状况、动脉瘤大小、周围血管和解剖部位等因素影响较大,多用于治疗大脑中动脉瘤[2]。血管内介入栓塞术作为新型的微创技术,采用微导管及栓塞材料阻塞血管,在减少传统手术所导致的神经组织损伤的同时,也起到了良好的神经保护作用。随着栓塞技术和栓塞材料的不断完善与改进,血管内介入栓塞术的适应症逐步扩大。本研究将血管内介入栓塞术用于颅内动脉瘤患者的治疗中,取得良好的疗效。现报告如下:
1 资料与方法
1.1 一般资料 选取2015年2月~2017年6月我院收治的72例颅内动脉瘤患者作为研究对象,根据手术方案分为对照组和实验组,每组36例。实验组中男19例,女17例;年龄34~73岁,平均年龄(53.51±4.62)岁;病变部位:14例后交通动脉,4例后循环动脉,17例前交通动脉,1例其他;Hunt-Hess分级:8例Ⅲ级,15例Ⅱ级,13例Ⅰ级。对照组中男21例,女 15例;年龄 35~76岁,平均年龄(54.29±5.37)岁;病变部位:15例后交通动脉,3例后循环动脉,15例前交通动脉,3例其他;Hunt-Hess分级:5例Ⅲ级,17例Ⅱ级,14例Ⅰ级。两组患者的病变部位、性别、Hunt-Hess分级、年龄等方一般资料相比较,差异无统计学意义,P>0.05,具有可比性。本研究经医院伦理委员会审核批准。
1.2 纳入标准 经数字血管造影(DSA)证实为颅内动脉瘤的患者;知情并签署手术同意书者。
1.3 排除标准 造血功能及免疫功能障碍者;重要脏器器质性病变者;有手术禁忌证者;传染性疾病患者;有凝血功能障碍者;再发脑血管病变者;无法主动配合治疗者。
1.4 治疗方法
1.4.1 常规治疗 入院后,两组均给予纠正水电解质平衡、控制颅内压、吸氧等常规对症治疗。
1.4.2 对照组 采用开颅夹闭术。采用气管插管麻醉。常规消毒后,于Yasargil翼点右侧入路,由颧弓上耳屏前1 cm发际线内作一长约7~8 cm的弧形切口,直至中线,分开皮瓣,于颞上线交界处、冠状缝分别钻孔,去除骨瓣,分离硬脑膜,开放侧裂池、颈内动脉池和视交叉池,引流脑脊液,显露瘤颈,用临时瘤夹阻断血流,保证动脉瘤彻底夹闭,止血完成后,缝合硬脑膜和头皮。
1.4.3 实验组 采用血管内介入栓塞术。采用气管插管麻醉。全身保持肝素化,术中予以肝素钠,1.25 g/h,根据瘤体的大小和部位与载瘤动脉的关系选取适当的弹簧圈栓塞。于同侧股动脉置入6F 0.070 ENVOY导管,以DSA结果确定最佳的操作角度,将塑形后的微导管前端放于动脉瘤中外1/3处,根据瘤体大小选择适当的弹簧圈填塞,填塞完成后松弛导管,稳定后解脱弹簧圈。根据DSA结果明确栓塞的致密性,并于术中给予尼莫地平注射液,术后用沙袋压迫穿刺部位。
1.5 观察指标 (1)两组的术后并发症发生情况。(2)两组术后3个月的预后良好率。采用格拉斯哥预后量表(GOS)进行评估,Ⅴ级为良好工作与学习;Ⅳ级为中度残疾;Ⅲ级为重度残疾;Ⅱ级为植物生存;Ⅰ级为死亡。Ⅳ级、Ⅴ级为预后良好;Ⅲ级、Ⅱ级、Ⅰ级为预后不良。(3)两组术前和术后3个月的日常生活能力。采用日常生活活动能力量表(ADL)进行评估,共100分,分值越低说明日常生活能力越差。优良率=(Ⅳ+Ⅴ级)/总例数×100%。
1.6 统计学处理 采用SPSS20.0统计学软件,计数资料以%表示,采用χ2检验,计量资料以(x±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组术后并发症发生情况比较 实验组的并发症发生率为5.56%,低于对照组27.78%,差异有统计学意义,P<0.05。见表1。
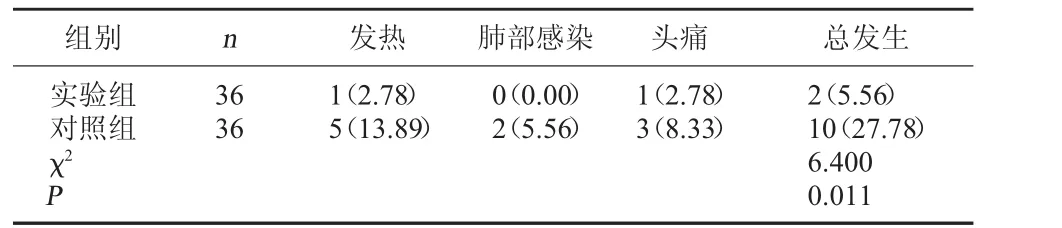
表1 两组术后并发症比较[例(%)]
2.2 两组的GOS分级比较 术后3个月,实验组的GOS分级优良率为75.00%,高于对照组的52.78%,差异有统计学意义,P<0.05。见表2。

表2 两组的GOS分级比较[例(%)]
2.3 两组的ADL评分比较 术后3个月,实验组的ADL评分高于对照组,差异有统计学意义,P<0.05。见表3。
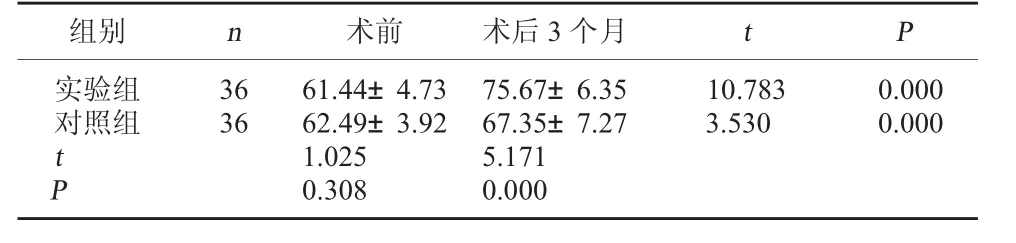
表3 两组的ADL评分比较(分,x±s)
3 讨论
据统计,颅内动脉瘤破裂出血后24 h的病死率约为20%,7 d内约为40%,1个月内约为50%[3]。颅内动脉瘤破裂后可并发蛛网膜下腔出血,引起颅内压升高、脑膜刺激征和头痛等症状,严重影响患者的生命健康。临床主张手术治疗颅内动脉瘤,主要包括开颅夹闭术和血管内介入栓塞术等。开颅夹闭术作为治疗颅内动脉瘤破裂的经典术式,可有效改善患者的临床症状,控制病情进展,但该术式创伤较大,易损伤脑组织及其周围组织,进而增加相关并发症的发生风险,降低手术安全性。相关研究显示,经开颅术治疗后的脑动脉瘤患者死亡率约为20%,给患者及其家属造成了巨大心理压力[4]。近年来,介入手术逐渐被应用于临床实际,并在脑动脉瘤的治疗中取得了一定疗效。徐江林等[5]的研究表明,采用血管介入栓塞术治疗脑动脉瘤患者,有效率为97.96%,并发症发生率为4.08%。由于血管内介入栓塞术无需直接接触颅内动脉瘤患者的脑组织,不仅能避免因脑组织损伤引起的神经功能缺损现象,而且可明显减少颅内感染、头痛和发热等并发症的发生情况[6]。
本研究结果显示,实验组的并发症发生率为5.56%,明显低于对照组27.78%,差异有统计学意义,P<0.05。其中对照组并发症发生率较高的原因在于术中需阻断瘤动脉,易导致脑血管破裂和脑动脉痉挛,加上术中存在不同程度的压迫和牵拉等操作,会损伤脑部组织,引起相关并发症。而经血管内介入栓塞术治疗脑动脉瘤,血管不易破裂,可有效减少血管破裂后引起的并发症,减少蛛网膜下腔出血现象。同时,其受脑水肿和颅内压等因素影响较少,可有效降低脑血管痉挛的发生,预防蛛网膜下腔出血引起的一系列病理变化[7]。此外,血管内介入栓塞术具有创伤小,术中出血量少等优势,利于患者术后恢复,对其日常生活能力及生活质量的改善具有重要的作用。本研究结果显示,术后3个月,实验组的GOS分级优良率为75.00%,高于对照组的52.78%,差异有统计学意义,P<0.05;实验组的ADL评分高于对照组,差异有统计学意义,P<0.05。可见血管介入栓塞术有助于提高颅内动脉瘤患者的日常生活能力,促进其预后。但临床中还需注意以下几点:术中动作轻柔,尤其是推动弹簧圈时;若术中出现脑动脉瘤破裂,需快速将导管内的弹簧圈推至瘤体内部,并选择适当的弹簧圈填塞瘤腔,以发挥止血效果。综上可知,采用血管内介入栓塞术治疗颅内动脉瘤患者,可降低并发症的发生率,提高其日常生活能力,改善预后。
[1]陈黛琪,张铭.动脉瘤性蛛网膜下腔出血导致症状性脑血管痉挛的危险因素分析[J].卒中与神经疾病,2015,22(4):243-245
[2]张扬,顾大群,晁迎九,等.血管内栓塞和开颅夹闭治疗急性期低级别破裂大脑中动脉瘤效果比较[J].介入放射学杂志,2016,25(1):7-10
[3]呼铁民,田甜,王昆鹏,等.开颅夹闭术与血管内介入动脉瘤栓塞术治疗中青年高危颅内动脉瘤破裂效果的比较研究[J].实用心脑肺血管病杂志,2015,23(7):81-84
[4]郭吉卫.血管内介入与传统开颅手术治疗颅内动脉瘤的临床比较[J].神经损伤与功能重建,2015,10(4):350-351
[5]徐江林,张宪哲,李永豪,等.血管内介入栓塞术与开颅夹闭术治疗脑动脉瘤临床对比研究[J].河北医药,2016,38(24):3755-3757
[6]游文良,张海涛,姚小峰,等.血管内栓塞和开颅夹闭术在颅内动脉瘤患者中的应用[J].局解手术学杂志,2016,25(5):367-369
[7]时雷.开颅夹闭与血管介入栓塞术治疗脑动脉瘤患者的临床观察[J].心脑血管病防治,2016,16(3):205-207

