红曲百合蜂蜜酒酿造工艺的优化
邓加聪,蒋素素,王诗瑶,王志辉 ,张文森,郑 虹
(1.福建师范大学福清分校海洋与生化工程学院,福建福清350300;2.食品软塑包装技术福建省高校工程研究中心,福建福清350300)
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,经充分酿造而成的天然甜物质[1]。它是一种高度复杂的糖类溶液,含有微量元素、氨基酸、蛋白质、有机酸、维生素、胶质物、蜂花粉和激素等[2],具有很高的营养价值和保健作用[3]。
百合是一种多年生宿根草本植物,而用百合酿造的酒是一种具有营养、保健、食疗等功能的新型饮品[4],现代医学研究发现,百合除含有蛋白质、脂肪、还原糖及矿物质外,还含有一些特殊的营养成分,如多种生物碱、糖苷、皂苷、酚酸甘油酯及丙酸酯衍生物等多种物质[5-6]。这些成分对人体不仅具有较好的滋补功效,而且还具有抗癌、抗疲劳、抗氧化、抗过敏等药理作用[7-10]。
红曲的主要活性成分为麦角甾醇、洛伐他汀、豆甾醇和莫纳克林[11-12]。这些活性物质具有降血糖、降血脂、降血压等功效,因此在酿酒的过程中添加红曲,使酒中溶入红曲所富含的多种活性物质,进而使酒有一定的营养和保健功能[13-14]。
蜂蜜酒是稀释后的蜂蜜经酵母菌发酵后酿制而成。蜂蜜中富含果糖,具有较高的渗透压,使微生物在此中难以生长繁殖[15-16]。稀释后的蜂蜜,糖分降低,适合酵母菌生长繁殖和发酵。目前蜂蜜酒产业成为地方产业发展、农民增收的一个特色传统产业项目。但就传统工艺而言,配方因人而异,加工设备简陋,家庭作坊式生产繁琐耗时,导致加工工艺不规范,工艺参数模糊。同时蜂蜜酒发酵过程中由于营养物的限制,存在发酵速度慢、酒精度低、残糖量高等问题,制约了蜂蜜酒的发展,为改善这一重大问题,本项目对蜂蜜酒酿造工艺进行研究与改造创新。
1 材料与方法
1.1 材料及试剂
蜂蜜,南平百花酒业有限公司;红曲,古田县力发曲业有限责任公司;百合干,市售;安琪酵母(耐高糖)、安琪酵母(黄酒专用)、生香酵母,安琪酵母股份有限公司;果胶酶(6000 U/mL)、黄酒澄清剂、磷酸二氢钾、硫酸铵、硫酸铜、次甲基蓝、酒石酸钾钠、亚铁氰化钾、盐酸、无水葡萄糖、氢氧化钠、甲基红等试剂均为分析纯,购自国药集团有限公司。
1.2 主要仪器
酒坛,市售;WYT-4手持式糖量计,泉州中友光学仪器有限公司;酒精计,上海科学仪器有限公司;PHS-3E酸度计,上海仪电科学仪器股份有限公司;FW100高速万能粉碎机,天津市泰斯特仪器有限公司;DK-98-(II)电子调温万能电炉,天津市泰斯特仪器有限公司;DHG-9076A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;SPX-150B-Z生化培养箱,厦门精益兴业科技有限公司;YP402N电子天平,上海精密科学仪器有限公司;蒸馏器等玻璃仪器,福州玻璃仪器有限公司。
1.3 百合酶解工艺条件的研究
1.3.1 百合酶解的工艺流程

1.3.2 操作要点
(1)百合干的预处理:选用无霉变、无虫蛀的百合干,粉碎机磨成粉末,60目过筛备用。
(2)酶解:取一定量百合干粉,用水溶解(百合干粉∶水=1∶20),用1 mol/L盐酸将pH值调至4.5±0.5,加果胶酶,50℃下酶解60 min。
(3)灭酶:将百合酶解浆液在100℃下保温3~5 min,灭酶活。
1.3.3 酶解工艺优化
(1)不同果胶酶添加量对百合酶解效果的影响准确称取5 g百合粉,加入100 mL的蒸馏水,经糊化、冷却,调酸至pH4.5±0.5,分别加入果胶酶(酶活活力为60 U/mL)1 mL、2 mL、3 mL、4 mL、5 mL、6 mL,于50℃下酶解60 min,灭酶后自然冷却至室温,用分光光度计测定并计算百合酶解浆液中皂苷的含量。每组试验做3个平行。
(2)不同温度对百合酶解效果的影响
准确称取5 g百合粉,加入100 mL的蒸馏水,经糊化、冷却,调酸至pH4.5±0.5,加入4 mL果胶酶(酶活活力为60 U/mL),不同温度(35℃、40℃、45℃、50℃、55℃、60℃)下酶解60 min,灭酶自然冷却至室温待测,测定后计算皂苷含量。每组试验做3个平行。
(3)不同酶解时间对百合酶解效果的影响
准确称取5 g百合粉,加入100 mL蒸馏水,经糊化、冷却,调酸至pH4.5±0.5,添加4 mL果胶酶(酶活活力为60U/mL),45℃下分别以30min、60min、90 min、120 min、150 min、180 min进行酶解,灭酶自然冷却至室温待测,测定后计算皂苷含量。每组试验做3个平行。
(4)3因素3水平试验优化酶解工艺
根据单因素试验结果,采用果胶酶的添加量、酶解温度、酶解时间作为考察因素,选用L9(34)正交表进行试验分析,测定吸光度后计算皂苷含量。百合酶解的因素和水平表见表1。

表1 百合酶解工艺的因素和水平
1.4 百合蜂蜜酒发酵工艺条件的研究
1.4.1 百合蜂蜜酒发酵的工艺流程

1.4.2 操作要点
(1)蜂蜜的稀释
按蜂蜜∶水=1∶4进行配比,添加20%百合酶解液,调配成糖度为25~26°Bx百合蜂蜜水溶液。
(2)加热灭菌
将调配好的百合蜂蜜水溶液于100℃下保温30 min,冷却至室温。
(3)酵母活化
称取一定量的安琪酵母接种于质量分数为3%的蜂蜜水,35~37℃活化培养1 h。
(4)菌种扩培
将活化后的酵母菌接种于新鲜的培养基,扩培4.5倍,当发酵液产生大量气泡时,扩培结束。
(5)接种
将扩培液与灭菌后的百合蜂蜜水在酒坛中混匀,并接入适量的红曲与百合酶解液。
(6)发酵
24~26℃发酵培养10~15 d。达到发酵终点时,75℃下保温10 min,冷却至室温。
(7)压榨过滤
发酵液用200目的尼龙绢布压榨过滤。
(8)澄清、过滤
压榨后的酒液中加入0.3%的黄酒专用澄清剂,混合均匀后静置沉淀12 h,上清液经硅藻土过滤至清亮透明。
(9)灌装、杀菌
酒液灌装封口后,80℃下保温30 min,杀菌后冷却至室温。
1.4.3 酿造工艺优化
(1)酵母菌种的选择对红曲百合蜂蜜酒品质的影响
3种酵母按以下3种不同组合:①生香酵母+安琪酵母(黄酒专用)、②安琪酵母(耐高糖)+生香酵母、③安琪酵母(耐高糖)+安琪酵母(黄酒专用)+生香酵母,接种于百合蜂蜜混合液,加入3%红曲,30℃发酵5 d。对发酵后的产品进行感官评价。
(2)初始糖度对红曲百合蜂蜜酒品质的影响
3种酵母混合,以0.6%接种量接种于不同初始糖度(20 °Bx、22 °Bx、24 °Bx、26 °Bx、28 °Bx、30 °Bx)的百合蜂蜜混合液,添加3%红曲。对发酵后的产品进行感官评分。
(3)百合酶解液添加量对红曲百合蜂蜜酒品质的影响
3种酵母混合,以0.6%接种量接种于初始糖度为26°Bx的不同量(10%、15%、20%、25%、30%、35%)的百合蜂蜜混合液,加入3%红曲。对发酵后的产品进行感官评分。
(4)酵母接种量对红曲百合蜂蜜酒品质的影响
3种酵母混合,以不同接种量(0.38%、0.41%、0.51%、0.55%、0.66%、0.74%)接种于初始糖度为26°Bx的25%的百合蜂蜜混合液,加入3%红曲。对发酵后的产品进行感官评分。
(5)红曲添加量对红曲百合蜂蜜酒品质的影响
3种酵母混合,以0.66%接种量接种于初始糖度为26°Bx的25%的百合蜂蜜混合液,加入不同量(1%、2%、3%、4%、5%、6%)的红曲。对发酵后的产品进行感官评分。
(6)正交试验优化红曲百合蜂蜜酒酿造工艺
根据单因素试验结果,采用蜂蜜水初始糖度、百合酶解液添加量、酵母接种量、红曲添加量作为考察因素,进行蜂蜜酒酿造的正交实验设计。因素和水平见表2。

表2 酿造工艺的因素和水平
1.5 分析方法
1.5.1 溶液中皂苷含量的测定
(1)D101树脂的预处理
称取50 g树脂浸泡在丙酮中,浸泡24 h,50℃水浴加热回流18 h,抽滤后丙酮冲洗,再用蒸馏水冲洗,最后与蒸馏水按1∶2混合,备用。
(2)层析柱的制备
采用湿法装柱(Ø:1 cm,D:15 cm),树脂高度为5 cm,之后覆盖少量脱脂棉,再加入0.2 g中性氧化铝,最后覆盖1层脱脂棉并压紧,备用。
(3)样品百合总皂苷含量的测定
称取2 mL百合皂苷提取液于10 mL容量瓶中,溶剂自然挥发后,用蒸馏水溶解并定容。取5 mL上述溶液,移入备用层析柱(流速控制在0.5 mL/min),用15 mL蒸馏水冲洗,洗去未吸附的杂质,再用30 mL 70%乙醇洗脱,收集洗脱液。测定并计算洗脱液中皂苷的含量[6,17]。
(4)标准曲线的制备
称取干燥后的人参皂苷Re标准品20 mg于5 mL容量瓶中,用甲醇溶解并定容。取5个10 mL具塞试管,分别加入30 μL、60 μL、90 μL、120 μL、150 μL的4 mg/mL人参皂苷Re,自然挥发除去甲醇,依次加入0.2 mL 5%香草醛冰醋酸溶液(现配现用)和0.8 mL高氯酸,混匀后,60℃水浴保温15 min,之后冰水冷却5 min,以不添加人参皂苷的试剂作为空白参比,552 nm处测定吸光度。以人参皂苷浓度(mg/mL)为横坐标,以OD值为纵坐标,绘制标准曲线。标准曲线见图1,得回归方程y=0.9749x-0.091,R²=0.9993。
1.5.2 可溶性物的含量测定

图1 人参皂苷标准曲线
采用手持式折光仪进行测定。
1.5.3 总糖的测定
按GB/T 13662—2008中6.2.2规定执行。
1.5.4 总酸的测定
按GB/T 13662—2008中6.6规定执行。
1.5.5 pH的测定
按GB/T 13662—2008中6.5规定执行。
1.5.6 酒精度的测定
按GB/T 13662—2008中6.4规定执行。
1.6 红曲百合蜂蜜酒感官评价的方法
根据红曲百合蜂蜜酒的色泽、气味、外观、口感进行感官评分,样品随机提供给10位经培训人员品尝和鉴定,红曲百合蜂蜜酒的感官评价标准见表3。
2 结果与分析
2.1 百合酶解工艺的研究

表3 红曲百合蜂蜜酒的感官评价标准
2.1.1 不同果胶酶的添加量对百合酶解效果的影响(图2)

图2 不同果胶酶添加量对百合浆液酶解效果的影响
由图2可知,随着果胶酶添加量的增加,糊化后的百合浆液中皂苷的含量也随之逐渐增加,表明果胶酶对百合浆液的酶解效果逐渐增强;当浆液中果胶酶添加量为240 U/mL时,百合浆液中皂苷的含量达到最高,为0.422 mg/mL,说明此时果胶酶对百合浆液的酶解效果最佳;之后,随着果胶酶添加量的增加,百合浆液的皂苷含量反而降低,表明果胶酶对百合浆液的酶解效果反而降低。当百合浆液中果胶酶的浓度过高,底物浓度过低,会造成酶的过量,同时添加过量的果胶酶,会产生异味,进而影响百合蜂蜜酒的口感。所以果胶酶的添加量取240 U/mL。
2.1.2 不同酶解温度对百合浆液酶解效果的影响(图3)

图3 不同酶解温度对百合酶解效果的影响
由图3可知,当酶解温度为35~45℃时,随着酶解温度的升高,百合浆液与果胶酶充分接触,百合浆液中皂苷总量逐渐增加,酶解效果逐渐增强;当酶解温度为45℃时,百合浆液的酶解效果最佳;当酶解温度超过45℃时,随着酶解温度的升高,百合浆液的酶解效果反而下降。所以确定酶解温度为45℃。
2.1.3 不同酶解时间对百合浆液酶解效果的影响(图4)
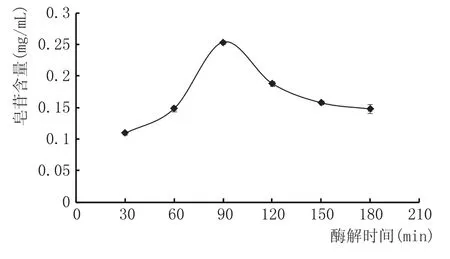
图4 不同的酶解时间对百合酶解效果的影响
由图4可知,随着酶解时间的增加,百合酶解浆液的皂苷含量先增加后缓慢下降。是因为随着酶解时间的延长,糊化好的百合浆液逐渐被酶解;当酶解时间达到90 min时,百合浆液中的底物酶解完全;之后随着酶解时间的延长,百合浆液中的酶解效果反而降低。因此确定酶解时间为90 min。
2.1.4 3因素完全试验优化酶解工艺
根据单因素试验结果,选用L9(34)正交表进行正交设计,结果见表4、表5。
由表4、表5的实验数据可知,酶解温度对百合浆液酶解过程的影响最大,其次是果胶酶添加量,而酶解时间的影响最小;即各因素对百合酶解效果影响主次顺序为果胶酶的添加量>酶解温度>酶解时间。同时得到百合浆液酶解的最佳组合为A2B2C2,即果胶酶的添加量为240 U/mL,酶解温度为45℃,酶解时间为90 min(由于该处理组合不在正交试验组合中,所以需进行验证性实验)。A、B、C 3个因素的F值均大于F0.01,表明3个因素对百合浆液酶解效果的影响均达到极显著水平。
2.1.5 验证性实验
正交试验结果的最佳组合A2B2C2和正交试验结果表中的皂苷总量最高的试验组合A2B1C2,分别做3组平行试验,测定皂苷含量,以百合酶解浆液的皂苷总量为指标,取平均值。结果发现,组合A2B2C2和组合A2B1C2的百合酶解浆液的皂苷含量分别为1.674 mg/mL和1.645 mg/mL,试验组合为A2B2C2的百合酶解浆液的皂苷总量较高,而且从经济效益方面考虑,此试验组合的可行性较好。因此,百合酶解的最佳试验组合为A2B2C2,即果胶酶的添加量240 U/mL、酶解温度为45℃、酶解时间90 min。
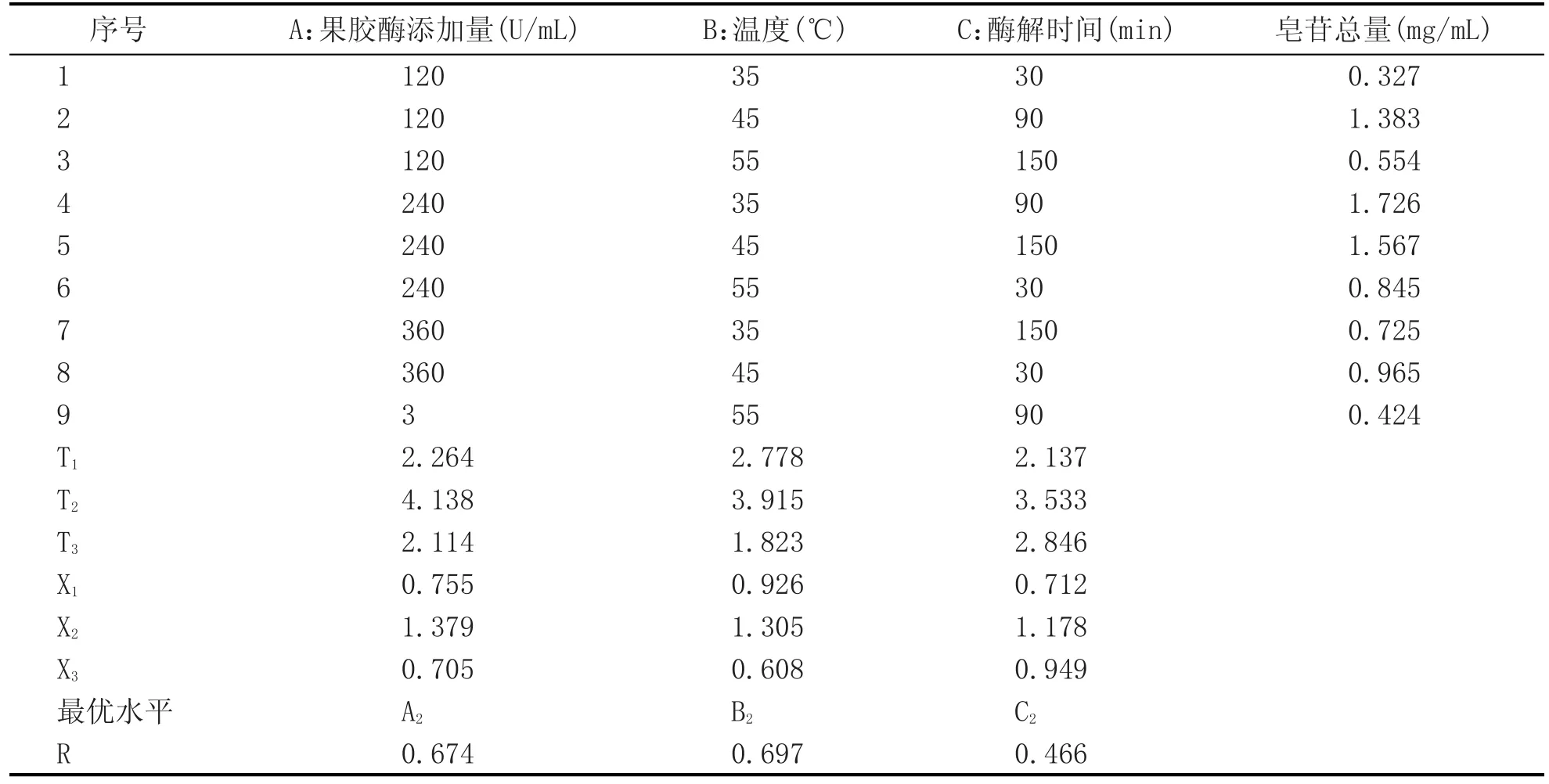
表4 酶解工艺正交试验的直观分析表

表5 百合酶解工艺正交试验方差分析表
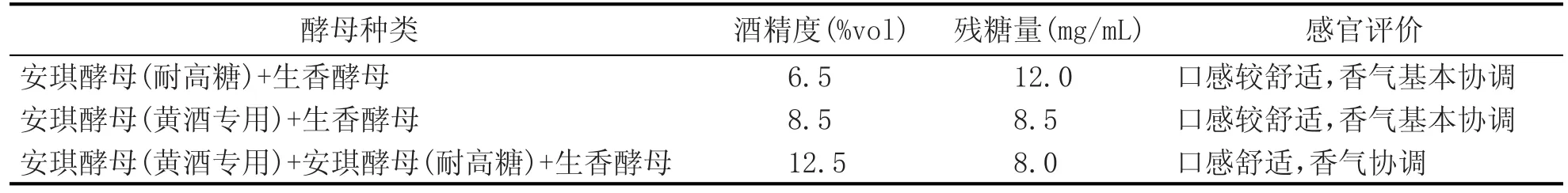
表6 不同酵母菌种对红曲百合蜂蜜酒品质的影响
2.2 红曲百合蜂蜜酒酿造工艺的优化
2.2.1 酵母菌种对红曲百合蜂蜜酒品质的影响
3种酵母的不同组合对红曲百合蜂蜜酒的影响结果见表6。
由表6可知,在3个菌种混合发酵条件下,酒的口味舒适、香气协调,在同水平试验中为最佳,因此较优的发酵菌种为3个菌种混合。
2.2.2 初始糖度对红曲百合蜂蜜酒品质的影响
在3%红曲添加量,3个菌种混合条件下,采用不同百合蜂蜜混合液初始糖度进行发酵,对发酵后的产品进行感官评分,结果见表7。
由表7可知,随着起始糖度的加大,残糖增多,得到的蜂蜜酒酒精度增高,初始糖度太高抑制酵母的生长代谢,并且残糖比较高,酒体浑浊。综上分析结果,确定最佳蜂蜜水起始糖度为26°Bx。
2.2.3 百合酶解液添加量对红曲百合蜂蜜酒品质的影响
以蜂蜜水起始糖度为26°Bx、3%红曲添加量、混合酵母菌接种量0.8%,采用不同百合酶解液添加量进行发酵,对发酵后的产品进行感官评分,结果见表8。
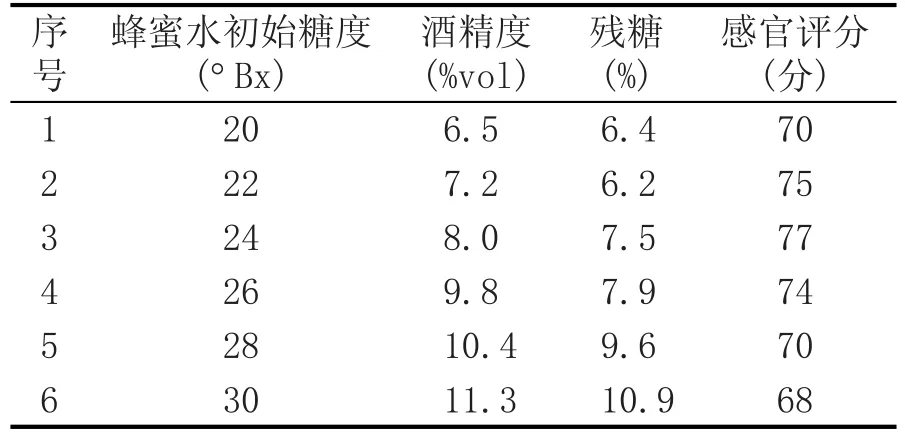
表7 初始糖浓度对百合蜂蜜酒的品质影响
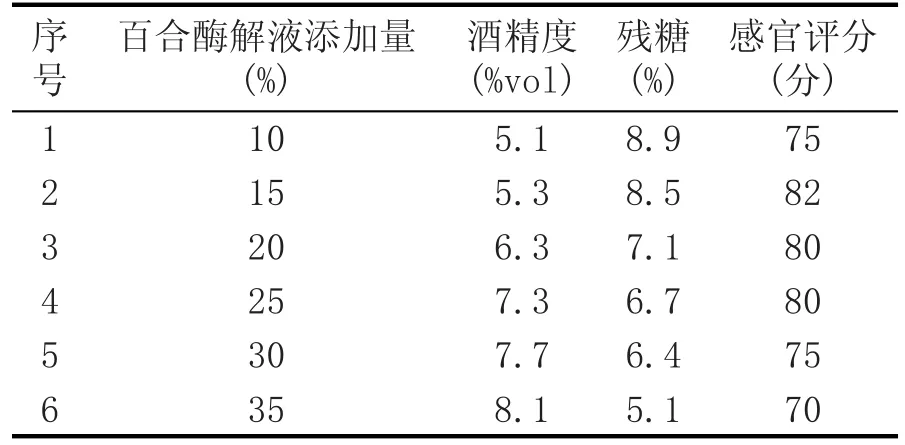
表8 不同百合酶解液添加量对百合蜂蜜酒品质的影响
由表8可知,随着百合酶解液添加量的增大,残糖减少,得到的蜂蜜酒酒精度增高。采用25%~35%百合酶解液添加量时,虽然酒精度较高,残糖却较低,酒体感官品质下降。综上分析,确定发酵的最佳百合酶解液添加量为25%。
2.2.4 酵母接种量对红曲百合蜂蜜酒品质的影响
以蜂蜜水起始糖度为26°Bx、3%红曲添加量、百合酶解液添加量为25%,使用不同的酵母接种量对蜂蜜百合酶解液进行发酵,对产品进行感官评分,结果见表9。

表9 不同酵母接种量对百合蜂蜜酒品质的影响
由表9可知,随着酵母接种量的增大,残糖减少,得到的蜂蜜酒酒精度增高。采用0.74%接种量时,虽然酒精度较高,残糖也较低,但其酒体感官品质下降。综合以上分析结果,确定发酵的酵母最佳接种量为0.66%。
2.2.5 红曲添加量对红曲百合蜂蜜酒品质的影响
以蜂蜜水起始糖度为26°Bx、酵母接种量为0.66%、百合酶解液添加量为25%,采用不同的红曲添加量,对产品进行感官评分,结果见表10。
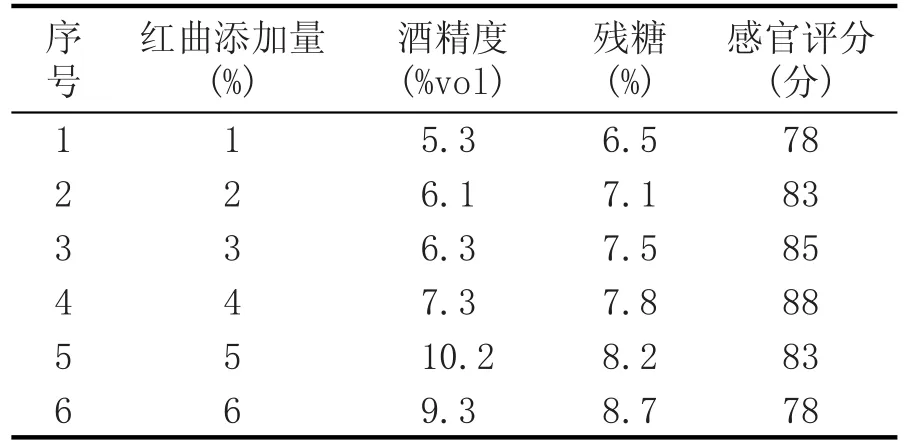
表10 不同红曲添加量对百合蜂蜜酒品质的影响
由表10可知,随着红曲添加量的加大,发酵速度过快,大于糖化速度,酒精度增高,但残糖增大。红曲添加量比较大,会抑制酵母菌的生长代谢,并且糖度较高,酒体偏浑浊。综上分析,确定最佳红曲添加量为4%。
2.2.6 正交试验优化红曲百合蜂蜜酒酿造工艺
根据单因素试验的结果,以蜂蜜水初始糖度、百合酶解液添加量、酵母接种量、红曲添加量作为考察因素,对红曲百合蜂蜜酒的酿造工艺进行优化实验。结果及分析见表11、表12。
由表11、表12可看出,通过正交分析,影响产品感官品质的各因素的主次顺序为C>B>A>D,即酵母接种量>百合酶解液添加量>蜂蜜水初始糖度>红曲添加量;同时得到较佳的酿造工艺组合为A3B3C3D2,即蜂蜜水初始糖度(A)为26 °Bx,蜂蜜百合酶解液添加量(B)为25%,酵母接种量(C)为0.66%,红曲添加量(D)为4%;置信度为95%,4个因素对感官评价的影响均达到极显著效果。
采用正交试验结果的最佳组合A3B3C3D2和正交试验结果表中的评分最高的试验组合A3B1C3D2进行验证实验。结果发现,组合A3B3C3D2和组合A3B1C3D2的感官评分分别为89分和 87分,且A3B3C3D2酒体丰满、清亮透明、光泽度好,口感醇厚细腻,各结果均表明组合A3B3C3D2的效果更佳。
最后以3 L投料按照组合A3B3C3D2进行3个批次的验证试验,对产品的酒精度、糖含量及最终pH值进行检测,并与标准产品要求进行比较。结果见表13。

表11 酿造工艺优化正交试验结果分析表

表12 酿造工艺对感官评价影响的方差分析表

表13 验证试验结果测定
表13结果表明,3批次的产品各项指标均符合要求。所以最终确定最佳工艺为A3B3C3D2即蜂蜜水初始糖度(A)为26°Bx,蜂蜜百合酶解液添加量(B)为25%,酵母接种量(C)为0.66%,红曲添加量(D)为4%。
3 结论
3.1 百合酶解正交试验结果表明,最优酶解工艺条件组合为A2B2C2,即果胶酶的添加量240 U/mL、酶解温度为45℃、酶解时间90 min。
3.2 通过正交试验确定红曲百合蜂蜜酒的最优酿造工艺条件为:A3B3C3D2,即蜂蜜水初始糖度(A)为26°Bx,蜂蜜百合酶解液添加量(B)为25%,酵母接种量(C)为0.66%,红曲添加量(D)为4%,在此条件下,生产的红曲百合蜂蜜酒酒体丰满、清亮透明、光泽度好,口感醇厚细腻,感官评分为89分。
3.3 对最佳酿造工艺组合进行验证实验,表明该工艺合理可行。所得的产品纯正柔和,各理化指标:酒精度为13.0%vol、糖度为12.0 g/L、pH3.2,均符合发酵饮料的标准,适合于批量化生产。结合当前的农业现状,红曲百合蜂蜜酒具有广阔的应用前景。
[1]谭洪波,王光新,张红城,等.蜂蜜的营养成分及其功能活性研究进展[J].蜜蜂杂志,2016,36(7):12-15.
[2]吴国泰,武玉鹏,牛亭惠,等.蜂蜜的化学、药理及应用研究概况[J].蜂蜜杂志,2017,37(1):3-6.
[3]孙政,程妮,曹炜.蜂蜜中氨基酸应用研究进展[J].食品与发酵工业,2016,42(1):260-263.
[4]慕钰文,张建龙,武洋,等.百合蜂蜜果酒的研制[J].甘肃农业,2008(10):84-86.
[5]于健华.青岛百合的资源调查、成分分析和组织快繁研究[D].青岛:青岛大学,2013:1-55.
[6]傅春燕,刘永辉,李明娟,等.百合总皂苷提取工艺及抗抑郁活性研究[J].天然产物研究与开发,2012,24(5):682-686.
[7]郭利红,姚华强,康震.百合地黄汤治疗更年期抑郁症的临床疗效及对神经内分泌系统的影响[J].中医药导报,2016,22(8):70-72.
[8]吴晓斌,任凤莲,邱昌桂,等.百合皂苷的提取、纯化及其对自由基的清除作用[J].天然产物研究与开发,2005,17(6):777-780.
[9]PETER J T,BRENDAN A N,LARRY R B.Inhibitory activity of honey against foodborne pathogens as influenced by the presense of hydrogen peroxide and level of antioxidant power[J].International joumal of food microbiology,2001,69:217-225.
[10]RODERICK J.WESTON K R M,KERRY LA.Antibacterial phenolic components of New Zealand manuka honey[J].Food chemistry,1999,64:295-301.
[11]贾氏臣,孟金明,穆红霞,等.红曲菌发酵产物中的新功能性成分及功效的研究进展[J].中国食品添加剂,2015(4):179-184.
[12]王玲,吴军林,吴清平.红曲降血脂功能的研究及应用概况[J].食品工业科技,2014,35(8):387-390.
[13]郭晓旭,王强,李国莹,等.红曲枸杞酒发酵工艺优化研究[J].酿酒科技,2014(5):79-82.
[14]牛小明.红曲蜂蜜酒生产工艺研究[J].中国酿造,2011(3):165-167.
[15]李从军,谢爱娣.发酵型桂花蜂蜜酒的酿造工艺研究[J].中国酿造,2017(7):187-192.
[16]孙洪浩,朱正军,张玉,等.蜂蜜酒酿造工艺研究[J].食品工业科技,2015,36(7):257-261.
[17]周秀玲,李家敏.不同品种百合中多糖和皂苷含量的测定[J].江苏农业科学,2011,39(5):432-433.

