催产素多重镇痛效应的研究现状*
周 倩 李迪森 孙武平,2 陈 盼 廖宇良 蒋昌宇,2△ 肖礼祖,2△
(1广东医科大学附属深圳第六医院疼痛科,深圳518000;2 深圳市南山医院韩济生院士疼痛医学工作站,深圳518000)
疼痛是由损伤或潜在的组织损伤引起的一种不愉快的感觉和情绪体验[1]。它是一把双刃剑,急性疼痛能提示身体已发生或潜在的损伤,从而起到一个预警作用。慢性疼痛为持续大于3个月的疼痛[2],一旦急性疼痛转变为慢性疼痛,对病人的身体、心理甚至经济都造成巨大的影响。目前,急性疼痛用阿片类药物或消炎镇痛药物可以取得比较好的效果,但对慢性疼痛的管理却还不理想。 除此之外,情绪在疼痛中也扮演至关重要的角色,而焦虑和抑郁往往伴随着慢性疼痛,增加疼痛体验[3],使问题更加严重。所以人们在寻找慢性疼痛治疗药物的过程中更倾向于既具有镇痛又有抗焦虑抑郁效果的药物。随着研究的深入,人们发现催产素除了其经典的生理功能以外,还在社会行为学、共情以及抗抑郁与焦虑方面发挥着重要的作用[4], 而且越来越多的基础实验表明催产素具有良好的镇痛效果[5],此外催产素还因为具有使用安全和增加安慰剂止痛效果的特性, 使之在镇痛药物的研发方面具有巨大的潜在价值。
催产素是一种九肽神经激素,主要由哺乳动物下丘脑视上核及室旁核所分泌。 过去主要认为催产素从下丘脑的核团中转运至垂体后叶,由此释放进入外周循环,在外周催产素发挥它在生产中的经典功能。近年来人们发现,催产素能被转运到海马、杏仁核、下丘脑和伏隔核及脊髓背角从而发挥它的神经递质的功能[6]。由于杏仁核及脊髓背角在情绪及疼痛的调节中起到重要作用,而催产素的受体在这些地方也有表达,这都提示,催产素及其受体在疼痛信息传导的过程、社会行为学以及情感方面均可能发挥着重要的调节作用[7]。正因如此,催产素及其受体在疼痛方面的研究也得到越来越多的关注,本文就催产素的多重镇痛效果进行探讨。
1.催产素镇痛的解剖学基础
室旁核不仅能合成分泌催产素,还能发出催产素能的直接投射,与中枢神经系统内的脊髓后角浅层、海马、伏隔核以及杏仁核等结构形成突触连接,起到调节突触传递的功能[8]。
(1)催产素受体
催产素受体属于 G 蛋白偶联的受体 (G protein coupled receptor, GPCR),它在雌性与雄性成年大鼠的中枢神经系统的分布均十分广泛,比如在下丘脑腹内侧核、杏仁核和脊髓后角浅层各个节段等处均有催产素受体的分布[9]。最近也有文献表明催产素受体在CGRP标记的C纤维上表达并能够抑制伤害信号传导至脊髓后角[10]。我们曾报道催产素受体被激活后主要作用于Gq/11蛋白,释放PLC,从而激活IP3,进一步释放钙库,增加细胞内钙离子浓度,抑制细胞内钾离子外流[11],同时催产素也可以通过Gs、Gi蛋白发挥相应的作用(见图1)。也有报道称催产素的镇痛作用是通过vasopressin-1A受体发挥其镇痛作用[12],而且催产素和血管加压缩可能相互作用于对方的受体。由于目前缺乏催产素受体特异性抗体,使得催产素在慢性疼痛中的变化情况研究较少,其机制仍需我们进一步研究。
(2)催产素受体在脊髓后角浅层(即后角Ⅰ层和Ⅱ层)分布特别密集,而脊髓后角浅层是疼痛信息的初级整合中枢,它即接受来自外周细小纤维(Aδ和C纤维)的投射也接受来自中脑的下行性传导通路的投射,这些投射与后角浅层Ⅰ层的投射神经元或Ⅱ层的中间神经元形成突触并调节疼痛信息的传导[13]。
(3)下丘脑腹内侧核主要接受感觉纤维的投射,并将信息整合后朝思暮想大脑皮层感觉去投射,是大脑对感觉处理的重要组成部分。杏仁核主要在海马的末端,属于边缘系统,主要是产生情绪,识别情绪和调节情绪,控制学习和记忆的脑部组织。正如我们前文所提到的疼痛处理自身的感觉传导外,和情绪也密切相关,而催产素受体在这些部位均有分布,这也为催产素的多重镇痛提供了理论依据。除此之外,有研究发现在成年大鼠的脊髓后角浅层催产素受体的表达没有性别差异[14]。
2.催产素的直接镇痛作用
很多试验均证明了催产素对疼痛信息的传导有调节作用,最近的一项关于催产素的系统回顾和综合分析也提出了催产素是一个有潜力的镇痛剂[15]。在一些人体和动物上研究催产的实验和病例报告中,大部分的研究者均提出催产素能降低伤害性刺激的敏感性。即使如此,催产素依然没有被运用于临床镇痛中去,主要是因为其镇痛机理依然不够明确,这也有待于科研人员进一步对其进行探索。
(1)关于催产素镇痛效应的动物实验研究
来自动物模型的研究证明催产素的镇痛效果的可靠性是最高的。Rash等人的一篇系统回顾与综合分析报道了33个动物模型中有29个均对催产素对急性痛的镇痛效果提示了很强的证据支持(Cohen' s d = 2.28)。催产素对很多不同的急性痛的痛觉刺激均表现出了镇痛效果,如:电刺激、机械刺激、热刺激、化学刺激或混合性刺激。催产素的镇痛效果在给药20~30 min时效果最强,而其效果大约可以维持一个小时[14]。值得注意的是上述的研究主要是针对急性的实验室疼痛的研究,而不是慢性疼痛模型。近期有一项研究表明,催产素能够缓解结扎大鼠眶下神经引起的三叉神经痛[12],这项研究也说明了催产素对慢性疼痛也有良好的镇痛效果。Brown 和 Perkowski在一项研究中发现患有慢性疼痛的狗的脑脊液中催产素的浓度比正常狗有显著的升高[16]。他们同时指出内源性疼痛的调节可以增加脑脊液中催产素的浓度,由此推断鞘内注射催产素能够起到镇痛的作用。
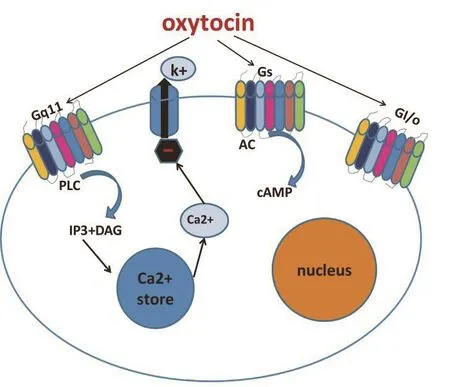
图1 催产素的细胞内途径:催产素主要作用于Gq蛋白释放PLC,从而激活IP3,进一步释放钙库,使得细胞内钙离子浓度升高,抑制钾离子外流。缩写:Gq11: G protein11; PLC:Phospholipase C; IP3: Inositol- 1,4,5-trisphosphate; DAG: Diacyl Glycerol; AC:Adenylate Cyclase; cAMP:cyclic adenosine monophosphate
(2)关于催产素镇痛的人体学研究
尽管在动物中催产素的研究很多了,但是在人类身上我们并没有做很多的研究,表1是近年来一些关于人体对比试验的总结。这些研究结果也是不太一致的。有些研究发现,催产素对实验室疼痛中的正常对照组并没有镇痛效果[17],但是有其他的研究发现注射催产素后有镇痛效果[18~20]。这些结果的差异可能有以下几个原因导致:①样本量的大小不一;②病人的入选标准不一(如:只选取了某一个性别的病人);③疼痛刺激的性质不一(如:实验室疼痛或慢性疼痛的不同进展期);④给药方式不一(如:鞘内给药、静脉给药、鼻息给药);⑤疼痛的部位及类型不一(如:腰背痛、偏头痛、纤维肌痛等)。
健康人群中催产素镇痛效果研究:Rash 和Campbell在一项随机对照双盲的实验中选取了健康志愿者进行经鼻吸入催产素后进行冷加压的测试[21]。他们报道了相对于安慰剂组,催产素组人员的痛阈明显升高。而在另外一项研究中,研究者表明鼻吸催产素相对于安慰剂组并不能减少电刺激引起的不适感[17]。
临床研究中催产素的镇痛效果研究:对于催产素是否能对不同的慢性疼痛产生镇痛效果,目前的研究说法不一(见表1)。一些研究认为对于那些已经治疗过去、但是仍然存在疼痛感的一些慢性疼痛疾病,给予催产素后能够降低疼痛。这些急性或慢性的腰背痛病人、紧张性头痛或偏头痛病人、长期便秘的病人在鼻吸或鞘内给予了催产素后均表示疼痛程度或不适感有明显的降低。然而在一项关于患纤维肌痛综合征的女性受试者中连续鼻吸催产素14天的研究者,并没有发现催产素有明显的镇痛效果[22]。1996年Louvel报道了肠易激的病人中静脉给催产素能够升高结肠管腔膨胀引起的不适感的阈值[18]。他们同时报道了静脉给催产素后,管腔膨胀引起不适的阈值。
3.催产素的间接镇痛效应
(1)催产素能够调节情绪
正如前文所述,情绪在疼痛的体验及调节中发挥重要的作用。 有试验研究表明,不同的情绪状态能都被诱导出来(如:展示一系列不同的情绪反应图片例如色情的或暴力的图像),而且情绪状态与伤害性刺激引起的疼痛感受及认知的变化相关联。研究发现激活积极的情绪主要可以抑制感觉传导纤维,但并不能抑制痛觉纤维[24]。然而激活消极情绪对疼痛的影响复杂的多,尽管恐惧情绪能够抑制疼痛感受,但是焦虑状态却能够增加疼痛感受[3]。此外还有研究表明,催产素能够减轻焦虑状态[25],进一步为催产素能够减轻疼痛的强度及感受提供证据。

表1 临床上外源性催产素的镇痛效果研究
(2)催产素能够影响社会行为
临床试验及实验室的实验均可证明疼痛的感知可以被社会行为支持所调节[26]。在临床上,在生产过程中,社会行为的支持能够降低疼痛的程度;同时社会行为的支持能够减少镇痛药物的使用及疼痛的强度[27]。在实验室条件控制下,相对于没有社会支持的参与者,那些无论是主动或是被动得到朋友或陌生人积极鼓励社会行为支持的参与者表现出更低的疼痛感受,即使他们只是简单的看到了一张同伴的照片[28]。另一方面,社会排斥能够增加有害热刺激所产生的不愉快的感受。众所周知,催产素能够激发满足、平静、安全感等感觉。而这些些研究结果表明催产素通过抑制大脑中控制恐惧及焦虑的部分及行为调节来减轻疼痛的感受。同时也有研究表明催产素也将成为孤独症的治疗上的新手段[29]。因此我们在社会行为支持下看到的镇痛效果,在某些程度上与催产素广泛的作用分不开关系。
(3)催产素能够增加安慰剂镇痛效应
安慰剂镇痛效应(安慰剂效应)是指给予了无效的药物或治疗反而出现了疼痛感受降低的效应。有研究表明通过鼻息催产素可以增加信任、减少焦虑从而减轻社交行为恐惧[30]。2013年,Kessner发现通过鼻息给催产素可以增加安慰剂的镇痛效应[31]。还有研究者认为这些发现和催产素的移情、增加信任及社会学习有关[32]。而这些移情作用及积极的影响均可以带来安慰剂效应。
4.催产素的应用安全性问题及未来的发展方向
催产素作为一个潜在的镇痛药物得到越来越多的人的关注,然而就像任何一种临床药物一样,其应用安全性必须得到审查。法律上也要求必须严格监控及记录药物的副作用及病人的主观感受来确保病人的安全。在近期的一项系统回顾中,MacDonald回顾了从1990年到2010年期间38项观察经鼻吸入催产素中枢效应的随机对照试验[33]。这项回顾包含了超过1500名参与者,18%的研究报道了经鼻吸入催产素后有轻微的副作用。
这些不良反应主要包含以下几种类型:①轻微的镇静、兴奋;②轻度的头昏、头晕或头痛;③鼻腔过敏、口干或喉干。 然而,有一项1:1配对研究报道了催产素组与安慰剂组的参与者出现了相关联的副作用反应(rs = 0.903, P < 0.001),表明了副作用可能是由于给药方式引起的,而不是药物的活性成分造成的。这38项研究中有28项研究调查了参与者的主观感受(如:询问参与者是否知道他们接受的示催产素还是安慰剂),其中93% 的参与者并不能辨别出来。由此得出催产素相对于安慰剂会导致轻微的、不易察觉的副作用,所以说鼻吸催产素对于健康人和成年病人来说是一种安全的给药方式。然而更高剂量的和更长时程的研究仍需进一步的研究,特别是在那些联合用药及儿童中的研究[33]。
从目前的研究来看,催产素运用到临床中仍然存在着一些问题: ①给药方式:是实验室及临床中,研究者们探索了多种给药方式,主要包括:静脉给药、鼻吸给药以及鞘内给药。上文已经提到催产素作用于中枢时主要发挥镇痛作用。目前鼻吸给药已被证实能够增加中枢及外周催产素浓度,从而达到镇痛及情绪调节等作用[34],但目前其机制尚不明确。而静脉给药主要应用于生产过程中。此外催产素在外周对不同性别的作用也不尽相同,我们在应用催产素的过程中也应考虑性别差异。正是因为目前临床给药途径的纷杂,不同的给药途径带来不同的效应,我们更应该探索简便易行、安全有效及规范的给药方式。②给药剂量:目前研究上给药浓度因给药方式的差异跨度很大,就是同一种给药方式也有多种浓度,如:鼻内给药浓度从0.02 Iu到80 Iu、鞘内给药0.1 μg/kg到1.6 μg/kg(见表1)均有应用过。这些不同的浓度带来的效应及副作用还有待研究,而且这些均是单次给药得出的结果,长期给药尚无太多研究,未来应该探索出一个安全有效的剂量。③正如文章提到的催产素不仅有镇痛的作用,还在情绪调节、社会行为学、增加安慰剂效应等方面具有良好的作用,在应用催产素某一方面作用时也不能忽略其他的作用。
总之,鉴于催产素良好应用前景,我们在应用于临床之前应行更多的临床前研究及机制研究,为更好的应用于临床服务。
[1] Loeser JD, Treede RD. The Kyoto protocol of IASP Basic Pain Terminology. Pain, 2008, 137(3): 473 ~ 477.
[2] Gatchel RJ, Peng YB,et al . P. N. Fuchs and D. C.Turk (2007). "The biopsychosocial approach to chronic pain: scientific advances and future directions." Psychol Bull, 2007, 133(4): 581 ~ 624.
[3] Rhudy JL, Meagher MW. Fear and anxiety: divergent effects on human pain thresholds. Pain, 2000, 84(1):65 ~ 75.
[4] MarlinBJ. Oxytocin enables maternal behaviour by balancing cortical inhibition. Nature, 2015, 520(7548):499 ~ 504.
[5] Goodin BR, Ness TJ, Robbins MT. Oxytocin-a multifunctional analgesic for chronic deep tissue pain.Curr Pharm Des, 2015, 21(7): 906 ~ 913.
[6] Gimpl G, Fahrenholz F. The oxytocin receptor system:structure, function, and regulation. Physiol Rev, 2001,81(2): 629 ~ 683.
[7] Marlin BJ, Mitre M, D' Amour JA, et al. Oxytocin enables maternal behaviour by balancing cortical inhibition. Nature, 2015, 520(7548): 499 ~ 504.
[8] Tracy LM, Georgiou-Karistianis N, Gibson SJ, et al.Oxytocin and the modulation of pain experience:Implications for chronic pain management. Neurosci Biobehav Rev, 2015, 55: 53 ~ 67.
[9] Moreno-Lopez Y, Martinez-Lorenzana G. Identification of oxytocin receptor in the dorsal horn and nociceptive dorsal root ganglion neurons. Neuropeptides, 2013,47(2): 117 ~ 123
[10] Gonzalez-Hernandez A, Manzano-Garcia A. "Peripheral oxytocin receptors inhibit the nociceptive input signal to spinal dorsal horn wide dynamic range neurons."Pain, 2017.
[11] Jiang CY, Fujita T, Kumamoto E. Synaptic modulation and inward current produced by oxytocin in substantia gelatinosa neurons of adult rat spinal cord slices. J Neurophysiol, 2014, 111(5): 991 ~ 1007.
[12] Kubo A, Shinoda M, Katagiri A, et al. "Oxytocin alleviates orofacial mechanical hypersensitivity associated with infraorbital nerve injury through vasopressin-1A receptors of the rat trigeminal ganglia." Pain, 2017,158(4): 649 ~ 659.
[13] 王群,吕岩. 疼痛特异性学说与闸门控制学说:争论还在持续. 中国疼痛医学杂志, 2014, 20(9): 609 ~613.
[14] Dumais KM, Veenema AH. Vasopressin and oxytocin receptor systems in the brain: Sex differences and sex-specific regulation of social behavior. Front Neuroendocrinol, 2016, 40: 1 ~ 23.
[15] Rash JA, Aguirre-Camacho A, Campbell TS. Oxytocin and pain: a systematic review and synthesis of findings.Clin J Pain, 2014, 30(5): 453 ~ 462.
[16] Brown DC, Perkowski S. Oxytocin content of the cerebrospinal fluid of dogs and its relationship to pain induced by spinal cord compression. Vet Surg, 1998,27(6): 607 ~ 611.
[17] Singer T, Snozzi R, Bird G, et al. Effects of oxytocin and prosocial behavior on brain responses to direct and vicariously experienced pain. Emotion, 2008. 8(6): p.781 ~ 791.
[18] Louvel D, Delvaux M, Felez A, et al. Oxytocin increases thresholds of colonic visceral perception in patients with irritable bowel syndrome. Gut, 1996,39(5): 741 ~ 747.
[19] Wang YL, Yuan Y, Yang J, et al. The interaction between the oxytocin and pain modulation in headache patients. Neuropeptides, 2013, 47(2): 93 ~ 97.
[20] Yang J. Intrathecal administration of oxytocin induces analgesia in low back pain involving the endogenous opiate peptide system. Spine (Phila Pa 1976), 1994,19(8): 867 ~ 871.
[21] Rash JA, Campbell TS. The effect of intranasal oxytocin administration on acute cold pressor pain: a placebo-controlled, double-blind, within-participants crossover investigation. Psychosom Med, 2014, 76(6):422 ~ 429.
[22] Mameli S, Pisanu GM, Sardo S, et al. Oxytocin nasal spray in fibromyalgic patients. Rheumatol Int, 2014,34(8): 1047 ~ 1052.
[23] Zunhammer M, Geis SBusch V. Effects of intranasal oxytocin on thermal pain in healthy men: a randomized functional magnetic resonance imaging study.Psychosom Med, 2015, 77(2): 156 ~ 166.
[24] Villemure C, Slotnick BM, a Bushnell MC. Effects of odors on pain perception: deciphering the roles of emotion and attention. Pain, 2003, 106(1-2): 101 ~ 108.[25] de Oliveira DC, Zuardi AW, Graeff FG, et al. Anxiolyticlike effect of oxytocin in the simulated public speaking test. J Psychopharmacol, 2012, 26(4): 497 ~504.
[26] Wiech K, aTracey I. Pain, decisions, and actions: a motivational perspective. Front Neurosci, 2013, 7: 46.
[27] HodnettED, Gates S, Hofmeyr GJ, et al. Continuous support for women during childbirth. Cochrane Database Syst Rev, 2012, 10: Cd003766.
[28] Master SL, Eisenberger NI, Taylor SE, et al. A picture' s worth: partner photographs reduce experimentally induced pain. Psychol Sci, 2009, 20(11): 1316 ~ 1318.
[29] 张嵘, 徐新杰, 韩济生. 催产素在孤独症患者社交障碍中的作用及治疗潜能. 中国心理卫生杂志, 2011, 6:464 ~ 467.
[30] Declerck CH, Boone C, Kiyonari T. Oxytocin and cooperation under conditions of uncertainty: the modulating role of incentives and social information.Horm Behav, 2010, 57(3): 368 ~ 374.
[31] Kessner S, Sprenger C, Wrobel N, et al. Effect of oxytocin on placebo analgesia: a randomized study.Jama, 2013, 310(16): 1733 ~ 1735.
[32] Meyer-Lindenberg A, Domes G, Kirsch P, et al.Oxytocin and vasopressin in the human brain: social neuropeptides for translational medicine. Nat Rev Neurosci, 2011, 12(9): 524 ~ 538.
[33] MacDonald E, Dadds MR, Brennan JL, et al. A review of safety, side-effects and subjective reactions to intranasal oxytocin in human research. Psychoneuroendocrinology, 2011, 36(8): 1114 ~ 1126.
[34] Dal Monte O, Noble PL, Turchi J, et al. CSF and blood oxytocin concentration changes following intranasal delivery in macaque. PLoS One, 2014, 9(8): e103677.

