JNK抑制剂对福尔马林内脏炎症痛大鼠痛觉敏感化的影响*
张家君 岳 伟 张灿文 胡冬梅 袁 慧 杨明峰 牛敬忠 张颜波△
(1泰山医学院附属医院超声科,泰安271000;2泰山医学院附属医院消化科,泰安,271000;3泰山医学院附属医院神经内科,泰安 271000)
与躯体痛比较,内脏炎症痛缺少特异、有效的治疗药物,所以探索、研发新型、有效的内脏炎症痛镇痛药物迫在眉睫[1]。痛觉敏感化包括痛觉过敏和痛觉异常等,影响着内脏炎症痛的形成和维持,在痛觉调制中发挥重要作用,是内脏炎症痛关键发病机制[2,3],众多神经递质、通道和受体等信号通路参与内脏炎症痛痛觉调制过程,导致内脏炎症痛“痛觉敏感化”。痛觉敏感化将是内脏炎症痛新型镇痛药物的研发方向[1,4]。MAPKs通路包括MAPKERK通路、MAPKJNK通路、MAPKP38通路和MKK5/MAPKERK5 共4条通路,研究发现脊神经节神经元内P38、ERK激活,参与内脏痛形成与维持的痛觉调制过程;与ERK、P38激活通路相比,JNK作为一种应激激活的蛋白激酶在病理性痛觉敏感化中研究相对较少,在内脏炎症痛觉敏感化中的作用研究更少[5~7]。故本实验拟用福尔马林直肠粘膜下复制内脏炎症痛模型[8],经脊髓蛛网膜下腔插管给予JNK抑制剂SP600125,观察JNK抑制剂对内脏炎症痛疼痛评分和脊髓背角神经元电活动的影响,探索JNK抑制剂对内脏炎症痛痛觉敏感化的作用,以期进一步探讨内脏炎症痛治疗的分子靶点。
方 法
1.试剂与材料
SP600125(美国Santa Cruze公司),福尔马林、乙醚和戊巴比妥钠(北京西中化工厂),PE-10管(ID:0.28mm; OD:0.61mm, Becton Dickinson公司),有机玻璃行为学观察箱(首都医科大学神经生物研究室制),大鼠手持直肠窥器(专利号:CN200820173538.2),钨丝电极(3~5MΩ,William D.Willis教授捐赠)、多导电生理记录仪(MP150型)(美国Biopac公司)。
2. 实验动物及分组
选用清洁级雄性SD大鼠,重200~250 g,山东省中医药大学实验动物中心提供,实验动物许可证号:SCXK (鲁) 2005-0015。实验随机分为4组:福尔马林(formalin, F)直肠致炎组(F组);福尔马林直肠致炎和脊髓蛛网膜下腔内插管(intrathecal, IT)组(IT组);福尔马林直肠致炎、脊髓蛛网膜下腔内插管并注射生理盐水组(NaCl组);福尔马林直肠致炎、脊髓蛛网膜下腔内插管并注射SP600125组(SP600125组);每组大鼠12只,共48只。
3.脊髓蛛网膜下腔内插管及给药
根据我们实验室既往成熟方法[8,9],用PE-10管插入大鼠脊髓蛛网膜下腔,插入长度7.5 cm,外端留有4.5 cm左右。本实验中NaCl和SP600125组,分别在福尔马林直肠致炎前30min经PE-10插管注射 20 μl 0.9%lNaCl、20 μl SP600125 溶液(含 10 μg SP600125),然后注入10 μl 0.9% NaCl冲洗插管,保证注射药品全部进入蛛网膜下腔。
4.内脏炎症痛模型复制
根据我们实验室既往成熟方法[8,9],大鼠乙醚持续麻醉,经肛门插入自制的直肠窥器(专利号:CN200820173538.2),距肛门约35 mm处,用针长8 cm的1 ml注射器于直肠粘膜下注射100 μl 5%的福尔马林。
5.内脏痛行为学观察
福尔马林致痛后,大鼠共有4种疼痛行为:①舔腹(L);②伸腰(B);③侧扭(C);④全身收缩(W)。疼痛评分公式计算:S = 1L + 2B + 3C +4W。L,B,C和W代表在一段时间内相应行为的次数。4组大鼠,每组8只,每15 min进行一次疼痛计分,连续记录大鼠的行为120 min[8,9]。
6.脊髓背角神经元放电记录
根据我们既往成熟方法进行脊髓背角神经元电生理记录[8,9]。SD大鼠以40 g/L的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,用钨丝电极(3~5 MΩ),在L6~S1背角处进行胞外记录,通过对直结肠扩张性刺激敏感性不同鉴别出广动力范围神经元,神经信号通过多导电生理记录仪记录并分析。以15 min为单位分析神经元放电频率,福尔马林注射前神经元放电频率为基线,即100%,注射后的放电频率以其占基线的百分比表示。观察记录注射福尔马林后120 min内脊髓背角神经元放电频率的变化,4组大鼠,每组8只,每15 min作为一个时间段,共8个时间段。
7.统计学方法
4个实验组分别以15 min共8个时间段记录疼痛反应和神经元放电频率变化。神经元放电频率以给药前神经元的放电频率为参照, 计算给药后反应的相对值:给药后实际反应频率/给药前实际反应频率×100%。所有实验数据均以均数±标准差(±SD)表示,统计学检验采用SPSS 10.0统计软件中的重复测量双因素方差分析进行比较,P < 0.05为差异有统计学意义。
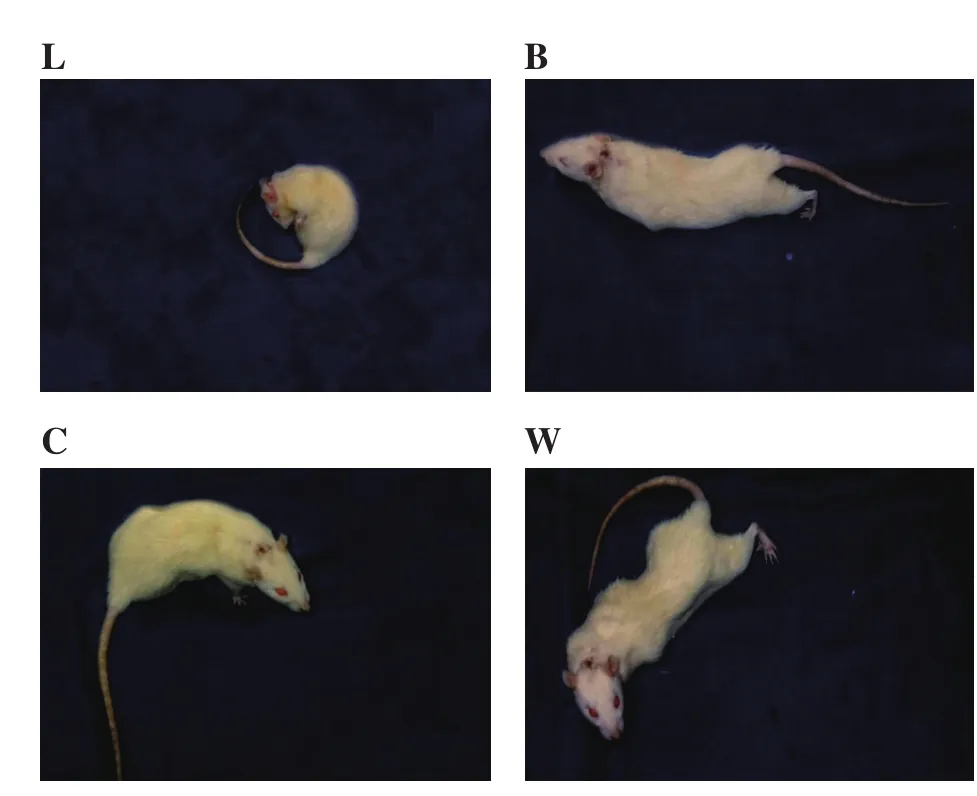
图1 4种内脏痛行为反应[9]L:舔腹;B:伸腰;C:侧扭;W:全身收缩Fig.1 Four kinds of formalin-induced painful behaviors[9]L: abdominal licking and nibbling; B: body stretching; C: contraction of the flanks; W: whole body contraction.
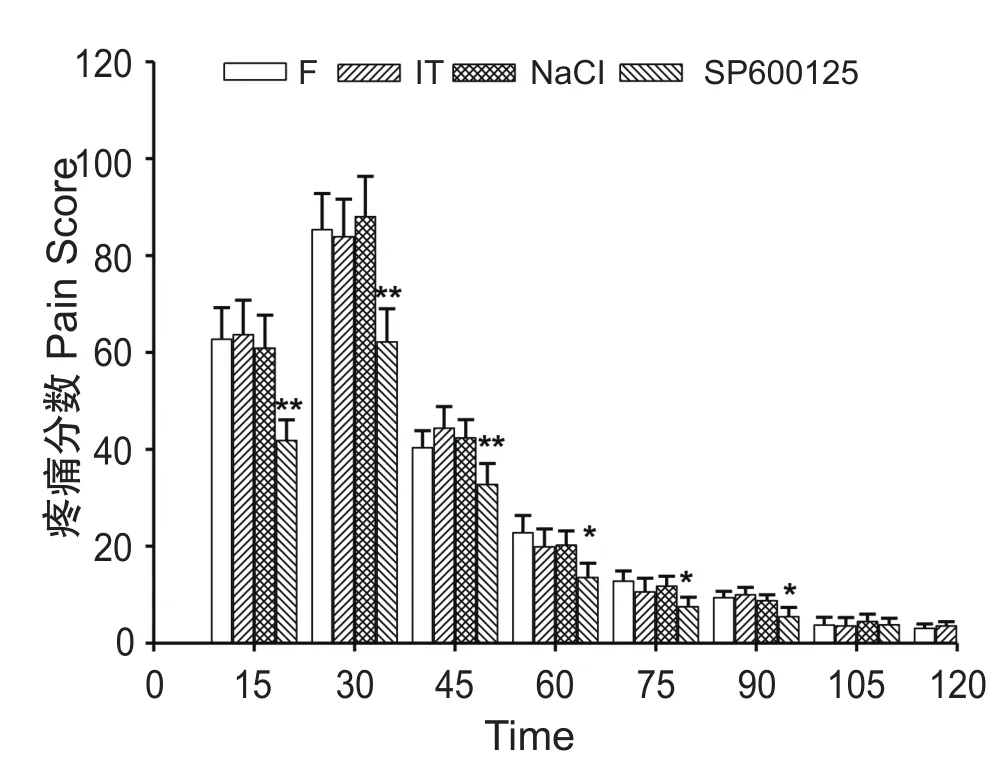
图2 福尔马林注射后各组不同时间段的疼痛分数SD)*P < 0.05, **P < 0.01, 与 F 组相比较Fig. 2 The time course of pain scores after formalin injection(±SD)N: Formalin group; IT: Intrathecal group; NaCl:NaCl group; SP600125: SP600125 group. *P < 0.05,**P < 0.01, compared with group F.
结 果
1.福尔马林复制内脏炎症痛模型的疼痛反应
四个实验组大鼠在注射福尔马林后30 min均达到疼痛评分的的最大值,并且在注射福尔马林后45 min至120 min之间,疼痛评分逐渐降低。前60 min内行为表现主要以W、C、B反应为主;而在后60 min内主要以L反应为主(见图1)。
2. JNK抑制剂SP600125减轻内脏炎症痛反应
F、IT、NaCl组和SP600125组大鼠在注射福尔马林后30 min均达到疼痛评分的最大值,从注射福尔马林后45 min至120 min内,疼痛评分逐渐降低,120 min时疼痛评分将至致痛前水平。SP600125组在前90 min内疼痛分数显著低于F组(P < 0.05或P < 0.01),IT组和NaCl组与F组相比较均未见显著性差异(见图2)。
3. 福尔马林直肠黏膜下注射后神经元放电频率的变化
注射福尔马林后,F组神经元放电频率立即明显增加,致炎后0~15 min、15~30 min和30~45 min内的放电频率分别为致炎前基线水平的 252.36 ± 28.76%、288.74 ± 40.64% 和 186.47 ±32.16%,在30 min时达放电频率最大值,与致炎前相比均有显著性增加(P < 0.05或P < 0.01), 提示福尔马林注射后出现疼痛敏感化。在注射福尔马林后45 min至120 min之间,放电频率逐渐降低,各时间段与致炎前相比虽有增加,但无显著性意义(见图3)。
4. JNK抑制剂SP600125降低大鼠背角神经元放电频率
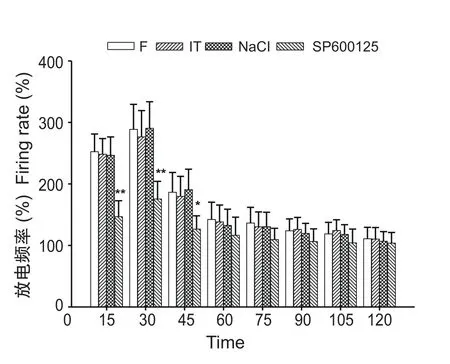
经蛛网膜下腔插管给予JNK抑制剂SP600125 30 min后,福尔马林直肠黏膜下注射致炎后神经元放电仍有增加,SP600125组在致炎后0~15 min、15~30 min和30~45 min两时间段的脊髓背角神经元放电频率分别为基线水平的146.86% ± 25.79%、175.49% ± 28.74%和126.48% ± 21.68%,与F组致炎后0~15 min、15~30 min和30~45 min内的放电频率 (252.36±28.76%、288.74±40.64%和186.47±32.16%) 分别相比均有显著性的降低(P < 0.05或P < 0.01); IT组和NaCl组与F组相比没有显著性差异(见图4)。
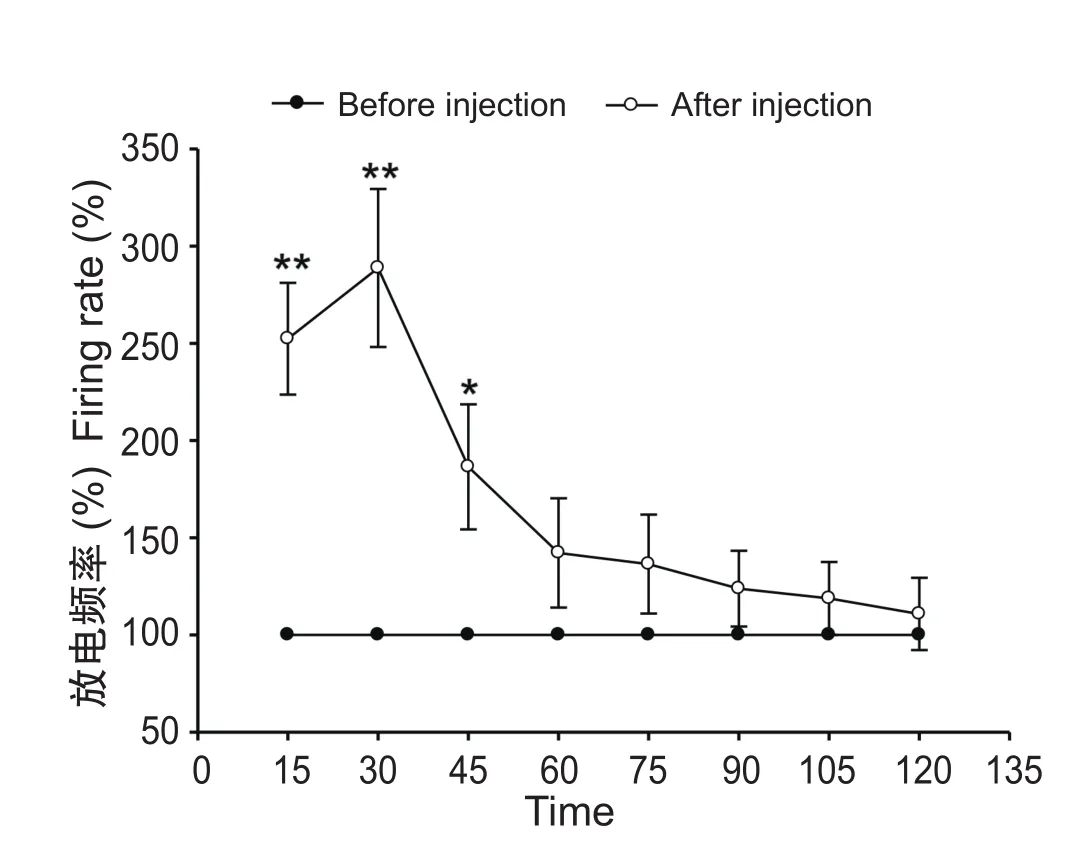
图3 福尔马林直肠黏膜下注射后神经元放电频率的变化*P < 0.05, **P < 0.01, 与注射前相比较Fig.3 Changes of the firing rate after formalin injection*P < 0.05, **P < 0.01, compared with Before injection.
讨 论
内脏痛以性质模糊、定位不明确、多通路传导、痛觉过敏、痛觉异常和牵涉痛为特点,严重影响病人生活、工作、学习和认知功能等[10,11]。内脏痛发病机制尚不明确,远远落后于躯体痛研究,严重影响了内脏痛病人的治疗与预后[12,13]。痛觉敏感化将是内脏炎症痛新型镇痛药物的研发方向,针对多个信号通路联合药物镇痛治疗优于单一药物,联合治疗是内脏痛治疗原则[1,4]。我们既往研究表明,众多信号分子,如PKC、ERK1/2参与内脏炎症痛发病机制,在内脏炎症痛觉敏感化形成和维持中起重要作用,均可以作为内脏炎症痛治疗新的药物靶点[7~9]。JNK作为MAPKs信号通路中的一员,在痛觉信号传递中发挥重要作用,缺少在内脏炎症痛中作用的细致研究,目前众多研究表明,PKC信号通路可以通过下游JNK信号通路,在神经元可塑、细胞凋亡等病理生理过程中发挥作用[14~16]。所以本研究观察JNK抑制剂对内脏炎症痛觉敏感化的影响,研究JNK抑制剂对内脏炎症痛的治疗作用,对探索联合信号靶点(如PKC、JNK等)治疗内脏炎症痛具有探索意义,也符合联合治疗内脏痛的药物治疗原则。
MAPKs通路包括MAPKERK通路、MAPKJNK通路、MAPKP38通路和MKK5/MAPKERK5 4条通路[7],Kondo T等、Sakurai J等分别利用胃扩张内脏痛模型,研究发现DRG神经元内P38、ERK激活,参与内脏痛形成与维持的痛觉调制过程[17,18];与ERK、P38激活通路相比,JNK在病理性痛觉敏感化中研究相对较少,在内脏痛痛觉敏感化调制中的作用研究更少[7]。Hao等利用躯体痛模型观察到,大鼠脚掌注射蜂毒素后产生痛觉感受和痛觉过敏,在注射前、后脚掌炎症局部给予 JNK抑制剂SP600125均可明显抑制蜂毒素引起的外周自发痛觉感受和热痛敏,但对机械痛敏效果较差,得出JNK可能对致炎后疼痛的维持和热痛敏的产生起重要作用,且外周的热痛敏和机械痛敏具有不同机制。同样Obata等在 L5脊神经结扎 (SNL)神经病理性痛模型中,鞘内注射 JNK 抑制剂 SP600125后,减轻 SNL引起的机械痛敏。我们应用内脏炎症痛模型研究发现,福尔马林直肠粘膜下致炎后,30 min时疼痛评分达最大值,同时脊髓背角神经元放电达高峰,说明30 min达到痛觉敏感化的高峰,给予JNK抑制剂SP600125后,能明显减少疼痛评分,抑制脊髓背角神经元放电,说明JNK抑制剂SP600125减轻内脏炎症痛反应,抑制内脏炎症痛觉敏感化,对内脏炎症痛具有镇痛作用。JNK作为一种应激激活的蛋白激酶,JNK被痛觉信号激活后,可通过一系列下游转录因子途径发挥作用:如Jun家族(c- Jun、JunB、JunD)、E lk-1、p53、ATF- 2、JDP2、c- M yc、STAT、NFAT 和 Pax家族等,在炎症反应和神经病理性损伤致痛觉敏感化中起重要作用[7]。JNK分为JNK1、JNK2和JNK3三种亚型,所以完善JNK(JNK1、JNK2和JNK3)那种亚型参与内脏炎症痛痛觉敏感化调制,同时探索PKC-JNK作为一条信号通路在内脏炎症发病机制中的作用,以及联合抑制PKC、JNK治疗内脏炎症痛,将是我们下一步研究的方向。
综上所述,JNK抑制剂SP600125通过降低内脏炎症痛疼痛评分和抑制脊髓背角神经元放电,起到抑制内脏炎症痛痛觉敏感化作用,JNK可能为内脏炎症痛镇痛靶点之一。
[1] Davis MP. Drug management of visceral pain: concepts from basic research. Pain Res Treat, 2012,2012:265605.
[2] Yamanaka H, Noguchi K. Pathophysiology of neuropathic pain: molecular mechanisms underlying central sensitization in the dorsal horn in neuropathic pain.Brain Nerve, 2012, 64:1255 ~ 1265.
[3] Yan N, Cao B, Xu J, et al. Glutamatergic activation of anterior cingulate cortex mediates the affective component of visceral pain memory in rats. Neurobiol Learn Mem, 2012, 97:156 ~ 164.
[4] Aziz Q, Botha C, Willert R. Pharmacology of visceral pain: central factors. Dig Dis, 2009, 27(1):31 ~ 41.
[5] Ji RR, Kawasaki Y, Zhuang ZY, et al. Protein kinases as potential targets for the treatment of pathological pain.Handb Exp Pharmacol, 2007, 177:359 ~ 389.
[6] Cheng JK, Ji RR. Intracellular signaling in primary sensory neurons and persistent pain. Neurochem Res,2008, 33:1970197 ~ 1970198.
[7] 张颜波,牛敬忠,孙保亮. 丝裂原活化的蛋白激酶激活通路与病理性痛痛觉敏感化.中国病理生理杂志,2010, 26: 613 ~ 616.
[8] Zhang Y, Gong K, Zhou W, et al. Involvement of subtypes γ and ε of protein kinase C in colon pain induced by formalin injection. Neurosignals, 2011, 19:142 ~ 150.
[9] Zhang YB, Guo ZD, Li MY, et al. Gabapentin Effects on PKC-ERK1/2 Signaling in the Spinal Cord of Rats with Formalin-Induced Visceral Inflammatory Pain.PLoS One, 2015, 10:e0141142.
[10] 张弘弘,孙艳,徐广银.慢性内脏痛的病理机制研究和临床治疗新进展.中国疼痛医学杂志, 2017,23(1):2 ~ 20.
[11] Gebhart GF, Bielefeldt K. Physiology of Visceral Pain.Compr Physiol, 2016, 6:1609 ~ 1633.
[12] Elsenbruch S, Enck P. Psychobiological mechanisms in the pathophysiology of chronic visceral pain. Schmerz,2016, 30:407 ~ 411.
[13] Johnson AC, Greenwood-Van Meerveld B. The Pharmacology of Visceral Pain. Adv Pharmacol, 2016,75:273 ~ 301.
[14] Yoon SP, Kim J. Exogenous CGRP upregulates profibrogenic growth factors through PKC/JNK signaling pathway in kidney proximal tubular cells. Cell Biol Toxicol, 2017.
[15] Wu N, Shen H, Wang Y, et al. Role of the PKCβII/JNK signaling pathway in acute glucose fluctuation-induced apoptosis of rat vascular endothelial cells. Acta Diabetol, 2017, 54:727 ~ 736.
[16] Wang X, Zhang Z, He X, et al. Taurochenodeoxycholic acid induces NR8383 cells apoptosis via PKC/JNK-dependent pathway. Eur J Pharmacol, 2016, 786:109 ~115.
[17] Kondo T, Sakurai J, Miwa H, et al. Activation of p38 MAPK through transient receptor potential A1 in a rat model of gastric distension-induced visceral pain. Neuroreport, 2013, 24:68 ~ 72.
[18] Sakurai J, Obata K, Ozaki N, et al. Activation of extracellular signal-regulated protein kinase in sensory neurons after noxious gastric distention and its involvement in acute visceral pain in rats. Gastroenterology,2008, 134:1094 ~ 1103.

