2 Hz电针对SNI诱导神经病理性疼痛大鼠背根神经节IRF8的作用*
王 英 江 茜 黄 诚
(1赣南医学院基础医学院,赣州341000;2赣南医学院临床护理教研室,赣州341000;3赣南医学院生理教研室,赣州341000)
神经病理性疼痛 (neuropathic pain, NP) 是一种由于外周或中枢神经系统病变、功能障碍所致的慢性疼痛综合征,以疼痛过敏、触诱发痛和自发性疼痛为临床特征。作为国际性难题的NP,在全世界有着高患病率,其中有 2/3 的病人药物治疗不能有效的的缓解症状,严重影响病人的生活质量,同时给社会带来巨大的压力。NP的发病机制极其复杂且治疗效果不佳。因此,对其发病机制的研究极其重要。而外周神经背根神经节 (dorsal root ganglion, DRG) 的损伤是神经病理性疼痛发生的主要原因之一。近年来,有大量文献报道,外周神经损伤后,可引起DRG内一些致炎因子和分子的基因和蛋白表达的变化,从而诱导神经病理性疼痛的发生发展[1,2]。
电针 (electroacupuncture, EA) 是由传统针灸发展而来的,它作为一种辅助治疗方法已广泛应用于临床。2 Hz电针对神经病理性疼痛的镇痛效果优于100 Hz电针[3],大量实验证实电针可通过作用于DRG来发挥镇痛作用[4,5],但其作用机制尚不甚清楚。目前有学者认为,干扰素调节因子8 (transcription factors interferon regulatory factor 8, IRF8) 是启动神经病理性疼痛形成的关键转录因子,可通过调控脊髓小胶质细胞的活化来启动神经病理性疼痛的形成[6]。有研究报道,对大鼠DRG进行脉冲射频可降低脊髓小胶质细胞IRF8的表达,从而缓解CCI模型诱导的神经病理性疼痛[7]。而关于IRF8在SNI模型中的表达情况尚未有研究,电针是否通过下调IRF8的表达,抑制小胶质细胞的活化从而缓解神经病理性疼痛也尚未有文献报道。基于此,我们提出电针通过抑制SNI模型大鼠DRG的IRF8表达抑制小胶质细胞的活化,进而来缓解神经病理性疼痛的假设,这就是本实验所要解决的问题,以期进一步为电针应用于临床治疗神经病理性疼痛提供理论和实验依据。
方 法
1.实验动物与分组
SPF级雄性SD大鼠,体重180~220 g,购自湖南斯莱克景达实验动物有限公司 [动物中心许可证号:SCXK (湘) 2013-0004]。动物饲养环境为每天12小时光照/12小时黑暗,50 ± 5%湿度,25±1℃。实验期间所有大鼠均自由饮食。大鼠实验和饲养符合相关规定。
将符合实验要求的大鼠随机分为3组 (n = 16):①Sham组;②SNI组;③SNI+EA组。在术后第1天开始,SNI+EA治疗组大鼠给予双侧的足三里和三阴交穴位进行隔日电针治疗21天,Sham组和SNI组大鼠则均给予上架不电针处理。于术前1 天和术后第3、7、10、14和21天分别测定其行为学变化。并于隔日电针的第3、7、14、21天,分别处死大鼠,立即取材。
2. 实验试剂与仪器
IRF8多 克 隆 抗 体 (ab28696, Abcam)、anti-β-tublin抗体 (20160510, Solarbio),CD11b (ab1211,Abcam),HRP标 记 兔 二 抗 (7074, CST),PVDF(Millipore),A SYBR®Select Master Mix (4472908,Life technologies),荧光二抗抗兔IgG (183967, Life technologies)。
华佗牌一次性针灸针(0.28 mm×15 mm,苏州医疗用品有限公司),韩氏多功能电针仪(北京华运安特科技有限公司),动态足底触觉仪(意大利Ugo Basile),Western Blot(电泳、电转移)系统(美国Bio-Rad),Lightcycler 480IIReal-Time PCR仪(瑞士Roche),MK3型酶标仪(美国Thermo),倒置荧光显微镜(日本 OLYMPUS) ZNHW-Ⅱ型恒温电热套(上海科雳仪器有限公司),SB-1000旋转蒸发仪(上海爱郎仪器有限公司)。
3.神经病理性疼痛大鼠模型制备
参照文献[8]介绍的方法制备SNI模型。按35 mg/kg剂量给予大鼠腹腔注射1%戊巴比妥钠进行麻醉,俯卧位固定于动物手术台上,左腿消毒和铺巾。于大腿股骨外缘凹陷中下部切开皮肤,钝性分离肌肉,暴露坐骨神经主干。坐骨神经干下1/3处分成腓总神经、胫前神经和腓肠神经。用玻璃棒分离3根神经,并结扎腓总神经和胫前神经,剪断,仅保留最细的进入腓肠肌的腓肠神经,腹腔注射40万单位青霉素液,肌肉和皮肤分两层缝合。术毕放回原笼,单笼饲养。术后1天,进行机械痛敏测试,剔除出现运动功能障碍和未出现触觉痛敏等不符合实验要求的大鼠。Sham组只暴露坐骨神经,不进行神经结扎剪断处理,其他手术操作同前。
4.电针的穴位与方法
根据文献,电针穴位选取足三里(ST36,胫骨前结节外侧2 mm)和三阴交(SP6,胫骨后、内踝上部2 mm),于术后第一天参考大鼠穴位图谱,分别垂直刺入足三里和三阴交两穴,深7 mm、5 mm,将刺入穴位的针固定好,连接韩氏多功能电针仪给予大鼠给予“连续波”(2 Hz;波宽0.6 ms;电流起始强度为1 mA,每10 min递增1 mA;时间30 min)治疗。随后隔日连续刺激,共 21天。
5. 机械缩足反射阈值(机械痛敏)的测定
采用动态足底触觉仪(意大利Ugo Basile)测定大鼠机械痛敏。将大鼠置于透明的有机玻璃箱中,底为1 cm×1 cm的铁丝网,实验前先适应15 min。采用测痛仪由下往上垂直刺激大鼠足底皮肤,逐渐加大刺激强度,记录出现缩足反应(如舔足、抬腿等)时的刺激强度为机械缩足反射阈值 (paw withdrawal threshold, PWT),最大刺激强度不超过50 g,每只大鼠重复3次,每次间隔5 min,取平均值。
6. Western blot检测
隔日电针3、7、14、21天后取材,快速取手术侧L4、L5和L6DRG。提取总蛋白后,应用BCA方法测量总蛋白浓度。将分装的蛋白样本 (30 μg) 进行SDS-PAGE (10%) 电泳,将蛋白转移至PVDF膜上,5% 脱脂牛奶室温封闭约1 h,按1:300 比例稀释一抗孵育过夜;1:1 000比例稀释与一抗对应的二抗,室温孵育2 h。最后,使用化学成像发光成像系统照相,通过Image tool图像分析软件读取目的蛋白以及内参条带在PVDF膜上测得的光密度值,计算出目的蛋白表达量。
7. 取材及免疫组化切片制备
以1%戊巴比妥钠腹腔注射 (100 mg/kg) 将大鼠麻醉,迅速开胸,经左心室插管入主动脉升部,先用150 ml 预冷的生理盐水快速灌流冲洗血液,然后给予200 ml 预冷的4%多聚甲醛(多聚甲醛溶于0.1 M PBS)缓慢灌流,直至大鼠身体变硬,大约2 h左右。取出手术侧(本实验为左侧)L4-6节段DRG,放入4%多聚甲醛PFA溶液中外固定4~6 h,然后转移到含20%、30%蔗糖中进行梯度脱水,直到组织沉底。将沉底的DRG组织取出后,用冷冻包埋剂(OCT)包埋,置于-80℃保存。切片时,-20℃冰冻切片机提前预冷,连续切片,DRG片厚10 μm,贴片于载玻片上,置于-20℃冰箱保存备用。
8. 免疫荧光染色
将已切好的DRG组织,用5% BSA封闭,37℃温箱中孵育1 h;0.01 M PBS 漂洗,5 min ×3次,5% BSA按1:200比例稀释一抗IRF8 (ab28696,Abcam),CD11b (ab1211, Abcam) 4℃冰箱中过夜;0.0l M PBS漂洗5 min × 3次;按1:1 000加入荧光二抗,37℃温箱中孵育1 h;0.0l M PBS 漂洗5 min × 3次;滤纸吸干,用抗荧光减弱剂封片;在荧光显微镜观察IRF8的蛋白表达。
9. qPCR 检测
各引物序列由上海生工生物工程公司合成。IRF8, Forward CCAGATCCTCCCTGACTGGT,Reverse TAAGGCTGAATGGTGTGCGT; GAPDH,Forward CAGCCGCATCTTCTTGTGC, Reverse GGTAACCAGGCGTCCGATA。 采 用 A SYBR® Select Master Mix试剂盒提取总RNA并配制20 μl逆转录体系合成cDNA。反转录条件:65℃,5 min;37℃,2 min;37℃,10 min;5个循环,70℃15 min。采用qPCR法进行扩增,PCR 扩增反应条件为:预变性(95℃,10 min);40个扩增循环,(95℃,10 s;61℃,20 s;72℃,25 s);溶解(72℃~95℃,0.5℃,10 s/each)。每组重复检测3次。采用2^-ΔΔCt法分析IRF8的mRNA表达水平。
10.数据处理与统计分析
应用GraphPad Prism 5.0软件对数据进行处理并统计分析,以均数±标准误(±SEM)表示,PWT的结果、qPCR和Western blot的结果采用two-way ANOVA检验。P < 0.05为差异有统计学意义。
结 果
1. 2 Hz电针对SNI模型大鼠机械缩足反射阈值(PWT) 的影响
实验结果显示:Sham组、SNI组和SNI+EA组在造模前的机械缩足反射阈值无差异(P > 0.05)。与Sham组相比,SNI组在术后第3天即出现机械缩足反射阈值下降(P < 0.001),提示造模成功,且在观察时间内持续低于Sham组(P < 0.001)。与SNI组相比,给予2 Hz电针干预后的第3、5、7、10、14和21天,机械缩足反射阈值显著上升(P < 0.05,见图 1)。
2. 2 Hz电针对SNI模型大鼠DRG的IRF8 mRNA表达的影响
实验结果显示:与Sham 组比较,SNI组大鼠DRG中IRF8 的mRNA表达明显增加 (P < 0.01,P < 0.001);与SNI组比较,SNI+EA组大鼠DRG中IRF8 的mRNA表达显著减少 (P < 0.01,P < 0.001,见图2)。
3. 2 Hz电针对SNI模型大鼠DRG的IRF8蛋白表达的影响
实验结果显示:与Sham组相比,SNI组大鼠DRG中IRF8蛋白表达均明显增加(P < 0.05,P < 0.01);与SNI组相比,2 Hz EA治疗21天后,DRG的IRF8蛋白表达显著降低 (P < 0.05,P < 0.01,见图3)。
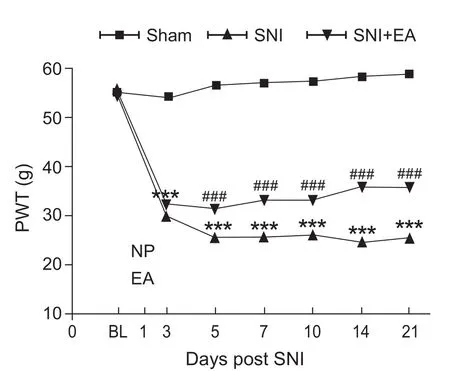
图1 2 Hz EA对 SNI 模型大鼠机械缩足反射阈值 (PWT)的影响(n = 8~16,±SEM)与 Sham 组比较:***P < 0.001;与SNI 组比较:###P < 0.001Fig.1 Effects of 2Hz EA on mechanical paw withdrawal threshold evoked by spared nerve injury in rats(n = 8~16,±SEM)***P < 0.001, compared to Sham group, ###P < 0.001,compared to SNI group.

图2 2 Hz EA对SNI大鼠DRG中IRF8 mRNA表达的影响(n = 4,±SEM)与 Sham 组比较,**P < 0.01,***P < 0.001;与SNI 组比较,##P < 0.01,###P < 0.001Fig.2 qPCR analysis of IRF8 mRNA expression in the L4-L6 DRG (n = 4,±SEM)**P < 0.01,***P < 0.001, compared to Sham group,##P < 0.01,###P < 0.001, compared to SNI group.
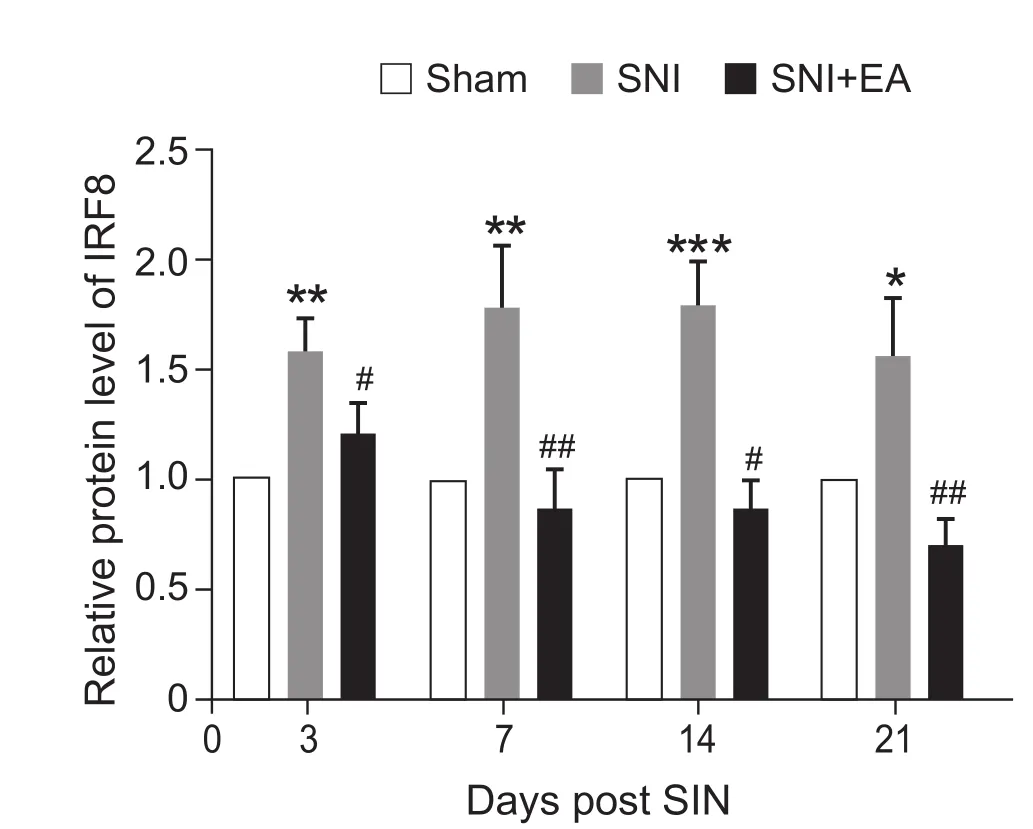
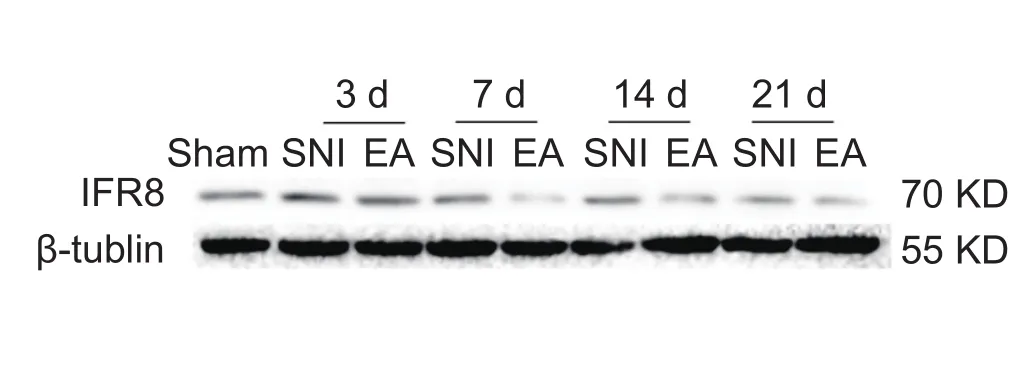
图3 2 Hz EA对SNI大鼠DRG中IRF8蛋白表达的影响(n = 7,±SEM)*P < 0.05,**P < 0.01,***P < 0.001,与 Sham 组比较;#P < 0.05,## P < 0.01,与 SNI组比较Fig.3 Western blot analysis of IRF8 protein expression in the L4-6 DRG (n = 7,±SEM)*P < 0.05,**P < 0.01,***P < 0.001, compared to Sham group, #P < 0.05,##P < 0.01, compared to SNI group.
4. 2 Hz电针对SNI模型大鼠DRG的CD11b mRNA表达的影响
实验结果显示:与Sham组相比,SNI组大鼠DRG中CD11b mRNA表达均明显增加 (P < 0.05,P < 0.001);与SNI组相比,2 Hz EA治疗21天后,DRG的CD11b mRNA表达显著降低 (P < 0.05,P < 0.01, P < 0.001,见图 4)。
5. 2 Hz电针对SNI模型大鼠DRG的IRF8及CD11b蛋白表达分布的影响
免疫荧光实验结果显示:与Sham组相比,SNI组大鼠DRG中IRF8及CD11b蛋白表达分布明显增加;与SNI组相比,2 Hz EA治疗7天后,大鼠DRG的IRF8及CD11b蛋白表达分布显著降低(见图5)。
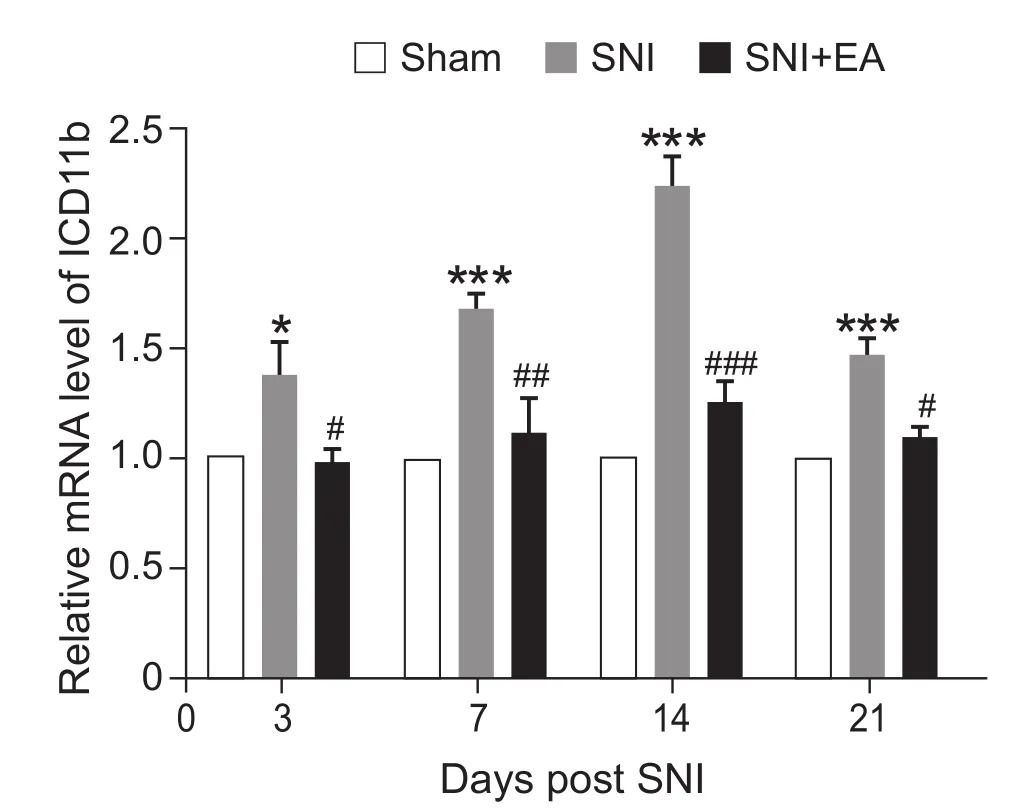
图4 2 Hz EA对SNI大鼠DRG中CD11b mRNA表达的影响(n = 4,±SEM)*P < 0.05,***P < 0.001,与Sham组比较;#P < 0.05,##P < 0.01, ###P < 0.001,与 SNI组比较Fig.4 qPCR analysis of CD11b mRNA expression in the L4-6 DRG (n = 4,±SEM)*P < 0.05,***P < 0.001, compared to Sham group;#P < 0.05,##P < 0.01, ## P < 0.001, compared to SNI group.
讨 论
神经病理性疼痛是一种临床常见的慢性病,其病因、发病机制及过程复杂。临床治疗方法效果不佳,严重影响病人的生活质量。为此,阐明神经病理性疼痛的发病机制及过程已刻不容缓,且可为临床上治疗神经病理性疼痛提供新的治疗途径和方法。我们的实验发现2 Hz电针可明显缓解SNI所诱导神经病理性疼痛的机械痛敏,并显著降低SNI模型大鼠DRG的IRF8基因和蛋白的表达水平。
本研究以选择性坐骨神经分支损伤 (SNI) 神经病理性疼痛为实验模型,SNI模型与其他几种模型相比较,具有疼痛发生时间早、维持时间长、损伤较小等特点,可减少伤口炎症介质所产生的疼痛,从而特异性的研究神经病理痛。有研究表明,SNI模型对机械灵敏度以及热反应变化的长期性与临床上的神经病理性疼痛特征非常相似[8,9]。在我们的实验中发现,SNI模型大鼠术后的后肢足底和足背外侧缘腓肠神经的感受野出现明显的机械痛敏,术后24小时内开始出现,第14天达高峰,这与文献报道的相一致[10]。给予2 Hz 电针隔日治疗21天后PWT显著上升,提示2 Hz 电针可缓解SNI所致的神经病理性疼痛大鼠的机械痛敏行为。这为我们进一步研究电针对SNI所致神经病理性疼痛的镇痛机制提供了稳定而可靠的大鼠模型。
IRF8是IRFs家族成员之一,在免疫和炎症反应、细胞周期和细胞凋亡等生物过程中起着关键作用。近期Masuda等发现,IRF8在中枢神经系统的小胶质细胞中有特异性表达,提示IRF8在调节小胶质细胞的活化和基因表达中起着关键作用,并且与神经病理性疼痛有着密切的相关性[11]。外周神经损伤 (peripheral nerve injury, PNI) 后,脊髓小胶质细胞的IRF8表达明显上调[12];在IRF8缺失小鼠,PNI术后诱导的触觉异常性疼痛可得到缓解,但其基础机械痛阈没有变化;通过对PNI术后小鼠鞘内注射IRF8的小干扰RNA (siRNA),可抑制脊髓IRF8的上调表达,且可恢复PNI诱导的触觉异常性疼痛[13]。以上研究表明IRF8通过激活并维持脊髓小胶质细胞的活化参与了神经病理性疼痛的发展和维持。证实了IRF8是启动神经病理性疼痛形成的关键转录因子。但有关IRF8在外周神经系统中的作用研究甚少。
神经病理性疼痛的形成和发展包含多因素相互的作用,其发病机制是由外周和中枢神经系统共同调控的[14,15]。DRG是神经病理性疼痛发生发展中痛觉信息传导的重要部位。比如,外周神经损伤后,作为第一级神经元的DRG接受外周疼痛信号的传入进而将之传送到脊髓背角及更高级中枢,通过阻断DRG就可抑制外周痛觉信息向脊髓及上位中枢的传递,从而调控痛觉的发生发展。有研究报道,小胶质细胞在DRG中有表达,且参与疼痛的调控[16]。为此,我们在实验中观察了IRF8在2 Hz电针对神经病理性疼痛模型大鼠的作用,发现SNI大鼠术后第3、7、14和21天的DRG中IRF8的mRNA和蛋白表达水平均明显升高,提示在外周的IRF8可能参与了神经病理性疼痛的形成和发展;也发现SNI大鼠术后DRG中的小胶质细胞的标志物CD11b的mRNA水平在第3、7、14和21天升高,而电针处理后IRF8的mRNA和蛋白表达水平、CD11b的mRNA水平均降低。为了证明IRF8与小胶质细胞的关系,进一步的免疫荧光结果显示,SNI术后7天,IRF8和CD11b的表达分布均明显升高,且IRF8在DRG小胶质细胞上表达,给予大鼠2 Hz 电针后可下调IRF8和CD11b的表达分布。以上结果提示2 Hz电针可能通过下调SNI大鼠DRG的IRF8基因和蛋白的表达,进而抑制DRG小胶质细胞的活化, 来缓解神经病理性疼痛的痛敏行为。
综上所述,基于文献报道和我们的实验结果,提示2 Hz 电针作用于神经病理性疼痛的可能镇痛机制是通过下调DRG的IRF8表达来抑制DRG小胶质细胞的活化,进而抑制神经病理性疼痛的发生发展,这也为电针治疗神经病理性疼痛提供了新靶点,但本实验未应用IRF8拮抗剂进一步探讨电针对SNI大鼠的镇痛作用,鞘内给予IRF8 siRNA或使用IRF8敲除大鼠,能进一步阐明电针对SNI大鼠的镇痛效应。
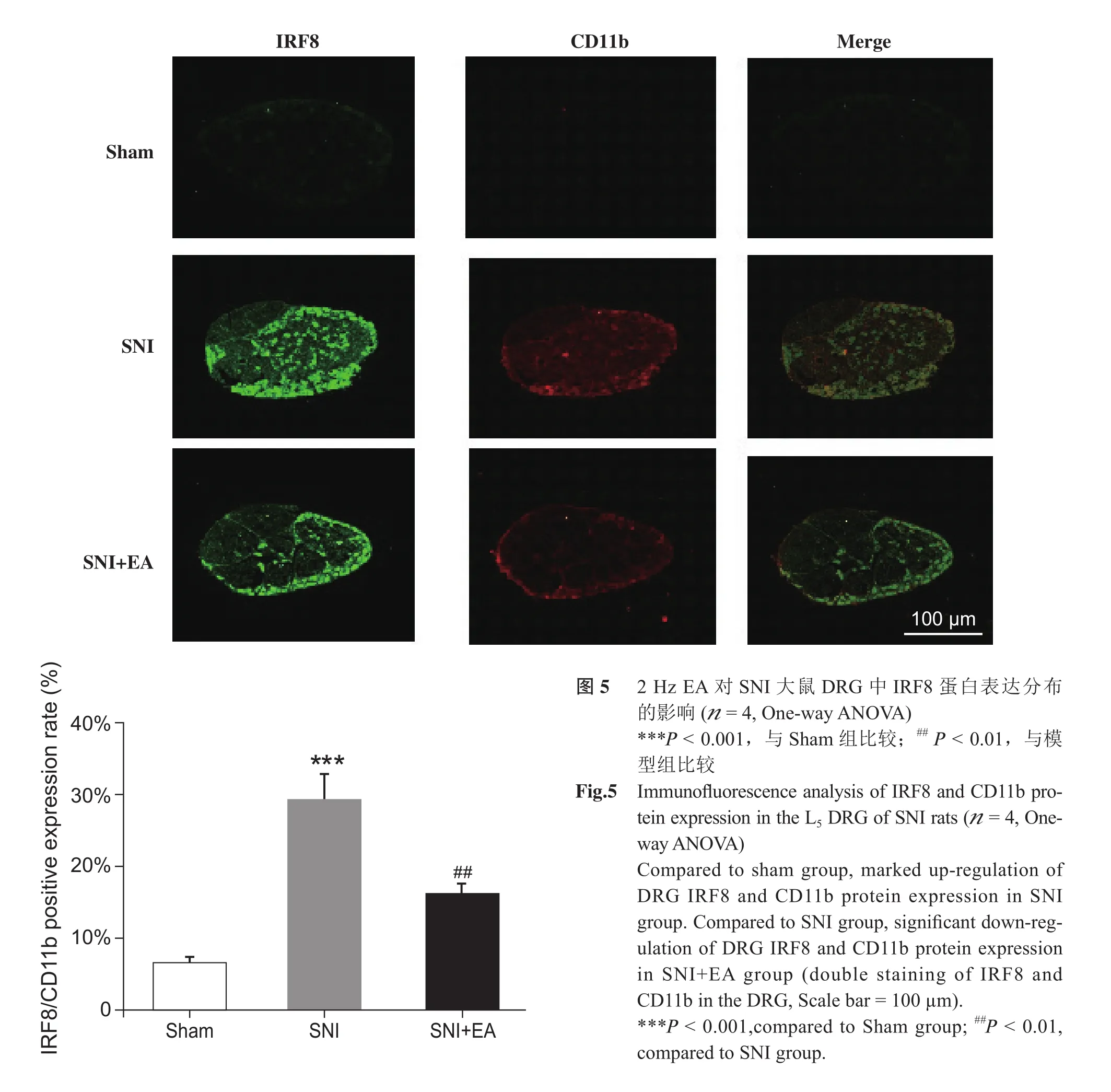
图5 2 Hz EA对SNI大鼠DRG中IRF8蛋白表达分布的影响 (n = 4, One-way ANOVA)***P < 0.001,与 Sham 组比较;## P < 0.01,与模型组比较Fig.5 Immunofluorescence analysis of IRF8 and CD11b protein expression in the L5 DRG of SNI rats (n = 4, Oneway ANOVA)Compared to sham group, marked up-regulation of DRG IRF8 and CD11b protein expression in SNI group. Compared to SNI group, significant down-regulation of DRG IRF8 and CD11b protein expression in SNI+EA group (double staining of IRF8 and CD11b in the DRG, Scale bar = 100 µm).***P < 0.001,compared to Sham group; ##P < 0.01,compared to SNI group.
[1] Ezquerra L, Alguacil LF, Nguyen T, et al. Different pattern of pleiotrophin and midkine expression in neuropathic pain: correlation between changes in pleiotrophin gene expression and rat strain differences in neuropathic pain. Growth Factors, 2008,26(1):44 ~ 48.
[2] Zhou XF, Deng YS, Xian CJ, et al. Neurotrophins from dorsal root ganglia trigger allodynia after spinal nerve injury in rats. Eur J Neurosc, 2000, 12(1):100 ~ 105.
[3] Liang Y, Qiu Y, Du J, et al. Inhibition of spinal microglia and astrocytes contributes to the anti-allodynic effect of electroacupuncture in neuropathic pain induced by spinal nerve ligation. Acupunct Med, 2016,34:40 ~ 47.
[4] Zhang RX, Lao LX , Ren K, et al. Mechanisms of Acupuncture-Electroacupuncture on Persistent Pain. Anesthesiology, 2014, 120(2): 482 ~ 503.
[5] He XF, Wei JJ, Shou SY, et al. Effects of electroacupuncture at 2 and 100 Hz on rat type 2 diabetic neuropathic pain and hyperalgesia-related protein expression in the dorsal root ganglion. J Zhejiang Univ Sci B,2017, 18(3): 239 ~ 248.
[6] Masuda T, Lwamoto S, Yoshinaga R, et al. Transcription factor IRF5 drives P2X4R+reactive microglia gating neuropathic pain. Nat Commun, 2014, 5: 3771.
[7] 方向宇, 徐雪汝, 刘荣国.脉冲射频大鼠CCI模型DRG对脊髓小胶质细胞IRF8表达的影响. 中国疼痛医学杂志, 2016, 22 (11):816 ~ 820.
[8] Decosterd I, Woolf CJ. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain,2000, 87(2):149 ~ 158.
[9] St Jacques B, Ma W. Role of prostaglandin E2 in the synthesis of the pro-inflammatory cytokine interleukin-6 in dorsal root ganglion neurons: an in vivo and in vitro study. J Neurochem, 2011, 118(5): 841 ~ 854.
[10] 汪伟, 王文, 武胜昔. 炎症性痛和神经病理性疼痛模型. 神经解剖学杂志, 2007, 23(1):93 ~ 98.
[11] Masuda T, Tsuda M, Yoshinaga R, et al. IRF8 is a critical transcription factor for transforming microglia into a reactive phenotype. Cell Rep, 2012, l(4): 334 ~ 340.
[12] Masuda T, Tsuda M, Tozaki SH, et al. Microglial regulation of neuropathic pain. J Pharmacol Sci, 2013,121(2): 89 ~ 94.
[13] Tsuda M, Masuda T, Inoue K, et al. P2X4 receptors and neuropathic pain. Front Cell Neurosci, 2013, 7(1): 191.
[14] Todd AJ. Neuronal circuitry for pain processing in the dorsal horn. Nat Rev Neurosci. 2010, 11(12): 823 ~ 836.
[15] Lu Y, Dong H, Gao Y, et.al. A feed-forward spinal cord glycinergic neural circuit gates mechanical allodynia. J Clin Invest, 2013, 123(9): 4050 ~ 4062.
[16] Pan J, Lin XJ, Ling ZH, et al. Effect of down-regulation of voltage-gated sodium channel Nav1.7 on activation of astrocytes and microglia in DRG in rats with cancer pain. Asian Pac J Trop Med, 2015, 8(5):405 ~ 411.

