基于肠道菌群代谢的知母皂苷BⅡ体外代谢转化研究
刘艳平 余自成 陈红君

摘要:目的 通过大鼠肠道菌群体外实验,观察大鼠肠道菌群对知母皂苷BⅡ的代谢转化情况。方法 收集大鼠新鲜粪便,将大鼠肠道菌加入厌氧培养液得到肠道菌孵育液,加入知母皂苷BⅡ,在厌氧环境中37 ℃温孵24 h,经沉淀离心,取上清液,采用高效液相色谱和薄层色谱方法对知母皂苷BⅡ降解情况和代谢成分进行分析。结果 知母皂苷BⅡ在大鼠粪便孵育液中很快发生代谢转化,24 h后孵育液中已检测不到知母皂苷BⅡ,能检测出较高浓度的代谢产物。代谢产物经检测为知母皂苷AⅢ。结论 离体培养的大鼠肠道菌可对知母皂苷BⅡ进行代谢,初步确定代谢产物为知母皂苷AⅢ。
关键词:知母皂苷BⅡ;大鼠肠道菌;代谢
DOI:10.3969/j.issn.1005-5304.2018.05.015
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)05-0066-05
Study on Metabolism and Transformation of Timosaponin BⅡ in Vitro
Based on Metabolism of Intestinal Flora
LIU Yan-ping1, YU Zi-cheng2, CHEN Hong-jun2
1. Pudong New Area Peoples Hospital, Shanghai 201200, China;
2. Yangpu Hospital of Tongji University, Shanghai 200090, China
Abstract: Objective To observe metabolic transformation of Timosaponin BⅡ in intestinal flora of rats by rat intestinal flora in vitro. Methods After the fresh rat feces were collected, the intestinal bacteria were added to the anaerobic medium to obtain the intestinal bacteria incubation fluid. Timosaponin BⅡ was added and cultured, and incubate at 37 ℃ in anaerobic environment for 24 h. Then samples were gathered through deposition and centrifugation. The supernatant was analyzed by HPLC and TLC method, and the degradation rate and metabolic components of Timosaponin BⅡ were analyzed. Results In vitro, Timosaponin BⅡ was metabolized by the intestinal flora soon and it could not be detected in the incubation fluid after 24 h, which could detect a higher concentration of metabolites. The metabolites preliminary identified as Timosaponin AⅢ. Conclusion Rat intestinal flora in vitro have metabolism effect on Timosaponin BⅡ. The metabolites are initially identified as Timosaponin AⅢ.
Keywords: Timosaponin BⅡ; intestinal bacteria; metabolize
知母為百合科植物知母Anemarrhena asphodeloides Bge.的干燥根茎,味苦、性寒,具有清热泻火、止渴除烦、滋阴润燥等功效,临床用于高热烦渴、外感热病、内热消渴、肺热燥咳、骨蒸潮热、肠燥便秘等。知母皂苷BⅡ(Timosaponin BⅡ,TBⅡ)是知母中的主要活性成分,具有抗老年痴呆、改善学习记忆、抗抑郁、抗肿瘤、抗炎、降糖等药理活性[1-2]。
基金项目:上海市杨浦区科技委卫计委科研课题(YP15Q05);同济大学青年优秀人才培养行动计划(2015KJ049);上海市杨浦区中心医院院级课题(Se1201509)
多种天然产物口服后可被肠道菌群代谢,有些天然产物经肠道细菌代谢后转化为具有更强活性药理或毒理作用的新化合物,因此,许多天然药物以前体药形式存在,肠道菌群在其代谢中发挥着至关重要的作用。天然药物代谢反应中最重要的是糖苷的水解,β-糖苷酶是催化这类反应的最常见水解酶,可以将外源性β-糖苷类化合物转化为相应的苷元和糖。由于TBⅡ属于β-糖苷类化合物(结构见图1),因此我们推测它可能会被肠道菌产生的β-糖苷酶代谢。本实验采用离体肠道菌孵育的方法,将TBⅡ用大鼠肠道菌的培养液在厌氧条件下温孵,考察其在肠道中代谢转化的一般规律,以HPLC定性分析TBⅡ在大鼠肠道菌群中的代谢情况,并推测代谢产物的结构,探讨TBⅡ在胃肠道内的代谢转化,以期为知母的体内药效物质基础研究及临床应用开发提供依据。
图1 TBⅡ结构图
1 仪器与试药
Agilent1100高效液相色谱仪(Agilent公司),Alltech3300蒸发光散射检测器(美国Grace公司),MS204S梅特勒电子分析天平(北京梅特勒仪器系统有限公司),MCO-15AC CO2培养箱(三洋电机株式会社),DK-S22电热恒温水浴锅(上海精宏实验设备有限公司),MTN-2800D氮吹仪(天津奥特赛恩斯仪器有限公司),MSL-3780高压蒸汽灭菌锅(三洋电机株式会社),ALLEGRA X-30R离心机(Beckman Coulter)。
TBⅡ(批号B21657,纯度≥98%),上海源叶生物有限公司;知母皂苷AⅢ(TAⅢ,批号17050329,纯度≥98%),上海同田生物有限公司;厌氧培养液(批号20170613)、厌氧培养袋(批号20161225)、厌氧产气包(批号20170615),上海哈灵生物公司;动物粪便采于SD雄性大鼠;乙腈(色谱纯),美国Fisher公司;其他试剂均为分析纯。
2 方法
2.1 色谱条件
2.1.1 知母皂苷BⅡ色谱条件
色谱柱:AlltimaTM C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(25∶75);流速:1 mL/min;检测器:蒸发光散射检测器,温度为60 ℃,雾化气体流速为1.5 L/min;柱温:25 ℃;进样量:20 μL。
2.1.2 知母皂苷AⅢ色谱条件
色谱柱:AlltimaTM C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-水(85∶15);流速:1 mL/min;检测器:蒸发光散射检测器,温度为60 ℃,雾化气体流速为1.5 L/min;柱温:25 ℃;进样量:20 μL。
2.2 对照品溶液的制备
2.2.1 知母皂苷BⅡ对照品溶液
精密称取TBⅡ对照品17.6 mg,溶于30%丙酮溶液10 mL中,即配制成浓度为1.76 mg/mL的TBⅡ对照品溶液,置于4 ℃冰箱中保存备用。
2.2.2 知母皂苷AⅢ对照品溶液
精密称取TAⅢ对照品12.1 mg,溶于10 mL甲醇溶液中,即配制成浓度为1.21 mg/mL的TAⅢ对照品溶液,置于4 ℃冰箱中保存备用。
2.3 厌氧培养液的制备
取GAM肉湯约15 g置烧杯中,加适量纯水,水浴中搅拌使溶解,冷却后转移并定容至1000 mL容量瓶中,即得GAM培养液,0.07 MPa、121 ℃高压灭菌15 min,冷却后备用。
2.4 大鼠肠道菌孵育液的制备
取健康大鼠的新鲜粪便10 g,按质量体积比1∶4加入生理盐水制成混悬液,4000 r/min离心10 min,取上清液,得大鼠肠道菌液。将大鼠肠道菌液按体积比2∶3加入厌氧培养液中,混匀后即得大鼠肠道菌孵育液。
2.5 色谱方法的建立
2.5.1 线性关系考察
取1.628 mg/mL TBⅡ对照品溶液,加入预先121 ℃高压灭菌15 min的大鼠肠道菌孵育液中,逐级稀释,分别配制浓度为40.7、108.5、407、814、1085、1628 μg/mL的对照品溶液,按“2.1.1”项下色谱条件测定,结果TBⅡ在40.7~1628 μg/mL范围内与峰面积的对数线性关系良好,回归方程为Y=1.227 9X+0.635 5,r2=1。
2.5.2 专属性考察
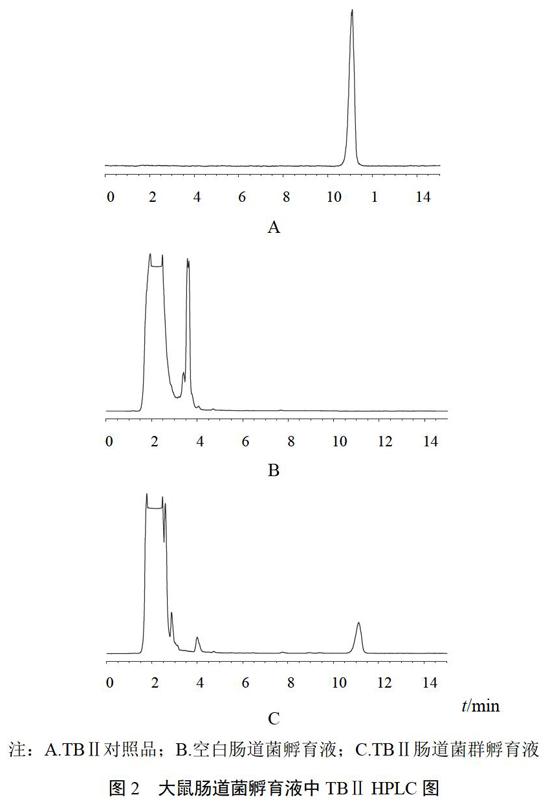
分别对空白肠道菌孵育液、TBⅡ对照品溶液和TBⅡ肠道菌孵育液中待测成分的色谱专属性进行考察分析,结果表明,TBⅡ对照品溶液和TBⅡ肠道菌孵育液中TBⅡ的保留时间一致,空白肠道菌孵育液在相同保留时间无该色谱峰,空白肠道菌孵育液不干扰该成分的测定。色谱图见图2。
2.5.3 精密度试验
取175.8 μg/mL的含预先121 ℃高压灭菌15 min的肠道菌培养液的对照品溶液20 μL,按“2.1.1”项下色谱条件,连续进样6次,计算峰面积RSD=1.72%,表明仪器精密度良好。
2.5.4 加样回收率试验
取同一已知含量的121 ℃高压灭菌15 min的含TBⅡ大鼠肠道菌培养液9份,分别每3份加入80%、100%、120%对照品溶液,测定TBⅡ含量,计算低、中、高3种浓度的加样回收率分别为103%、105%、102.6%。
2.5.5 重复性试验
取6份5 mL大鼠肠菌培养液,加入2 mL浓度为1.76 mg/mL的TBⅡ对照品溶液,混匀,置于37 ℃恒温培养箱培养4 h,分别取出0.5 mL,加入0.5 mL冰乙腈终止反应,涡旋振荡2 min,10 000 r/min离心10 min,取上清液0.5 mL,于37 ℃水浴上氮气流吹干。残渣用30%丙酮100 μL溶解,14 800 r/min离心15 min,取上清液,进行HPLC分析,测得TBⅡ含量RSD=2.48%。
A
B
C
注:A.TBⅡ对照品;B.空白肠道菌孵育液;C.TBⅡ肠道菌群孵育液
图2 大鼠肠道菌孵育液中TBⅡ HPLC图
2.6 知母皂苷BⅡ在大鼠肠道菌培养液中的代谢
取上述大鼠肠道菌孵育液5 mL,加入2 mL浓度为1.76 mg/mL的TBⅡ对照品溶液,混匀,将溶液分装(每管0.5 mL),同时设阴性对照组(不加TBⅡ的大鼠肠道菌孵育液,排除大鼠粪便中其他成分和厌氧培养液中成分的干扰)和空白对照组(TBⅡ对照品溶液+厌氧培养液,排除厌氧培养液对TBⅡ的干扰),每组重复2份。将各组置于培养系统中,37 ℃恒温培养箱密闭培养0、1、2、4、8、12、24 h,于各时间点分别取出各样品,加0.5 mL冰乙腈终止反应,涡旋振荡1 min,10 000 r/min离心10 min,取上清液0.5 mL,置于氮吹仪上,37 ℃水浴氮气流吹干。残渣用30%丙酮100 μL溶解,14 800 r/min离心10 min,取上清液进样分析,测定TBⅡ含量,计算TBⅡ的剩余率与转化率。剩余率(%)=Cn÷C0×100%,转化率(%)=(C0-Cn)÷C0×100%,式中Cn为第n个时间点的TBⅡ浓度,C0为0 h的TBⅡ浓度。另取一部分样品残渣,用甲醇100 μL溶解,14 800 r/min离心10 min,取上清液,进行HPLC和TLC分析,根据对照品初步鉴定代谢产物。
3 结果
3.1 知母皂苷BⅡ在大鼠肠道菌培养液中的代谢转化分析
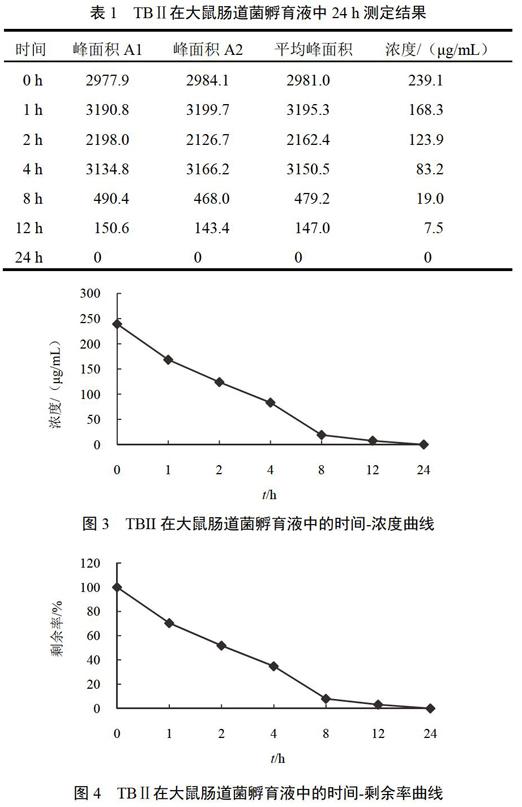
TBⅡ在大鼠肠道菌孵育液中24 h的代谢情况见表1、图3~图5。厌氧培养液对TBⅡ的代谢转化无影响,厌氧培养液与TBⅡ温孵24 h含量基本不变,见图6。大鼠粪便中其他物质和厌氧培养液残留成分也无干扰。TBⅡ在与大鼠肠道菌共孵育的过程中,代谢率的变化经过了2个时期:急速增加期(0~8 h)、平稳期(8~24 h)。TBⅡ与肠道菌共孵育24 h后已经检测不到TBⅡ。以0 h时TBⅡ的含量作为100%,TBⅡ在1、2、4、8、12、24 h的剩余率分别为70.4%、51.8%、34.8%、7.9%、3.2%、0%。以0 h时TBⅡ的代谢产物作为0%,TBⅡ在1、2、4、8、12、24 h的转化率分别为29.6%、48.2%、65.2%、92.0%、96.8%、100%。
3.2 知母皂苷BⅡ在大鼠肠道菌孵育液中的代谢产物检测
3.2.1 高效液相色谱检测
采用HPLC检测代谢产物是否为TAⅢ。分别精密吸取处理后的TBⅡ肠道菌孵育液与TAⅢ对照品溶液各20 μL,按“2.1.2”项下色谱条件进样,结果样品图谱中与对照品在相同的保留时间显示同一个色谱峰,初步鉴定代谢产物为TAⅢ。各时间点HPLC图见图7。
3.2.2 薄层色谱检测
将“2.6”项下的24 h孵育液迅速加入0.5 mL冰乙腈终止反应,涡旋振荡2 min后,10 000 r/min离心10 min,取上清液0.5 mL,于37 ℃水浴上氮气流吹干。残渣用100 μL甲醇溶解,14 800 r/min离心10 min,取上清液,进行薄层色谱分析。
分别吸取甲醇复溶的样品溶液、TAⅢ对照品溶液和阴性对照溶液(不加TBⅡ的大鼠肠道菌孵育液)各5 μL,点于同一硅胶G薄层板上,以CHCl3-MeOH-H2O(70∶15∶2)为展开剂展开,喷以香草醛硫酸试液,于105 ℃加热至斑点显色清晰。结果样品色谱中与对照品TAⅢ在相同位置上顯相同颜色的斑点,阴性对照在相同位置上无相应斑点。由此可初步判断代谢产物为TAⅢ。
4 讨论
对于糖苷类成分而言,苷元是肠道菌群代谢的主要产物。本试验中,大鼠肠道菌群对TBⅡ有较强的代谢作用,孵育8 h时转化率即达到92%,24 h时已检测不到TBⅡ,将代谢产物用甲醇复溶后可以检测到浓度很高的TAⅢ;同时,薄层色谱鉴定显示,样品与对照品在相同位置上显相同颜色的斑点。由此可以初步判定TBⅡ的大鼠肠道菌群代谢产物为TAⅢ,即TBⅡ失去一分子糖,其可能的代谢途径见图8。
图8 TBⅡ代谢途径
中药绝大多数通过口服吸收而发挥药理作用,对于糖苷类药物而言,通常在肠道内很难吸收,生物利用度低,原型药理活性小,需经过肠道菌群的作用,发生代谢转化后发挥其药理活性,被认为是“天然前体药物”。近年来,关于TAⅢ抗肿瘤的研究报道很多,TAⅢ可以诱导人乳腺癌BT474及乳房上皮细胞MCF10A的凋亡[3];能通过线粒体自我吞噬诱发HeLa癌细胞凋亡[4],TAⅢ对黑色素瘤B16和A375、人脑胶质瘤及人胰腺癌PANC-1细胞均具有凋亡作用[5-9]。King F W等[3]研究表明,TBⅡ无抗肿瘤活性,但TAⅢ能诱导多种肿瘤细胞凋亡,且对正常细胞无影响。本研究也比较了TBⅡ、TAⅢ两者的抗肿瘤活性,结果显示TAⅢ对胰腺癌PANC-1细胞有较强的抑制作用,浓度为30 μg/mL时抑制率达97%。可见,TAⅢ具有较高的抗肿瘤药理活性。然而,知母中TBⅡ含量较高,2015年版《中华人民共和国药典》规定不少于3.0%,文献报道最高达10.25%[10];本研究测定结果显示,TAⅢ含量较少,仅为TBⅡ的1/20。本研究结果表明,TBⅡ可较高效率地转化为抗肿瘤活性更强的TAⅢ。这就提供了一种研究思路,即将TBⅡ在体外转化为TAⅢ,本研究为体外大量制备TAⅢ提供了参考与技术支持。
TBⅡ易被大鼠肠道菌群代谢,掌握口服后其在体内的代谢转化规律,可为深入理解其药理作用机制提供帮助,并且,其代谢产物TAⅢ的抗肿瘤药理活性远大于TBⅡ,将其活性代谢产物制成制剂入药,是否能增加药物的生物利用度和药理活性,值得进一步深入研究。
参考文献:
[1] 徐爱娟,韩丽萍,蒋琳兰.知母的研究进展[J].中药材,2008,31(4):624-628.
[2] 王迪,姜艳艳,石任兵.中药知母质量控制方法研究[J].北京中医药大学学报,2011,34(4):263-265.
[3] KING F W, FONG S, GRIFFIN C, et al. Timosaponin AⅢ is preferentially cytotoxic to tumor cells through inhibition of mTOR and induction of ER stress[J]. PLoS One,2009,4(9):e7283.
[4] SY L K, YAN S C, LOK C N, et al. Timosaponin A-Ⅲ induces autophagy preceding mitochondria-mediated apoptosis in HeLa cancer cells[J]. Cancer Res,2008,68(24):10229-10237.
[5] 潘会君,莫小辉,冯彦军,等.知母皂苷AⅢ对人脐静脉内皮细胞增殖和凋亡的影响[J].中国药房,2014,25(43):4049-4051.
[6] 潘会君,陈中建,章丹丹.知母皂苷AⅢ对2种黑色素瘤细胞生长及巨噬细胞活化的影响[J].中国药师,2015,18(2):181-185.
[7] 潘会君,史海霞,陈中建,等.知母皂苷AⅢ对黑色素瘤B16细胞生长和Bax,Bcl-2 mRNA的影响[J].中国新药与临床药理,2015,26(1):48-52.
[8] 潘会君,聂绪强,刘朵,等.4种中药单体对人胰腺癌PANC-1细胞移植瘤生长的影响及分子机制探讨[J].中国中药杂志,2013,38(2):245-248.
[9] 谭希,潘会君,吴伟达,等.知母皂苷AⅢ抑制人脑胶质瘤增殖生长的机制研究[J].中国中药杂志,2017,42(6):1160-1166.
[10] 梁雷,边宝林,王宏洁.不同产地知母药材中芒果苷和知母皂苷BⅡ的含量测定[J].中国实验方剂学杂志,2010,16(16):49-51.
(收稿日期:2017-11-03)
(修回日期:2017-12-25;编辑:陈静)

