可注射型人工骨与异体松质骨治疗骨质疏松性胫骨平台Schatzker II型骨折的植骨效果比较
张爱玲 吕辉照 赵枫 曹杰 李萍 陈少婷
老年骨质疏松性胫骨平台骨折多伴有关节面塌陷,临床上主要采用异体松质骨植骨,但异体松质骨抗压能力差,容易导致关节面塌陷,增加关节炎的风险。可注射型人工骨作为新的植骨材料,具有渗透性好、支撑面积均匀及抗压能力强等优点[1],但用于合并骨质疏松的胫骨平台塌陷性骨折,植骨效果是否优于异体松质骨国内外尚无相关文献报道。我院自2015年8月至2017年3月分别应用可注射型人工骨与异体松质骨治疗骨质疏松性胫骨平台 Schatzker II型骨折,现针对植骨效果报道如下。
1 资料与方法
1.1 一般资料
2015年8 月至2017年3月,我院骨科共收治43例骨质疏松性胫骨平台SchatzkerII型骨折,其中男33例,女10例;年龄51~76岁,平均63.3±5.9岁;受伤原因:摔伤37例,车祸伤5例,高处坠落伤1例;左侧17例,右侧26例,均为单侧骨折;骨折按Schatzker分型均为II型。应用双能X线骨密度仪(美国Hologic公司提供)测量第2-4腰椎骨密度: T值-2.5SD至-3.3SD,平均-2.8±0.2SD。合并伤:内侧副韧带断裂6例,外侧半月副韧带损伤11例,股骨外髁骨折2例。按就诊顺序采用SPSS软件20.0随机数字生成器随机分为治疗组与对照组,其中治疗组17例,应用可注射型人工骨进行胫骨平台关节面下注射植骨;对照组26例,应用异体松质骨关节面下填压植骨。本研究已通过解放军第 180医院伦理管理委员会审核通过(批准文号:PLA180L201501007),所有病人及家属均签署知情同意书及授权书。
1.2 纳入标准与排除标准
纳入标准:X、CT、MRI等影像学检查明确诊断胫骨平台Schatkzer II型骨折;符合WHO推荐的骨质疏松诊断标准[2]:骨密度测量T值≤-2.5SD即可诊断为骨质疏松;患侧膝关节无骨性关节炎病史或膝骨性关节炎Kellgren-Lawrence分期为0期或I期。患侧无膝关节周围骨折病史。排除标准:自身免疫性疾病需长期服用激素者;长期营养不良;有膝关节周围骨折病史者;膝关节骨性关节炎Kellgren-Lawrence分期II期及以上者;精神神经系统疾病,无法配合治疗者。
1.3 手术方法
手术均由同一组人员完成。自髌骨上缘外侧约2.5 cm向下作髌旁外侧弧形切口,根据手术需要延长切口,逐层切开显露骨折端,沿半月板边缘锐性切开,从半月板下方将其抬起显露塌陷的关节面。复位骨折端,放置胫骨平台外侧锁定钢板,远端行螺钉固定。距关节面约2 cm处用骨凿开窗,小心抬起外髁关节面达正常位置,关节面下分别采用冻干异体松质骨(北京鑫康辰医学科技发展有限公司提供)填压植骨或Genex-S慢凝型可注射型人工骨(英国Biocomposites公司提供)注射植骨。钢板近端螺钉固定。逐层缝合关闭切口,放置引流。需要注意的是,Biocomposites公司提供的可注射型人工骨操作指南建议在拉丝期进行加压注射(调配成功后5 min左右),但对于骨质疏松骨折,该操作应在拉丝期前进行操作(调配成功后约2~3 min左右),以利于人工骨浆渗透扩散进骨小梁中,增加植骨的强度和面积(见图1)。
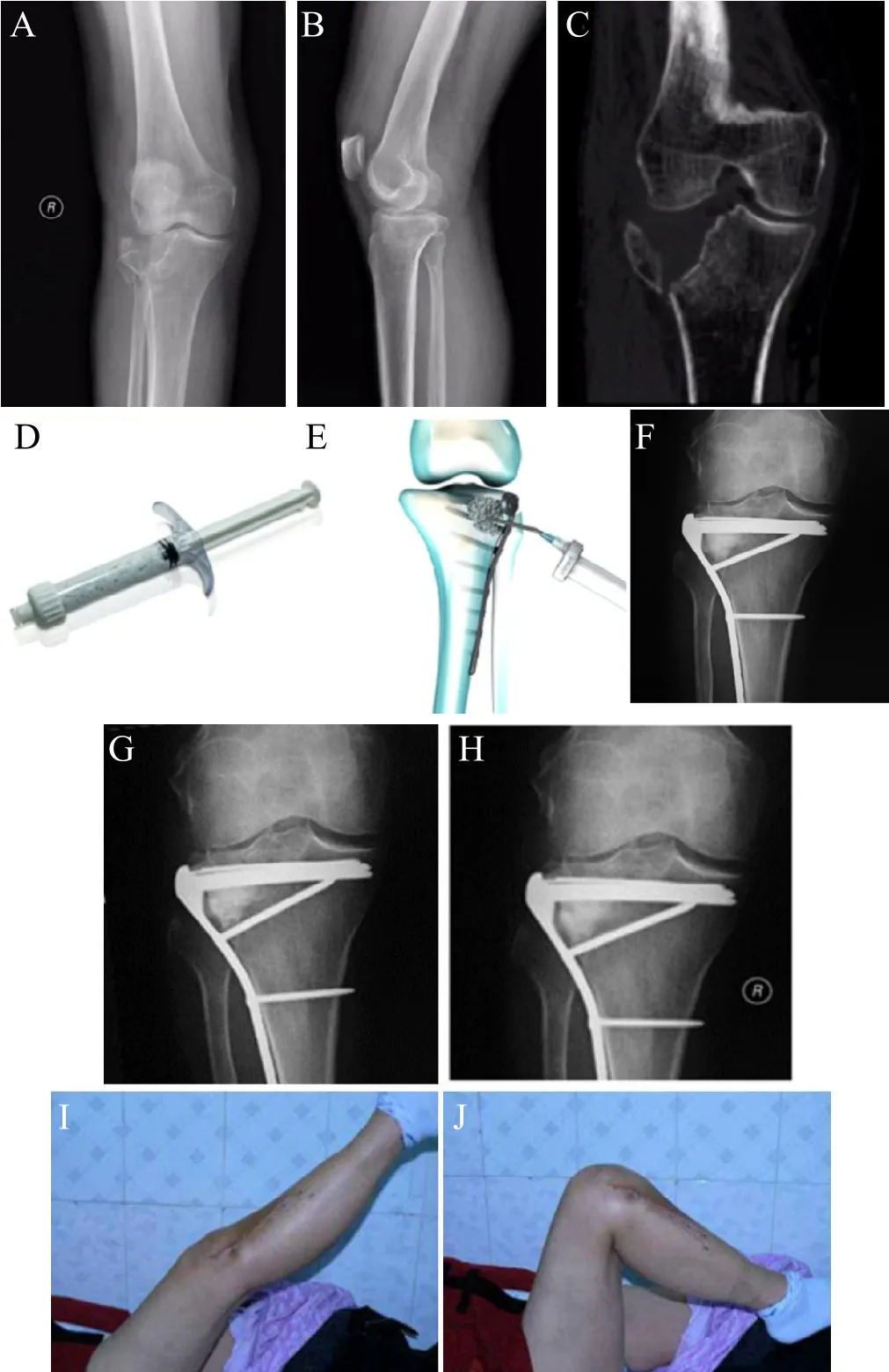
图1,患者,女,63岁,跌倒致右胫骨平台骨折,Schatzker II型。双能X线骨密度检查:T值-2.8SD。A、B术前X线片显示右胫骨平台外侧髁骨折,骨折类型为Schatzker II型;C CT显示关节面塌陷;D Genex-S慢凝型可注射型人工骨加压灌注系统;E可注射型人工骨植骨示意图;F右胫骨平台外侧髁植骨术后X线片显示植骨区密度明显增高,T值达到0.92SD;G、H术后3个月及术后6个月X线片示显示植骨区密度仍然较高,T值分别达到0.90SD与0.81SD;I、J术后膝关节屈伸功能正常。
1.4 术后处理
术后常规使用抗菌素预防感染。术后第2天开始进行抗骨质疏松治疗,治疗方案:唑来膦酸注射液(瑞士诺华医药有限公司)5 mg每天静滴一次;钙尔奇碳酸钙 D3咀嚼片(Wyeth惠氏制药有限公司)600 mg口服1次/日。术后第2天逐步开始膝关节功能锻炼,术后1周开始不负重行走,术后3个月开始部分负重行走;术后6个月完全负重行走。
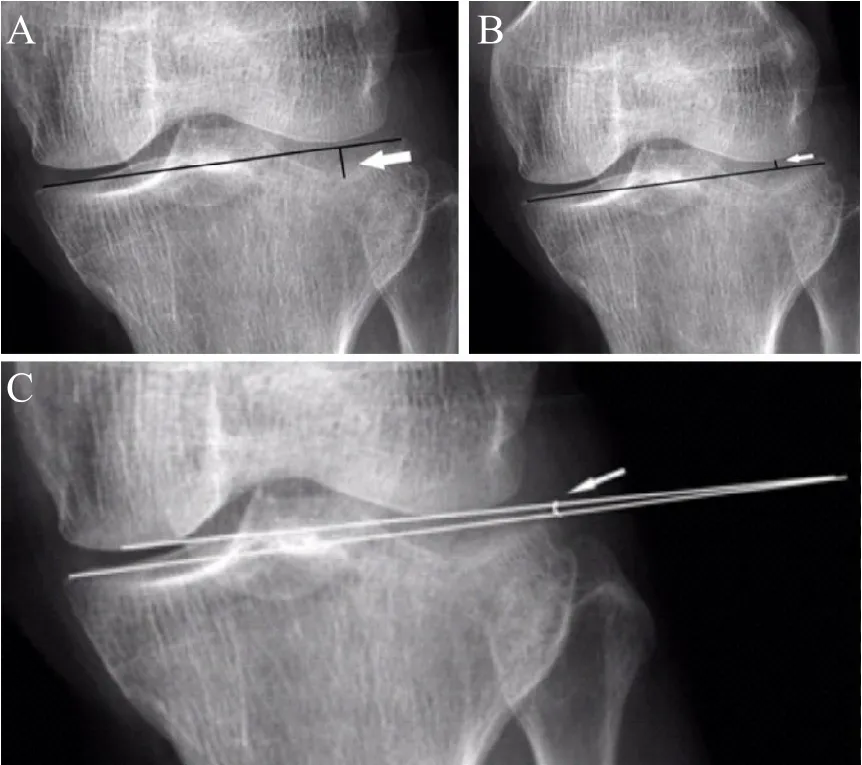
所有病人均获得随访,随访时间12~43个月,平均22.3个月。分别在术后1周内、术后3个月、术后6个月与术后12个月各时间点进行膝关节正侧位X线片及植骨区域骨密度检查,记录胫骨外髁关节面塌陷高度(见图2 A)、膝关节外侧间隙高度(见图2 B)、膝关节外侧间隙角(见图2 C)、植骨区域骨密度[3]。计算术后3个月内、术后3至6个月与术后6至12个月的胫骨外髁关节面塌陷高度差值、膝关节外侧间隙高度差值及膝关节外侧间隙角差值。
1.5 评价指标
胫骨外髁关节面塌陷高度差值:在膝关节正位 X线片上,关节面最凹点至胫骨内、外髁连线的垂直距离,即为胫骨外髁关节面塌陷高度;胫骨外髁关节面塌陷高度差值=后一个时间点的塌陷高度-前一个时间点的塌陷高度。膝关节外侧间隙高度差值:在膝关节正位 X线片上,作胫骨平台内外侧髁的连线,股骨外髁最低点至该连结的垂直距离,即为膝关节外侧间隙高度;膝关节外侧间隙高度差值=前一个时间点的外侧间隙高度-后一个时间点的外侧间隙高度。膝关节外侧间隙角差值:股骨关节面切线与胫骨平台面切线的外侧夹角,即为膝关节外侧间隙角;膝关节外侧间隙角差值=后一个时间点的外侧间隙角-前一个时间点的外侧间隙角。植骨区域骨密度:应用双能X线骨密度仪(美国Hologic公司提供)测量植骨区域骨密度,记录相应的T值。术中进行外髁复位时,会以外侧骨皮质对参照进行复位,可以有效恢复外髁外缘骨质的高度,复位丢失情况较轻。本研究主要研究的术后膝关节参数的变化,统计值是各参数的差值,外髁一定程度的误差对差值的变化无明显影响,不会对统计数据造成误差。
1.6 统计分析
采用SPSS 20.0统计软件包进行分析。计量资料数据以(±s)表示,两组计量资料间比较采用两独立样本 检验;计数资料采用卡方检验;检验水准 =0.05。
2 结果
2.1 两组间可比性分析
两组间的年龄、性别、骨密度 T值比较无统计学差异(>0.05),具备可比性(见表1)。
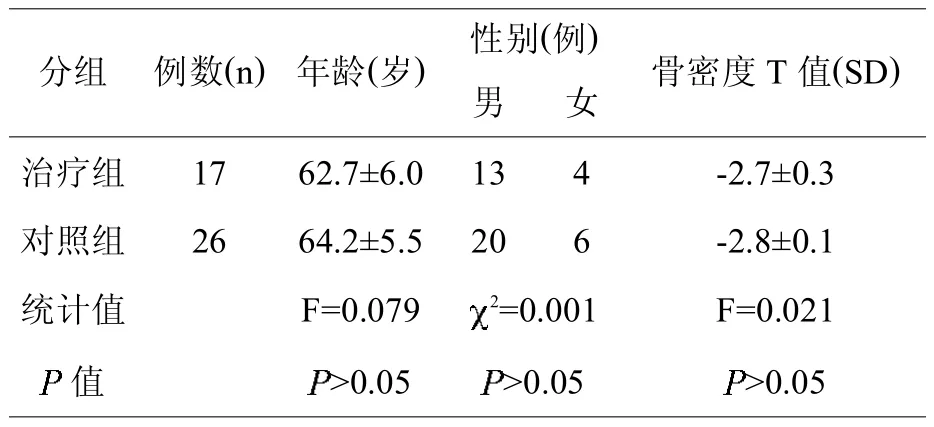
表1,两组间的可比性分析
2.2 抗骨质疏松治疗对骨密度的影响
治疗组与对照组各时间点的健侧胫骨平台骨密度比较差异无统计学意义(>0.05),提示两组间的抗骨质疏松治疗对植骨区骨密度的影响相同,具有可比性(见表2)。
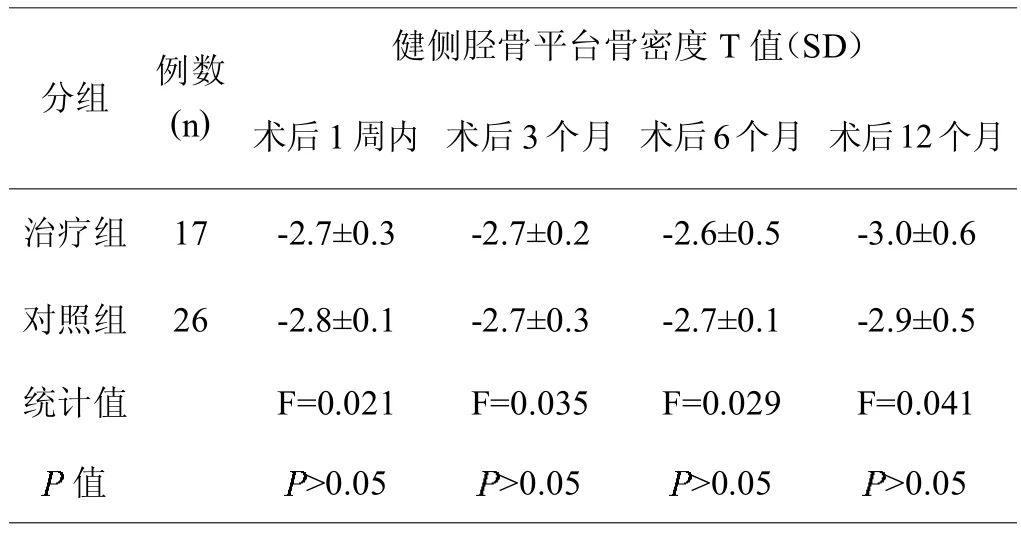
表2,两组间的健侧胫骨平台骨密度T值比较
2.3 胫骨外髁关节面塌陷高度差值
治疗组术后12个月胫骨外髁关节面总体塌陷高度小于对照组,而且各时间点的塌陷高度差值也小于对照组(见表3)。
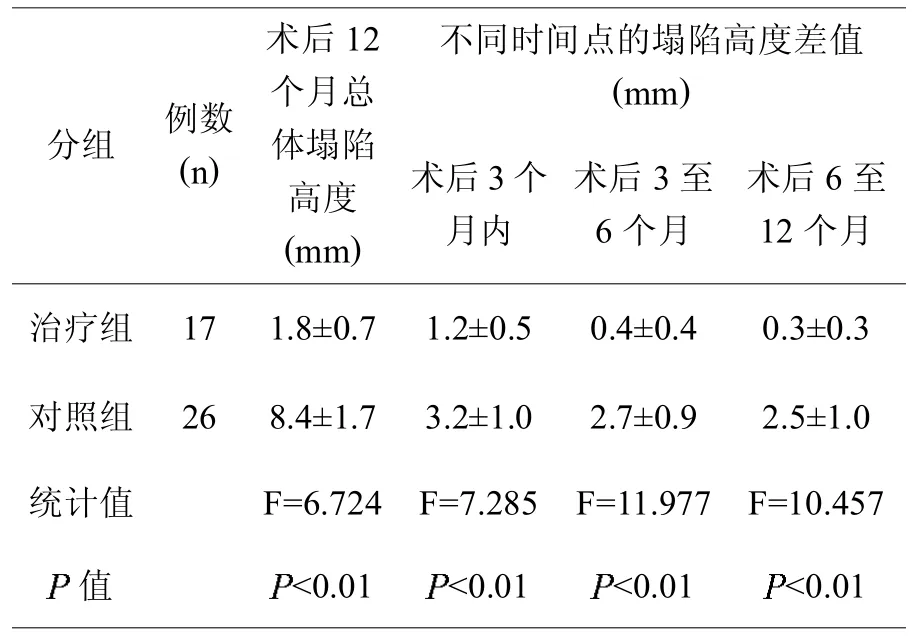
表3,两组间的胫骨外髁关节面塌陷情况比较
2.4 膝关节外侧间隙高度差值
治疗组术后12个月外侧间隙总体丢失高度小于对照组,而且各时间点的膝关节外侧间隙高度差值也小于对照组(见表 4)。
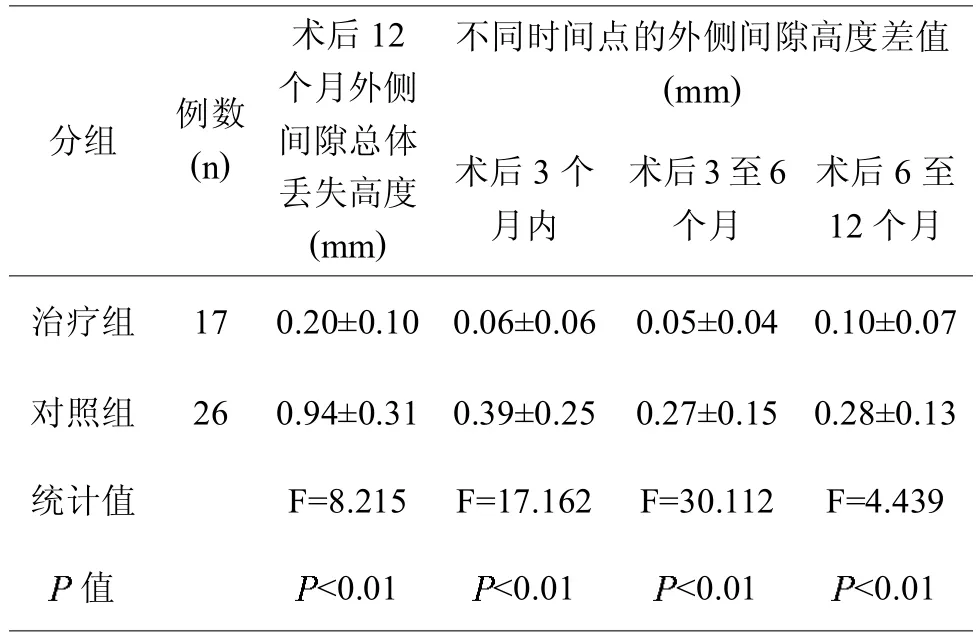
表4,两组间的膝关节外侧间隙高度比较
2.5 膝关节外侧间隙角差值
治疗组术后12个月外侧间隙角总体增加角度小于对照组,而且各时间点的膝关节外侧间隙高度差值也小于对照组,但术后6~12个月的膝关节外侧间隙高度差值与对照组比较无差异(见表5)。
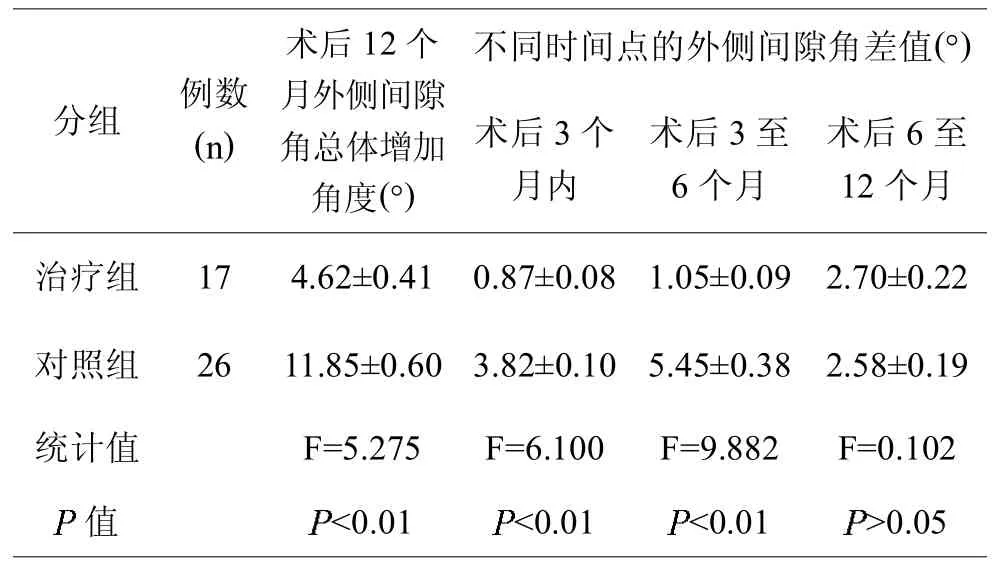
表5,两组间的膝关节外侧间隙角比较
2.6 植骨区域骨密度
治疗组各时间点的植骨区域骨密度 T值均高于对照组(见表6)。
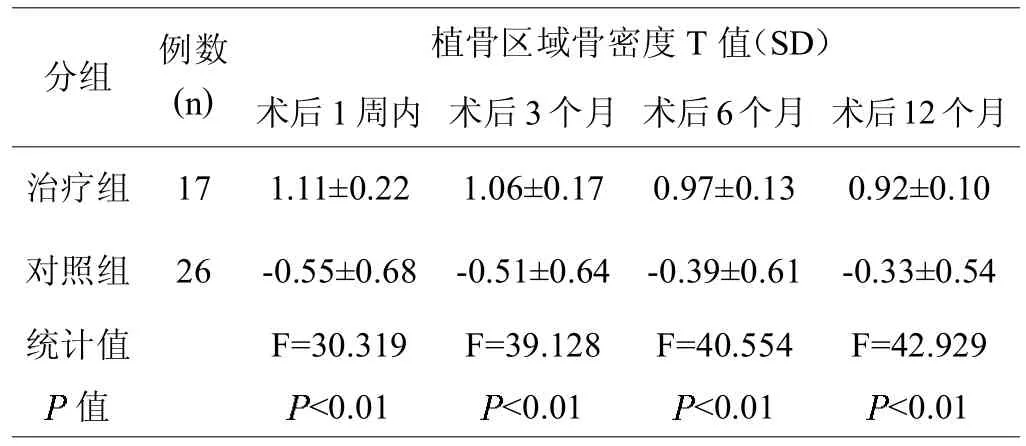
表6,两组间的植骨区域骨密度T值比较
2.7 并发症
治疗组所有病人均未出现切口感染、植骨排异反应,骨折均获得愈合。对照组出现2例排异反应,经换药后分别于术后2个月与术后4个月切口愈合;另1例出现异体骨排异反应后继发感染,经清创取出异体骨、行自体髂骨移植后痊愈。
3 讨论
3.1 骨质疏松性胫骨平台骨折支撑植骨的重要性
随着中国进入老龄化社会,骨质疏松性胫骨平台塌陷骨折较常见,该类型骨折骨质压缩较多,单纯依靠内植物难以获得有效的关节面支撑,容易出现植骨丢失,继发关节内、外翻畸形或骨性关节炎等并发症[4]。此时,关节面的支撑植骨对稳定关节面至关重要,Weaver等报道北美近20年的骨质疏松性关节周围骨折,发现未植骨时的关节面塌陷率是植骨的4~6倍[5]。Heiney等发现50岁以上绝经后妇女胫骨平台骨折行植骨术后关节面平均塌陷约4.2 mm,而非植骨患者平均塌陷约8.7 mm[6]。骨质疏松时骨小梁力学强度减弱,螺钉的切割效应增加,需要在关节面下增加支撑面积,减小局部压强继而减少关节面的下陷,而植骨是增加该支撑面积的有效方法[7]。
3.2 异体松质骨植骨的优点与不足
异体松质骨是临床上最常用的植骨材料,广泛用于骨缺损的植骨,与可注射型人工骨相比,具有来源广泛、操作简单、性价比高及有一定的抗挤压力学性能和骨长入生物性能等优点。但同种异体骨的制备方法使用其存在先天的不足。目前同种异体骨的去抗原方法主要是冷冻干燥法,但冷冻脱水过程中产生的骨小梁微小骨折可导致骨生物力学特性改变,尤其使其脆性增加,抗扭和抗弯强度明显降低[8]。所以异体骨是一种满意的填充植骨材料,在受到外力挤压时,骨小梁容易受到压缩塌陷,难以达到有效的支撑。而且骨质疏松性骨折时,骨小梁组织生物力学强度的下降,更加减弱了异体松质骨的支撑强度。笔者在该研究中发现胫骨平台Schatkzer II型骨质疏松性骨折,采用异体松质骨支撑植骨时12个月内关节面塌陷达到(8.4±1.7)mm,继发的膝关节外侧间隙高度丢失(0.94±0.31)mm、外侧间隙角增加(11.85±0.60)度。同时,本研究中膝关节面塌陷高度和外侧间隙高度在术后3个月内丢失最多,而且随着骨痂的形成逐渐减少,所以笔者认为异体松质骨的早期支撑能力有其不足之处,其力学稳定只有等待骨痂形成后才能获得。
3.3 可注射型人工骨在骨质疏松性胫骨平台骨折中的优势与不足
Genex-S是一种全新的人工合成骨填充材料,相对异体松质骨具有多项优点。极佳的生物兼容性,安全无排异反应[9],笔者发现可注射型人工骨植骨时均未出现排异反应,生物相容性良好,相反,少数的异体松质骨仍存在一定的抗原性,在本研究中出现3例与排异反应相关的切口不愈合与感染,排异反应率约占11.5%。物理抗压性强,注射15~20 min后可完全固化,固化后的强度为松质骨的3倍[10],本研究中可注射型人工骨的局部骨密度T值均在1.0SD左右,位于正常骨密度的高值,强度明显优于异体松质骨。而且凝固快速,具有类似骨水泥的即时稳定性[11],有利于强化关节面的支撑能力,减少早期关节面塌陷。采用Zeta电位控制(ZPCTM)技术和模拟松质骨的微孔结构,通过激发自身细胞活性来诱导并增加蛋白质和骨生长因子吸附的骨填充材料,从而加速新骨生成[12]。可注射型人工骨固化前呈粘稠液态,注射后可根据缺损部位形态任意塑形,进行骨缺损区域的完全填充植骨,克服了固体异体松质骨植骨时存在较多植骨间隙而减弱支撑能力的缺点。同时液态的人工骨具有弥散性能,可以渗透至骨小梁间隙,固化后与骨小梁可以产生“交锁机制”[13],大大加强植骨区域与骨小梁之间的稳定性,尤其适用于骨质疏松骨折的植骨,这是异体松质骨不具备的特性。
Parkkinen等[14]认为关节面植骨术后,关节面下陷最明显的时期在术后3个月内,随着骨痂生长,塌陷程度逐渐减缓。本研究中异体松质骨植骨后3个月内胫骨关节面下陷达到3.2 mm±1.0 mm,这与Parkkinen类似,但术后3~6个月与6~12个月内下陷高度仍达到2.7 mm±0.9 mm和2.5 mm±1.0 mm。笔者认为,由于异体骨尤其是异体松质骨存在较大的骨小梁间隙,该间隙的存在减弱了异体骨的早期生物力学性能,而随着异体松质骨的挤压,支撑能力逐渐增加,直至达到稳定。虽然患者术后3个月内未进行负重,但由于膝关节存在一定的生理外翻角,静息状态下胫骨平台外侧髁持续存在一定的压应力。术后3个月内关节面下陷增加的原因考虑主要与异体松质骨受到该压应力作用时,松质骨骨小梁间隙逐渐受到挤压变小有关。而术后3个月后,由于受到挤压后的骨小梁生物力学性能提高,同时正常骨组织的逐渐长入,所以后期关节面下陷的趋势逐渐受到控制。所以对于骨质疏松性胫骨平台骨折,在骨痂愈合过程中保持持续的关节面支撑能力至关重要。可注射型人工骨的应用可以较好地解决该问题,对于骨质疏松性胫骨平台骨折关节面支撑植骨具有明显的优势。可注射型人工骨植骨区骨密度T值在术后12个月内均保持在1.0SD左右,其带来的结果是术后3个月内的关节面塌陷高度为仅为1.2 mm±0.5 mm,而术后3~6个月及术后6~12个月的关节面塌陷高度只有0.4 mm±0.4 mm与0.3 mm±0.3 mm,相应的膝关节外侧间隙高度差值及外侧间隙角差值均优于异体松质骨。
但可注射型人工骨也有不足之处,其费用较昂贵,性价比差,难以广泛应用。而且可注射型人工骨操作对时间的要求较高,操作复杂,凝固时间对可注射型人工骨在松质骨骨小梁间隙中的弥散影响较大,继而影响植骨支撑效果。
3.4 治疗体会
由于可注射型人工骨具有凝固窗口期,部分国外学者[15]认为Genex-S可注射型人工骨的开始凝固时间约9 min,在拉丝期进行加压注射时植骨效果最佳,但这些研究并未专门针对骨质疏松人群,对于骨质疏松骨折的最佳植骨时机尚未有文献报道。笔者在骨质疏松性胫骨平台骨折的应用中发现,可注射型人工骨在液态期的渗透能力优于拉丝期,有利于人工骨浆扩散至骨小梁间隙中,可以明显增加支撑植骨的强度和面积,所以笔者建议在骨质疏松性骨折的支撑植骨中,应在调配成功后约2~3 min时就开始加压注射。
3.5 本研究的局限性
首先,虽然应用可注射型人工骨的所有17例病人均未出现感染、排异反应或骨不愈合等并发症,显示了满意的生物相容性,但该研究中纳入的病例数相对较少,可注射型人工骨作为一种人工材料,其临床效果及并发症尚需大样本临床验证。其次,由于骨质疏松患者胫骨关节面的沉降,大部分都存在胫骨内侧髁关节面不同程度的凹陷,即使在标准X线片上也可能会出现“双凹征”。这种情况对膝关节各种测量指标的是否存在影响或者影响的程度大小尚无文献报道。但笔者认为胫骨平台关节线的标注是以胫骨平台内、外侧缘为参照,对膝关节外侧间隙高度和外侧间隙角的测量影响较小,但拍片时 X线投照角度与后倾对胫骨外髁关节面塌陷高度的测量可能存在系统误差,但该误差对本研究是否存在偏倚,尚需进一步研究。最后,可注射型人工骨在注射后可渗透至周围骨小梁间隙内,对局部松质骨有一定的强化作用,理论有预防骨折再蹋陷的作用,但弹性模量的差异,是否容易造成新的骨折,尚需在远期随访中观察。
综上所述,在骨质疏松性胫骨平台Schatkzer II型骨折的治疗中,可注射型人工骨的植骨强度与稳定性优于异体松质骨,可能是一种适用于骨质疏松性骨折支撑植骨的良好生物填充材料。
[1] Masala S,Nano G,Marcia S,et al.Osteoporotic vertebral compression fracture augmentation by injectable partly resorbable ceramic bone substitute(CeramentTM|SPINESUPPORT):a prospective nonrandomized study[J].Neuroradiology,2012,54(11):1245-1251.
[2] Kanis JA.Assessment of fracture risk and its application to screening for postmenopausal osteoporosis:synopsis of a WHO report[J].Osteoporos Int,1994,4(6):368-381.
[3] 张益英.骨与关节X线图解-正常、正常变异与损伤[M].北京大学医学出版社,2007,231-235.
[4] Horwitz DS,Kubiak EN.Surgical treatment of osteoporotic fractures about the knee[J].Instr Course Lect,2010,59(12):511-523.
[5] Weaver MJ,Harris MB,Strom AC,et al.Fracture pattern and fixation type related to loss of reduction in bicondylar tibial plateau fractures[J].Injury,2012,43(6):846-869.
[6] Heiney JP,Kursa K,Schmidt AH,et al.Reduction and stabilization of depressed articular tibial plateau fractures:comparison of inflatable and conventional bone tamps:study of a cadaver model[J].J Bone Joint Surg Am,2014,96(15):1273-1279.
[7] 邱贵兴,裴福兴,胡侦明,等.中国骨质疏松性骨折诊疗指南(骨质疏松性骨折诊断及治疗原则)[J].中华骨与关节外科杂志,2015,8(5):371-375.
[8] Bauer TW,Muschler GF.Bone graft materials.An overview of the basic science[J].Clin Orthop Relat Res,2000,2(371):10-27.
[9] Ishiguro S,Kasai Y,Sudo A,et al.Percutaneous vertebroplasty for osteoporotic compression fractures using calcium phosphate cement[J].J Orthop Surg(Hong Kong),2010,18(3):346-351.
[10]Friesenbichler J,Maurer W,Sadoqhi P,et al.Adverse reactions of artificial bone graft substitutes:lessons learned from using tricalcium phosphate gene X[J].Clin Orthop Relat Res,2014,472(3):976-982.
[11]Evaniew N,Tan V,Parasu N,et al.Use of a calcium sulfate-calcium phosphate synthetic bone graft composite in the surgical management of primary bone tumors[J].Orthopedics,2013,36(2):216-222.
[12]Yang HL,Zhu XS,Chen L,et al.Bone healing response to a synthetic calcium sulfate/-tricalcium phosphate graft material in a sheep vertebral body defect model[J].J Biomed Mater Res B Appl Biomater,2012,100(7):1911-1921.
[13]Ryu KS,Shim JH,Heo HY,etal.Therapeutic efficacy of injectable calcium phosphate cement in osteoporotic vertebral compression fractures:Prospective nonrandomized controlled study at 6-month follow-up[J].World Neurosurg,2010,73(4):408-411.
[14]Parkkinen M,Lindahl J,Makinen TJ,et al.Predictors of osteoarthritis following operative treatment of medial tibial plateau fractures[J].Injury,2017,11(14):1383-1390.
[15]Saadoun S,Macdonald C,Bell BA,et al.Dangers of bone graft substitutes:lessons form using GeneX[J].J Neurol Neurosurg Psychiatry,2011,82(8):944-946.

