基于Reason模型的医疗器械不良事件的影响因素研究
朱未 胡少科
医疗器械在疾病的诊断、监护和治疗中发挥举足轻重的作用,但潜在的风险会对患者造成严重后果,直接伤害或死亡。医疗器械直接或间接地作用于人体,存在不同程度的风险,其本身质量问题,使用、管理不当,都会影响到医疗、护理的质量,甚至危害病人的生命安全[1]。2016年我国药品不良反应监测中心收到由医疗器械造成严重伤害的可疑不良事件报告共52331份,死亡可疑不良事件报告181份。近年来医疗器械引发的安全事件数量逐渐增多,医疗器械应用安全风险是必须正视的问题[2]。
1 资料与方法
1.1 文献分析
查阅 2013~ 2016年度国家食品药品监督管理总局(CFDA)发布《国家医疗器械不良事件监测年度报告》等资料,以“医疗器械”、“不良事件”、“医疗安全事件”、“案例”等检索关键词,在CNKI、万方、维普和PubMed中文库等数据库检索2013~2017近五年的期刊文献。
1.1.1 文献评级标准及分类
根据文献的来源、案例数量、研究内容分为四个级别:A级为个案式研究、有确切的研究方法或大数据统计分析,B级为通则式研究或中等数据统计分析,C级为系统性评价或综述类,D级为管理类或经验总结类。
1.1.2 数据选取与分析
以医疗器械不良事件系统评价和案例研究为切入点,对文献中的医疗器械不良事件案例进行全面、客观、系统的收集。本研究符合标准的文献共纳入273篇,其中 A级文献12篇,B级文献29篇,C级文献79篇,D级文献153篇(见表1)。在这273篇文献中,仅有74篇文献(占比27.1%)可以作为医疗器械不良事件影响因素研究的证据来分析,证据文献来源:A级文献12篇,B级文献21篇,C级文献24篇,D级文献17篇。
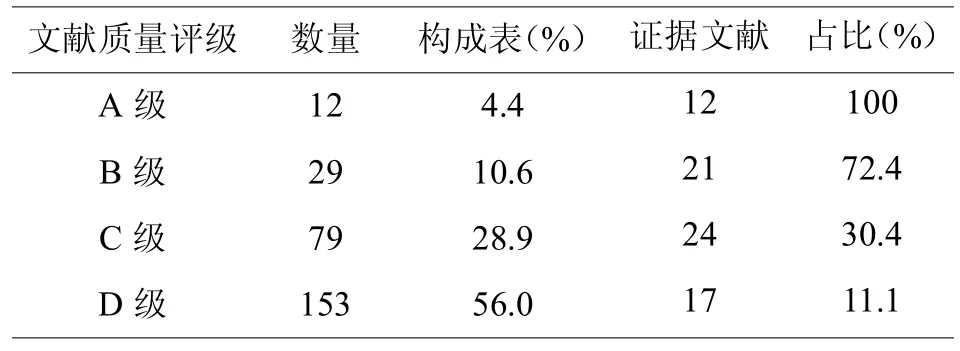
表1,纳入的文献分类
1.2 Reason模型在医疗不良事件分析的应用
1990年,Reason模型由英国曼彻斯特大学的Reason教授首先提出[3],最初在航空事故调查和分析的常用模型。后来广泛应用于各领域的安全事件分析,并能帮助建立系统性的安全和事故预防,尤其是近年来在医疗卫生领域中应用。在医疗系统中,Reason模型已成为分析不良事件的理论框架[4]。
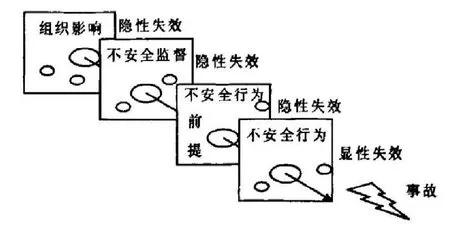
图1,Reason事故的致因模型。
Reason模型通常将导致不良事件的原因分为四个方面:组织影响、不安全监督、不安全行为的前提和不安全行为。图1可以看到,不安全行为往往是导致不良事件发生最直接的原因,也是第一层;组织因素是导致不良事件发生的主体,是最高级别的影响,一般容易被忽略。Reason模型是一个广泛、层次分明的模型,强调组织管理,善于探索根本原因。但其缺陷在于没有明确定义在航空器事故中奶酪模型“洞”的具体含义[5]。在本文也采用Reason模型来分析。
2 结果
2.1 医疗器械不良事件案例统计分析
在2013年至2017年间,研究学者针对某类医疗器械不良事件报告案例研究,涵盖不良事件发生的医疗机构、医疗器械类型及案例分析。如表2所示选取部分国内学者的研究案例[6-16],囊括了输液泵、阴道扩张器、臭氧治疗仪、中频电疗仪等设备,以及骨科内植入物、体外诊断试剂、静脉留置针、人工髋关节、Y型接头和接骨板等医用耗材,对这些品类的医疗器械不良事件的影响因素进行详尽分析。
2013~2017 年CFDA发布《医疗器械不良事件信息通报》涉及骨科植入物材料接骨板和人工髋关节,以及医用电子直线加速器、导尿管、特定电磁波治疗仪、熏蒸类设备、血管造影 X射线机、体外除颤器和低频电磁治疗设备等医疗器械。证据文献基于CFDA重点警讯的案例展开研究,对于发生医疗器械不良事件影响因素分析具有积极的意义。例如,国内学者石铸等人[7]选取126例骨科内植入物的不良事件临床分析,对内植入物断裂、骨不连、排异的影响因素进行全面的分析;学者张竞等人[15]对122例人工髋关节不良事件影响因素分析认为,包括设计问题、材料缺陷、诊断失误、假体初次使用稳定性不好、感染和未知原因导致术后早期疼痛。这些案例研究能充分表明某一类医疗器械不良事件影响因素的规律性、客观性及其必然性,对于系统研究医疗器械不良事件的成因具有参考和借鉴意义。

表2,国内医疗器械不良事件研究案例摘录
2.2 医疗器械不良事件的影响因素分析
在医疗领域,人的失误通常是致命的因素,导致人的失误常常包括人、机、环境和组织等因素的综合影响。应用Reason模型进行医疗器械不良事件分析时,同样可以借鉴其在航空领域中的应用原则,即:不安全行为--不安全行为的前提--不安全的监督--组织因素[4]。如图2所示,医疗器械不良事件的Reason致因模型。医疗器械本身的风险属性,在组织管理、临床试验监管、产品设计、物流管理和临床使用环节的“漏洞”中出现隐形失效,导致医疗器械不良事件发生。
组织管理因素可从准入管理、生产监督管理和全生命周期管理三个方面进行分析。组织错误是个体行为人在决策时由于知识经验的不足而出现人因失误,且没有及时发现、控制,从而转化为管理制度、流程、规则、程序、决策上的缺陷。如未经过临床试验阶段的植入类骨科耗材直接开始试用于人体,不合格的医疗器械被批准投放到市场,或者医疗器械在使用过程中出现故障,被隐瞒继续用于患者治疗。
不安全的监督在这里主要是指临床试验监管和产品设计要求的过程监管。这些过程监管失误导致的后果是灾难性的,如临床试验数据造假、隐瞒无效数据等,都会直接影响医疗质量和临床产出。
不安全的行为前兆包括物流的疏忽或过错、包装的完整、温湿度要求等。例如消毒不彻底,包装破损等导致患者感染事件,温度过高、过低导致医用耗材失效。
不安全的行为主要体现在临床使用环节中人的失误。医疗器械的临床使用风险是由医护人员、病人和工程技术人员共同组成一个复杂环境带来的安全问题,例如器械熟悉程度、患者配合依从程度,以及设备日常维护保养情况。
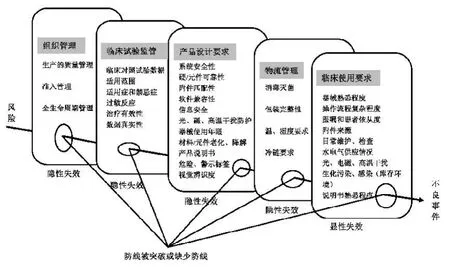
图2,医疗器械不良事的Reason致因模型。
3 讨论
3.1 对不良事件应该明晰的、正确的认知
目前,大多数文献中将医疗器械在使用过程中出现故障等同于不良事件,这是对医疗器械不良事件概念的误解。根据 CFDA对医疗器械不良事件的定义,可以将不良事件归纳为四个要件,即“批准上市且质量合格”、“正常使用”、“导致或可能导致伤害”。因此,医疗器械出现故障造成的潜在伤害并不能直接等同于不良事件。
文献[6-8,10,11]将医疗器械不良事件归因于医护人员的操作失误,例如本文的证据文献中医疗器械不良事件出现频次最高的“操作不当”、“操作问题”,即认为医护人员是导致不良事件的主体,这也影响到医疗器械不良事件上报的积极性。医疗器械上市前是否开展过可用性测试,是否更好的满足人工效学的要求,设计是否更符合临床操作习惯,等而这些问题是影响人的操作最主要的因素[17]。例如,手术骨钳手柄设计过短导致使用时用力不均造成患者伤害;医疗器械说明书字体过小、内容过多,医生缺乏耐心或阅读易疲劳忽略重要内容导致的医疗不良事件……因此,不能简单地将医疗器械不良事件归结于人的操作失误,应该对其树立正确的认识,追根溯源,系统性的分析和研判失误的原因。
3.2 对医疗器械全过程把关
上市前产品设计阶段对医疗器械功能定位、技术管理和价值理念,是决定生产企业生存力和竞争力的核心要素;临床试验阶段是对设计出的医疗器械在安全性、有效性方面的验证和完善的过程,是监管机构对医疗器械准入上市和监管的依据;上市后产品的制造、运输、库存阶段存在的隐患会直接反映医疗器械的质量和可靠性,经营企业为直接利益攸关方;而临床阶段医疗器械使用安全则是医疗机构关注的重点。
这些影响因素的失误是导致医疗器械不良事件最根本的原因。例如婴儿培养箱在产品设计阶段由于硬件可靠性缺陷,在临床使用时导致新生儿伤害事件;某类接触角膜镜在临床试验阶段数据造假,导致上市后客户使用过程中出现大量不良反应报告[2,13,17]。因此,医疗器械不良事件影响因素是生产企业、经营企业、医疗机构及医疗器械监管机构各自严格把关的出发点和发力点,对这些影响因素进行精确的管控和把关,能够较大程度提高医疗器械临床使用安全,避免或减少医疗器械不良事件的发生。
3.3 医疗器械上市前可靠性要求
传统观点认为,医疗器械使用安全在于医疗器械的安全性和有效性。大量文献研究表明,医疗器械在临床使用是安全、有效的,但产品的质量问题导致不良事件是主要原因,可靠性亦是重要影响因素。医疗器械生产企业在保证安全性和有效性的同时,应注重医疗器械的可靠性,即医疗器械应该具有稳定的性能,体现在材质的稳定性能、电子元器件的可靠、对使用环境的耐受力[18]。
因此,在上市前临床试验阶段,同期开展医疗器械可用性测试[19]和可靠性评估很有必要。可靠性评估应包涵设计、工艺、材料、制造技术等方面,是医疗器械安全和有效的基本保证,是杜绝不良事件发生的基础条件。
3.4 医疗器械临床使用风险管控
医疗机构对器械准入管理,不仅仅体现在医疗器械的安全性和有效性,还应基于医疗器械购置的经济性和功能技术评估等方面综合考虑;在临床使用阶段,应开展医疗器械使用培训,促进使用人员对器械操作、功能的熟练,规范操作,进一步降低医疗器械临床使用风险。针对风险级别较高的医疗器械开展预防性维护,避免“带病”工作产生的掣肘,减少安全风险事件的发生。
4 结论
医疗器械的系统安全风险管理是由上市前到临床使用各环节参与的人、机和环境等组成一个复杂的系统而完成的。医疗器械不良事件的影响因素映射为产品在组织管理、临床试验监管、产品设计、物流管理和临床使用环节中出现的“漏洞”中的隐形失效,这些隐匿性问题未得到有效解决,会影响医疗器械临床使用安全,也是导致临床使用时潜在患者伤害的根源。医疗器械临床使用风险的控制,在于对医疗器械不良事件的隐匿性因素的控制,即上市前的医疗器械安全性、有效性和可靠性要求和上市后全生命周期的质量控制,构成了一个连续的、持续改进的管理闭环。
[1] Shuman EK,Chenoweth CE.Reuse of Medical Devices:Implications for Infection Control[J].Infectious disease clinics of North America,2012,26(1):165-172.
[2] 施跃.2016年国家医疗器械不良事件监测年度报告发布数量持续增长质量不断提升[J].中国食品药品监管,2017,(05):15-17.
[3] Reason J.James Reason:patient safety,human error,and Swiss cheese.Interview by Karolina Peltomaa and Duncan Neuhauser[J].Qual Manag Health Care,2012,21(1):59-63.
[4] 李艳,谢晖,孙婷,等.Reason模型及其在医疗领域中的应用现状[J].解放军护理杂志,2016,33(11):29-32.
[5] 耿增显,赵嶷飞,孟令航,等.基于Reason模型的航空器事故调查分析软件设计[J].中国民航大学学报,2013,31(03):6-9.
[6] 卞蓉蓉,郑建立,徐厚明,等.16706例可疑医疗器械不良事件报告分析[J].中国医疗器械信息,2014,(3):37-41,50.
[7] 石铸,马江川,陈江,等.126例四肢骨折骨科内植入物不良事件临床分析[J].黑龙江医学,2014,38(10):1156-1157.
[8] 简永耀,王铁柱,杨建林,等.567例阴道扩张器不良事件分析[J].中国医疗器械杂志,2014,38(6):439-441.
[9] 曲婷婷,崔昊.113例输注泵不良事件报告分析[J].中国医疗设备,2014,(12):64-65,68.
[10]李尧,王新敏,卞蓉蓉,等.体外诊断试剂519例可疑不良事件报告分析[J].药学与临床研究,2015,(6):593-595.
[11]赵瑛,黄璞,黄晖,等.136例妇科臭氧治疗仪不良事件分析[J].药物流行病学杂志,2016,25(04):251-253.
[12]梁健健,文良东.安徽省206例静脉留置针不良事件分析[J].黑龙江医药,2015,28(02):417-419.
[13]蒋贻芳,高小坤.医院可疑医疗设备不良事件的分析与对策[J].中国医学装备,2016,13(12):20-24.
[14]杨飞,钟蕾,焦立公,等.北京市医疗机构中频电疗仪使用情况调查报告[J].中国医疗设备,2016,31(12):124-127,130.
[15]张竞,唐杞衡,邵宏翊,等.人工髋关节置换可疑不良事件的报告分析[J].骨科临床与研究杂志,2017,2(4):219-222.
[16]朱洁,刘宝林.接骨板不良事件的成因分析与对策[J].产业与科技论坛,2017,16(11):39-40.
[17]刘远,陈文霞,李甜,等.医疗器械不良事件案例分析[J].中国医学装备,2016,13(9):119-120.
[18]谢松城.医疗器械临床使用风险及其对护理质量的影响[J].中国护理管理,2010,10(10):5-7.
[19]Yadin David,张强,周丹,等.基于医院的临床工程项目必须以质量和安全为目标[J].中国医疗设备,2014,(8):1-4,57.

