hMSCs与同种异体骨共培养及其在促红素诱导下的成血管效应*
万岷金相廷张幸 黄俊 陈桂林 夏红枝 李东洋 卢振刚 刘希娥
股骨头缺血性坏死临床十分常见,常用治疗方法包括早期自体腓骨打压植骨等保头治疗和晚期金属假体置换。早期的各种保头疗法效果并不确定,我们认为其原因在于无法解决坏死区域的再血管化问题。间充质干细胞(mesenchymal stem cells,MSCs)属于多功能干细胞,具有多项分化潜能,在不同诱导条件下可分化为骨、内皮、脂肪、肌肉、韧带等多种组织细胞,可作为种子细胞用于修复损伤的组织器官[1-3]。有学者研究证实促红细胞生成素(erythropoietin,EPO)可以促进hMSCs增殖并向血管内皮细胞分化,促进血管的形成[4-6]。本研究旨在观察hMSCs与同种异体骨材料共培养细胞增殖情况及在EPO诱导下干细胞向血管内皮细胞转化的情况,以期为股骨头缺血坏死的早期治疗探索一种新的治疗方向。
1 材料与方法
1.1 材料
1.1.1 主要材料来源
同种异体骨材料(北京大清生物),冻存人骨髓间充质干细胞(human mesenchymalstem cells,hMSCs,广州赛业生物)。
1.1.2 主要试剂和仪器
Cell Counting Kit-8试剂(日本Dojindo公司),hMSC完全培养基(广州赛业生物),离心机(美国Beckman公司),离心管,恒温水浴箱(上海恒一公司),细胞培养瓶,细胞培养箱(美国Thermo公司),移液器(德国Eppendrof公司),PBS(武汉博士德),0.25%胰酶(美国ThermoFisher公司),促红细胞生成素(EPO,美国 Peprotech公司),4%多聚甲醛(武汉博士德),兔抗 von willebrand factor(VWF)多克隆抗体(美国 Santacruz公司),兔抗血管内皮生长因子(Vascular endothelial growth factor,VEGF)多克隆抗体(美国CST公司),兔抗血小板内皮细胞粘附分子(Platelet endothelial cell adhesion molecule 1,PECAM-1)多克隆抗体(美国 Santacruz公司),荧光标记的羊抗兔IgG(北京中杉金桥公司),荧光显微镜(日本Olympus公司),酶标仪(美国Thermo公司),细胞培养板(美国Corning公司)。
1.2 方法
1.2.1 细胞增殖率测定
取冻存hMSCs一支,放入37℃水浴箱中解冻,800 rpm,室温下离心5 min,吸取上清液,加入1 mL新鲜hMSC完全培养基,吹散细胞沉淀,移入25 cm2细胞培养瓶中,加入2 mL培养基,放入37℃,5%CO2细胞培养箱中。第二天复苏细胞换液,其后每2~3天换液,待细胞融合率达90%,将细胞培养瓶中的细胞用0.25%胰酶消化,用新鲜培养基制成10000个/mL的细胞悬液。将骨材料反复双蒸水冲洗浸泡后切成0.5 cm×0.5 cm×0.5 cm大小,放入96孔板中。将细胞悬液加入孔中,放入37℃,5%CO2细胞培养箱中。96孔板中以添加骨材料者为实验组,未添加者为对照组,每组8孔。接种细胞1,2,3,4天后,将CCK-8(CellCounting Kit-8)用培养基1∶10稀释备用,吸去孔中旧培养基,每孔中加入100 uL稀释好的CCK-8,放入细胞培养箱中培养2 h,每孔吸出90 uL至新的96孔板中,用酶标仪测量450 nm波长吸光度值(OD值),测得的OD值(A450 nm)与细胞增殖数成正比。每个时间节点各组均取5孔测量并计算增殖率。
hMSCs增殖率=(各时间点细胞总数-首日接种存活细胞数)/首日接种存活细胞数×100%
1.2.2 诱导实验
材料组(A组)将同种异体骨材料反复双蒸水冲洗浸泡后切成0.5 cm×0.5 cm×0.5 cm大小,放入15 mL离心管中。将细胞培养瓶中细胞用0.25%胰酶消化,用新鲜培养基制成10000个/mL的细胞悬液,用移液器吸取400uL细胞悬液,加入骨材料中,放入 37℃,5%CO2细胞培养箱中。12 h后待细胞贴壁,每个离心管中分别加入1 mL正常培养基和1 mL含EPO浓度为1ng/mL的培养基,放入37℃,5%CO2细胞培养箱中。非材料组(B组)离心管中不加入骨材料,其余同A组。非诱导组(C组)离心管中加入骨材料,但不加入EPO,其余同A组。各组每3天换液一次,连续60天。将各离心管中细胞用0.25%胰酶消化,用新鲜培养基制成1000个/mL的细胞悬液,将细胞悬液滴入预先准备好的细胞爬片上,放入37℃,5%CO2细胞培养箱中。2天后细胞已在爬片上完全伸展,吸取培养基,用 PBS漂洗一次,加入4℃预冷的4%多聚甲醛固定。各组均制作24张爬片。对PECAM-1、VEGF、VWF三种标记物进行免疫荧光染色,每种标记物每组抽取8张爬片染色,于荧光显微镜下观察拍照。
1.3 图像软件分析
应用ImageJ1.51k图像分析软件(NationalInstitutesofHealh,USA)进行细胞数量评估。每张爬片均随机抽取一张视野照片,应用软件测量视野中细胞个数,并除以测量面积,从而得到相对细胞密度值,用以估算各组所观察细胞数量。
1.4 统计学分析
使用SPSS 19.0统计软件,资料数据以(±s)表示。增殖率各时间点两组间比较采用配对样本 检验,诱导实验各组间比较采用随机区组设计资料的方差分析。
2 结果
2.1 移植后干细胞增殖率
干细胞移植后2~4天,可见两组hMSCs细胞增殖数量均随培养时间逐渐增加,第4天,实验组及对照组增殖率分别为(486.74±33.84)%,(489.47±59.34)%。各时间点实验组与对照组细胞增殖率无明显差异(值均>0.05,见图1)。说明同种异体骨材料与hMSCs共培养条件下,同种异体骨材料对hMSCs增殖无明显影响。
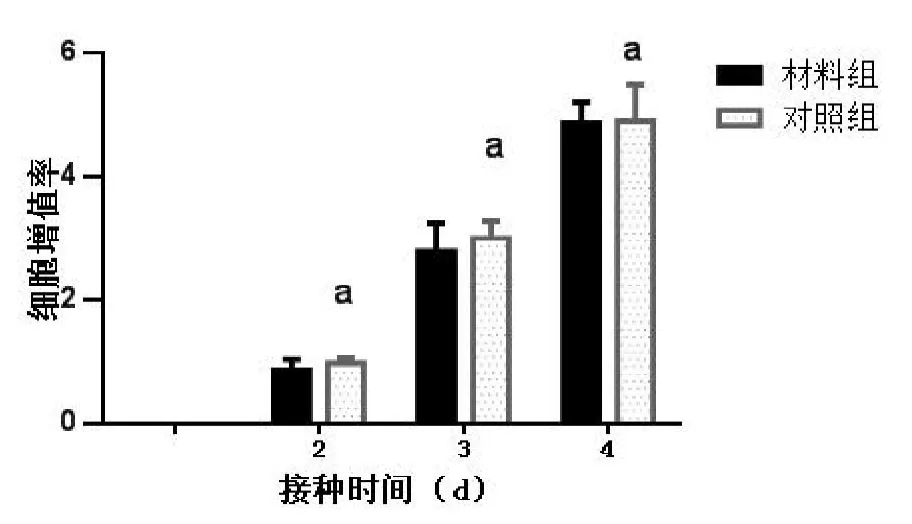
图1,两组孔板接种hMSCs细胞后不同时间点细胞增殖率比较。
2.2 EPO诱导干细胞情况
2.2.1 免疫荧光染色观察
荧光显微镜下观察可见C组三种标记物均无明显表达,A组及B组血管内皮细胞标记物PECAM-1、VEGF、VWF荧光染色均有表达,阳性细胞发出高亮红色荧光。且A组、B组荧光表达情况与C组对比差异明显(见图2-4)。说明在hMSCs与同种异体骨材料共培养情况下,EPO对hMSCs仍有明显的成血管诱导作用,而单独应用同种异体骨材料并不能显著促使hMSCs向血管内皮细胞分化。
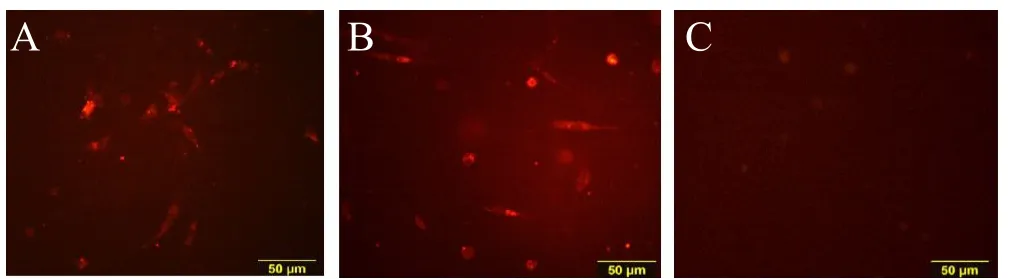
图2,免疫荧光染色PECAM-1表达情况(彩图见插页)。
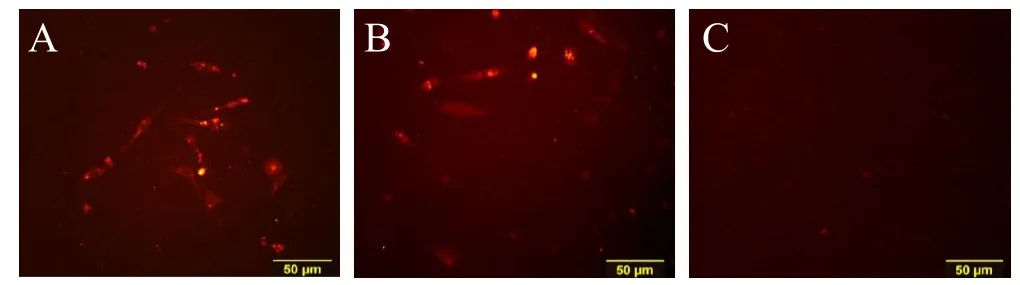
图3,免疫荧光染色VWF表达情况(彩图见插页)。
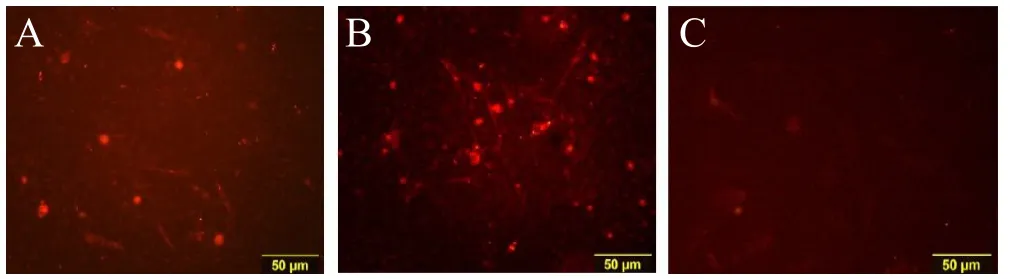
图4,免疫荧光染色VEGF表达情况(彩图见插页)。
2.2.2 图像分析软件分析结果
ImageJ图像分析软件进行荧光染色粒子计数。A组PECAM-1、VEGF、VWF三种血管内皮标记物阳性细胞数(分别为 174.13±28.02/mm2,487.38±43.09/mm2,375.25±44.12/mm2)均明显高于C 组(分别为 44.50±18.81/mm2,63.13±18.90/mm2,41.62±10.06/mm2,均<0.01),但A组与B组间无明显统计学差异(均>0.05,见图5)。说明同种异体骨材料对于EPO的诱导hMSCs成血管作用无明显影响。
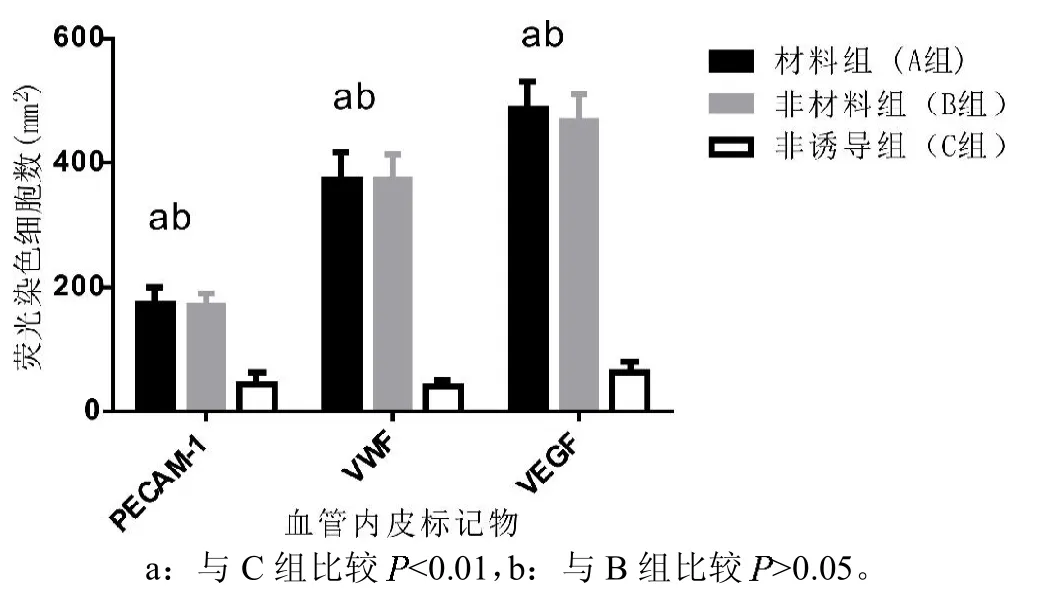
图5,血管内皮标记物表达情况。
3 讨论
我国已进入老龄化社会,临床上股骨头缺血坏死的发生率也逐年增高。股骨头缺血坏死可以造成髋关节疼痛并影响髋关节的活动功能,可导致股骨头塌陷并形成骨性关节炎[7-9]。目前股骨头坏死的具体发病机制仍不十分明确,但目前普遍认为与多种因素引起的股骨头血供障碍密切相关[10,11]。研究表明股骨头髓芯钻孔减压联合自体骨髓细胞注射移植治疗早期股骨头缺血坏死与单独钻孔减压相比可以提高治疗髋关节疼痛、活动障碍等方面的效果[12,13]。这可能与hMSCs的成血管效应最终促进了局部循环的改善有关。EPO一般情况下由肾脏的肾小管旁细胞分泌,可促进红细胞的增殖,EPO还可促进hMSCs增殖,并促进hMSCs向血管内皮分化,引导血管内皮细胞归巢,促进血管形成。同时有研究表明 EPO还可促进血管内皮生长因子的表达并可抑制成骨细胞、骨细胞的凋亡[14]。临床治疗过程中发现植入干细胞需要良好的支架,否则无法解决细胞在植入区的定植及分化,同种异体骨经过医学处理后排异性最小,其松质骨的孔洞也有利于细胞附着及新生组织长入,因此,如果能够在股骨头缺血坏死的早期手术清除坏死骨组织,植入复合hMSCs的同种异体骨材料,并通过 EPO诱导使 hMSCs向血管内皮迁延、分化,促使血管形成,势必可以改善骨坏死、骨缺损的局部血液循环,增加营养供应,从而提高疾病的治疗效果。
血管内皮生长因子(VEGF)参与血管内皮细胞的增殖和迁移,对血管的发生形成起着至关重要的作用[15]。血小板内皮细胞粘附分子(PECAM-1)又称CD31,是一种内皮细胞连接分子,广泛分布于血管细胞[16]。血管性血友病因子(VWF)是由血管内皮细胞分泌的一种糖蛋白,有着重要的止血作用,可促进血小板的粘附和聚集,并可与凝血因子Ⅷ结合起到稳定因子Ⅷ的作用[17]。相关研究中也常将PECAM-1、VWF作为血管内皮标记物进行检测。本实验通过将hMSCs与同种异体骨材料体外共培养,结果显示hMSCs的增殖情况良好,说明同种异体骨材料不会影响hMSCs的正常存活及增殖。在hMSCs与同种异体骨材料体外共培养条件下通过加入EPO诱导,对PECAM-1、VWF、VEGF三种标记物进行免疫荧光染色,结果显示此三种标记物表达情况良好,说明EPO对hMSCs仍有明显的成血管诱导作用。但是本研究也存在一定的局限性,虽然观察到有多种血管标记物的表达,但是复合材料是否可在生物体内确实促进血管形成仍需相关实验进行验证。hMSCs可以在同种异体骨材料中正常存活、增殖,并在EPO诱导下向血管内皮细胞方向分化,这为骨坏死、骨缺损等疾病的治疗材料选择提供了一个新的研究方向。但是如何将hMSCs与同种异体骨材料更好的复合实用化、更好的加以成血管诱导、促进细胞增殖,仍需进一步探索、研究。
[1] Zhang W,Zhang L,Liu J,et al.Repairing sciatic nerve injury with an EPO-loaded nerve conduit and sandwiched-in strategy of transplanting mesenchymalstem cells[J].Biomaterials,2017,142:90-100.
[2] 黄晓楠.BMP-14诱导骨髓间充质干细胞向肌腱细胞分化的实验研究[J].生物骨科材料与临床研究,2017,14(02):1-4.
[3] 邵艳琳,罗世君,孙嵩,等.骨髓间充质干细胞复合Bio-oss修复兔颅骨缺损的组织学变化[J].中国组织工程研究,2017,21(13):2036-2042.
[4] Li JP,Wang DW,Song QH.Transplantation of erythropoietin genetransfected umbilical cord mesenchymal stem cells as a treatment for limb ischemia in rats[J].Genet Mol Res,2015,14(4):19005-19015.
[5] Matsumoto R,Omura T,Yoshiyama M,et al.Vascular endothelial growth factor expressing mesenchymal stem transplantation for the treatment of acute myocardial infarction[J].Arterioscler Thromb Vasc Biol,2005,25(6):1168-1173.
[6] 林海泓,肖萍,朱军,等.重组人促红细胞生成素对MSCs增殖及分泌功能的影响 [J].复旦学报(医学版),2007,34(S1):674-677.
[7] Yoshioka T,Mishima H,Akaogi H,et al.Concentrated autologous bone marrow aspirate transplantation treatment for corticosteroidinduced osteonecrosis of the femoral head in systemic lupus erythematosus[J].Int Orthop,2011,35(6):823-829.
[8] Feitosa M-L-T,Fadel L,Belträo-Braga P-C-B,et al.Successful transplant of mesenchymal stem cells in induced osteonecrosis of the ovine femoral head:preliminary results[J].Acta Cir Bras,2010,25(5):416-422.
[9] Hang D,Wang Q,Guo C,et al.Treatment of Osteonecrosis of the Femoral Head with VEGF(165)Transgenic Bone Marrow Mesenchymal Stem Cells in Mongrel Dogs[J].Cells Tissues Organs,2012,195(6):495-506.
[10]Tripathy SK,Goyal T,Sen RK.Management of femoral head osteonecrosis:Current concepts[J].Indian J Orthop,2015,49(1):28-45.
[11]Chan KL,Mok CC.Glucocorticoid-Induced Avascular Bone Necrosis:Diagnosis and Management[J].The Open Orthopaedics J,2012,6(1):449-457.
[12]孙薏,张文华,姚一民,等.中心减压植骨联合骨髓间充质干细胞移植治疗股骨头缺血坏死[J].西南国防医药,2008,18(6):800-802.
[13]宁卫全,王万春,刘武夷,等.小转速髓芯减压结合自体红骨髓组织工程复合物治疗早中期股骨头缺血性坏死[J].生物骨科材料与临床研究,2017,14(04):24-28.
[14]Chen S,Li J,Peng H,et al.Administration of erythropoietin exerts protective effects against glucocorticoid induced osteonecrosis of the femoral head in rats[J].Int J Molecule Med,2014,33(4):840-848.
[15]Zheng W,Seftor EA,Meininger CJ,et al.Mechanisms of coronary angiogenesis in response to stretch:role of VEGF and TGF-beta[J].Am J Physiol Heart Circ Physiol,2001,280(2):H909-H917.
[16]杜明伟,方长青,王秀茹,等.血管内皮标记物及血管内皮生长因子在胸水细胞中的表达和意义[J].微生物学杂志,2012,32(4):47-52.
[17]Randi AM,Laffan MA,Starke RD.Von Willebrand factor,angiodysplasia and angiogenesis[J].Mediterr J Hematol Infect Dis,2013,5(1):e2013060.

