羊栖菜提取液绿色合成纳米铁及去铬性能研究❋
林国庆, 闫晓云, 庞红璐, 陈小兰, 李文娟, 闫鑫宇 (.中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 6600;
2.山东省海洋环境地质工程重点实验室,中国海洋大学环境科学与工程学院, 山东 青岛 266100)
纳米铁因其具有比表面积大、还原能力强和反应速度快等优点,被应用于去除地表水和地下水中重金属、有机氯代物等污染物[1-3]。目前纳米铁的合成方法有物理法、化学法和生物法,其中生物法合成纳米铁的方法逐渐成为研究的热点[4]。生物法主要是利用微生物、植物提取物等生物分子的还原特性参与纳米铁合成的方法,具有原料来源广、反应条件温和、合成纳米颗粒不易团聚,以及合成过程中加入的化学试剂和产生的有毒副产物少等优点[4]。
近年,许多植物提取物已被用于制备纳米铁颗粒。比如,Njagi等[5]利用高粱麸皮提取物制备纳米铁;George等[6]利用茶叶提取液绿色合成纳米铁;Kumar等[7]利用薄荷提取物合成粒径为20~45 nm的纳米铁颗粒。利用植物提取液合成纳米铁原理是植物中含有多酚、黄酮、多糖等多种具有生物活性的还原剂,这些有机成分可以将铁盐或亚铁盐还原为纳米铁,同时又可以分散和稳定生成的纳米铁,提高了纳米铁的稳定性[8]。目前已有将绿色合成的纳米铁材料应用于环境中重金属、有机物和染料等去除的报道。Machado等[9]采用葡萄渣、红茶和葡萄叶制备纳米铁颗粒并用于土壤中初始浓度为2.8 mg·kg-1的布洛芬去除,去除率可以达到90%;陈祖亮等[10]利用绿茶、乌龙茶和红茶提取液制备出了球状纳米铁,并研究了不同合成条件下(温度、pH、配比)所制备出的纳米铁对孔雀石绿(MG)的去除效果。Souria等采用芦荟汁合成纳米铁氧化物颗粒,并用于去除污水中的As(V)[11]。
然而,当前绿色合成纳米铁采用的植物多为陆生植物,而海洋面积占据地球的70%,海洋藻类资源丰富,很多海洋藻类中含有大量多酚、黄酮、蛋白质等成分,这些成分可作为制备纳米铁的还原剂、分散剂和稳定剂[12]。羊栖菜隶属于褐藻,为潮间带底栖海藻的优势种类,在中国分布广泛,北起辽东半岛,南至雷州半岛。此外,在日本、韩国及朝鲜海域均有分布。羊栖菜中含有的多糖、多酚和黄酮类等化合物具有很高的抗氧化性和清除自由基的能力[13],为采用羊栖菜提取液制备纳米铁颗粒提供了可能性。
铬(Cr)及其化合物被广泛应用于工业制造、印染、防腐、皮革染色等领域。水体中铬主要以Cr(III)和Cr(VI)的形式存在,其中Cr(VI)具有强毒性,易进入到水体中,破坏生境,影响动植物生长,威胁人体健康[14]。纳米铁具有颗粒粒径小、比表面积大和反应活性高的优良特性,是一种极具应用前景的还原性物质,已有报道指出纳米铁可以修复水中铬污染[15]。
本文采用羊栖菜提取液还原氯化铁制备纳米铁,通过扫描电镜、X射线衍射和红外光谱等方法对制备出的纳米铁进行表征和分析,并以对环境及人体健康危害严重的Cr(VI)为目标污染物,考察由羊栖菜提取物合成的纳米铁对水中Cr(VI)的去除效果。
1 材料和方法
1.1 实验材料
实验所用羊栖菜购自浙江省温州市洞头县,用去离子水清洗羊栖菜表面灰尘,粉碎备用。实验过程中均使用去离子水。
试验用的化学药品氯化铁、邻菲罗啉、乙醇和重铬酸钾等均为分析纯,且使用前未经纯化。氯化铁购自天津市恒兴化学试剂制造有限公司;无水乙醇购自天津市富宇精细化工有限公司;重铬酸钾购自国药集团化学试剂有限公司。
1.2 羊栖菜提取液绿色合成纳米铁
取6 g粉碎后的羊栖菜置于150 mL三角瓶中,加入100 mL去离子水,在80 ℃条件(由于在此温度下,多酚等氧化酶失活,多酚等物质就不会被氧化,可以保持活性)[16]下水浴30 min,然后将提取液进行真空抽滤,得到羊栖菜提取液,并储存在4 ℃环境中备用。
将羊栖菜提取液与0.1 mol/L 的氯化铁溶液按照体积比2:1进行混合,在25 ℃摇床中以250 r/min速度振荡1 h,对悬浊液进行真空抽滤,得到HF-Fe NPs,并迅速用乙醇清洗,在60 ℃条件下真空干燥4 h后,将制备得到的HF-Fe NPs保存在无氧容器中。
1.3 样品表征
采用扫描电子显微镜(SEM)(日立SU8020超高分辨冷场发射扫描电子显微镜)观察样品的表面形貌及元素组成;采用X射线粉末衍射(XRD)(德国Bruker公司D8 Advance型X 射线粉末衍射仪)分析合成纳米铁的晶态结构,扫描范围2θ为10~80 θ,扫描速率2θ·min-1;采用傅里叶变换红外光谱(FTIR)(德国布鲁克光谱仪器公司Tensor 27红外光谱仪)获取合成纳米铁样品的FTIR谱图,合成纳米铁样品与KBr按照1∶150研磨制成薄压片,红外光谱仪于4 000~500 cm-1波长区间内扫描;采用美国尤尼柯2800UV/VIS紫外可见分光光度计对羊栖菜提取液和生成的纳米铁悬浊液进行全光谱扫描,扫描范围为200~700 cm-1;采用透射电子显微镜(TEM)(JEM-1200EX型电子透射显微镜)观察纳米铁的形貌、分散情况,获取选区电子衍射花样(SAED),辅助XRD分析纳米铁的晶相。
1.4 Cr(VI)的去除实验
以羊栖菜提取物(HFE)作为对照试验。将0.1 g的HFE与HF-Fe NPs分别加入到100 mL初始浓度为10 mg·L-1的Cr(VI)溶液中,置于摇床中振荡,于2,5,10,20,30,50,70和90取样,快速用0.22 μm滤膜过滤,滤液中Cr(VI)的含量用二苯碳酰二阱分光光度计法在540 nm波长下测定,用去除率来评价HFE与HF-Fe NPs的活性。HFE与HF-Fe NPs对Cr(VI)去除率按照以下公式计算:
η=(ρ0-ρt)/ρ0×100%。
(1)
其中:η为Cr(VI)的去除率,%;ρ0为溶液中Cr(VI)的初始浓度,mg·L-1;ρt为反应t分钟后溶液中的Cr(VI)浓度,单位mg·L-1。
2 结果与讨论
2.1 扫描电镜(SEM)和X射线能谱图(EDS)
图1(A)、图1(C)分别为羊栖菜提取液干燥后的残留物和羊栖菜提取液绿色合成的纳米铁 (HF-Fe NPs)的扫描电镜图。由图1(A)可以看出,羊栖菜提取液烘干后的残留物表面光滑,提取液中本身没有纳米颗粒。图1(C)显示,HF-Fe NPs基本呈现较规则的球形纳米颗粒。采用Nano Measure软件进行粒径统计分析,结果显示,其粒径范围大约为17~40 nm。图1(A)和图1(C)比较结果进一步证明向羊栖菜提取液中加入FeCl3溶液后,有黑色的纳米颗粒的生成。这一现象与Makarov和Wang等人所报道的结果相似[17-18]。

图1 羊栖菜SEM (A)和EDS (B),HF-Fe NPs 的SEM (C)和EDS (D)
羊栖菜提取液干燥后的残留物和HF-Fe NPs的EDS图以及元素分析结果分别见图1(B)、图1(D)和表1,主要元素有C、O、P、S、Cl、K、Na、Mg。羊栖菜提取物中铁含量为0%,而HF-Fe NPs的EDS图中显示有铁(25.49%)的存在,这表明羊栖菜提取物与氯化铁反应生成了纳米铁颗粒。
由于羊栖菜提取物成分复杂,所以生成HF-Fe NPs的表面也含有多种元素,其中C、O主要来源于多糖、酚类等生物分子,P、S来源于羊栖菜中的氨基酸等,Na、Mg、K、Cl等主要来源于羊栖菜中的矿物质、盐类等。羊栖菜提取液干燥后的残留物和HF-Fe NPs的EDS元素分析(见表1)结果表明,在生成HF-Fe NPs后Na、Mg、K、Cl元素含量减少,这是由于在合成纳米铁后进行了醇洗,HF-Fe NPs表面的矿物质以及来源于氯化铁的氯离子被洗掉。此外,HF-Fe NPs表面氧元素含量明显高于羊栖菜提取物,可能是由于在HF-Fe NPs表面有铁氧化物的生成和氧化多酚的存在。已有相关报道中,Wang等[19]采用桉树叶制备纳米铁,Kuang等[20]与Chrysochoou等[21]采用茶叶提取液制备纳米铁制备纳米铁的研究也得到相似的结果。

表1 羊栖菜提取物(HFE)与合成纳米铁(HF-Fe NPs)元素含量Table 1 Elemental contents of Hizikia fusiformis extracts (HFE) and synthetic nanoparticles (HF-Fe NPs) /%
注:wt为元素质量百分含量,%。wt refers to the element quality percentage content, %.
2.2 合成纳米铁的晶态分析(XRD和TEM)
HF-Fe NPs的XRD、TEM和SAED如图2,图2(a)为合成的HF-Fe NPs的X射线衍射图(XRD),图中没有显示与α-Fe(2θ=44.9°)、Fe2O3(2θ=35.68°)、Fe3O4(2θ= 35.45°)和FeOOH(2θ=20.35°)相关的衍射峰[22-23],说明生成纳米铁为非晶态。在2θ=25°附近存在一个宽驼峰,为有机物的衍射峰,这说明图2(b)透射电镜图(TEM)中HF-Fe NPs的表面覆盖物质为有机物。这些有机物包裹在纳米铁外,可以提高Fe NPs的分散性,使其不易团聚,还阻隔了与外界空气的接触,增加HF-Fe NPs的稳定性,使它不容易被氧化。为进一步确认样品的结构,对多个纳米颗粒的电子衍射花样进行检验,结果表明,除了极少纳米颗粒的选区电子衍射花样(SAED)显示单晶和多晶纳米颗粒存在,大多数纳米颗粒多为非晶态,这与前边XRD图中没有显示与α-Fe、Fe2O3、Fe3O4和FeOOH相关的衍射峰的结果一致。该研究结果与Njagi和Machado等人所报道的结果相似[6, 24]。Njagi等[6]采用高梁麸皮制备得到的纳米铁XRD图也仅在2θ=25°附近有驼峰。Machado[24]采用果树叶片合成得到纳米铁也为非晶态,并提出绿色合成纳米铁与化学合成纳米铁晶态不同可能是与叶片提取物中复杂成分有关。
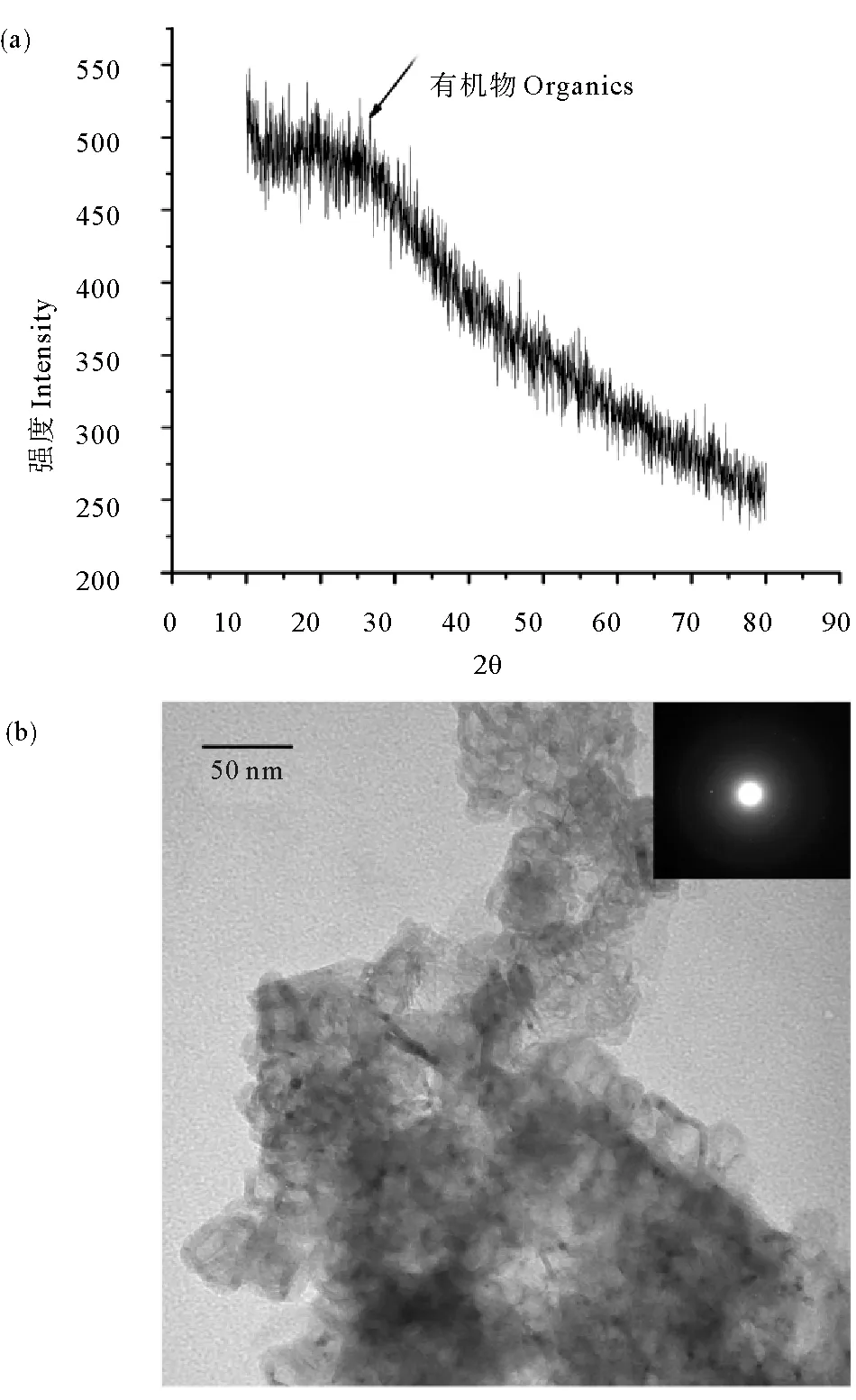
图2 HF-Fe NPs的XRD、TEM和SAEDFig.2 The XRD(a)、TEM(b) and SAED(b) images of HF-Fe NPs
2.3 紫外可见全扫描谱图分析(UV-Vis)和红外光谱分析(FTIR)
采用紫外可见全扫描谱图(UV-Vis)和红外谱图(FTIR)对羊栖菜提取液中参与合成纳米铁的生物分子进行分析(见图3)。图3中曲线a、b、c分别为氯化铁溶液、羊栖菜提取液与HF-Fe NPs悬浊液的全扫描曲线。图3中b、c两条曲线在200~250 nm区间显示有强吸收峰(ε>104),说明羊栖菜提取液中含有两个双键的共轭体系;在250~300 nm区间有中等强度吸收峰(ε=200~1 000),表明羊栖菜提取液中存在苯环。已有研究表明,羊栖菜中起到抗氧化作用的化学成分主要有岩藻黄素和多酚,其中两个双键的共轭体系为岩藻黄素中的二烯键,而苯环则主要存在于多酚物质中[25]。图3中曲线c在200 nm处的吸收值比曲线b有所减弱,其原因可能是羊栖菜提取物中有部分岩藻黄素和氯化铁反应生成了纳米铁。而在250~300 nm区间的吸收值未见明显减弱,可能是纳米铁表面存在多酚,可以防止纳米铁颗粒发生氧化,具有稳定纳米铁的作用。
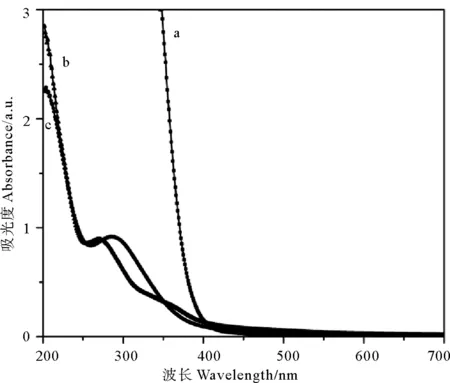
图3 FeCl3溶液、羊栖菜提取物和HF-Fe NPs的UV-Vis图Fig.3 The UV-Vis images of FeCl3、HFE and HF-Fe NPs
羊栖菜提取物和HF-Fe NPs纳米颗粒在波数为4 000~400 cm-1的红外谱图如图4。图中3 416和3 147 cm-1附近为O—H的振动吸收峰,1 641和1 628 cm-1附近是C=C的振动吸收峰,1 385和1 402 cm-1附近为芳香胺的伸缩振动吸收峰[19,26]。1 084和1 042 cm-1附近吸收峰为—NH的伸缩振动,在886、879和818 cm-1附近的弱吸收为苯环中C—H的弯曲振动[7]。羊栖菜提取物和HF-Fe NPs的红外谱图表明了—OH、C=C、—NH、酚类官能团的存在。提取物中富含有强还原性的羟基—OH官能团,可以通过释放质子将Fe(III)还原为Fe0。C=C官能团可以被氧化为醛,而带有C=O键的醛酮类物质可以被氧化为羧基,同时也可以将氯化铁中的Fe(III)还原生成铁纳米颗粒。而在HF-Fe NPs表面可以通过-NH和-COOH等官能团的相互作用提高纳米铁的稳定性[27]。

图4 羊栖菜提取物(a)和HF-Fe NPs (b)的红外光谱图 Fig.4 The FTIR spectrum of HFE(a) and HF-Fe NPs(b)
2.4 HF-Fe NPs去除水中Cr(VI)
本研究以Cr(VI)为目标污染物,以羊栖菜提取物(HFE)为对照,评估了HF-Fe NPs去除污染物的能力,去除效果如图5。结果表明,羊栖菜提取物(HFE)对Cr(VI)去除率仅为12.76%。而HF-Fe NPs能够迅速去除水体中的Cr(VI),实验开始2 min内HF-Fe NPs对Cr(VI)去除率达到50%,反应90 min后,HF-Fe NPs对Cr(VI)去除率高达92.76%。表明HF-Fe NPs能高效去除水中的Cr(VI)。
对HF-Fe NPs去除污染物Cr(VI)进行动力学分析,一级动力学模型公式为:
lg(qe-qt)=lgqe-k1t/2.303。
(2)
其中:qe和qt分别是在平衡时和在t时间(min)HF-Fe NPs对Cr(VI)的去除量(mg·g-1);k1是准一级反应的表观速率常数。表观速率常数k1可以由计算lg(qe-qt)对时间t的曲线斜率得到。
应用二级吸附动力学模型描述HF-Fe NPs对水体中Cr(VI)的去除过程,公式为:
t/qt=1/(k2qe2)+t/qe。
(3)
式中:qe和qt分别是在平衡时和在t时间(min)HF-FeNPs对Cr(VI)的去除量(mg·g-1);k2表示准二级反应的表观速率常数,其中q和k2的值可以从t/qt的曲线计算。
采用一级动力学模型以及二级动力学模型分别对数据进行拟合,结果如表2所示。由表2可以看出,二级动力学模型拟合相关系数R2(0.943 4)高于一级动力学模型拟合相关系数R2(0.758 9)。另外,由二级动力学方程拟合出的平衡吸附量为9.596 9 mg·g-1,与实验值计算出的平衡吸附量(9.568 3 mg·g-1)非常接近,说明HF-Fe NPs对于Cr(VI)的去除更符合二级动力学模型。结果表明,HF-Fe NPs去除水溶液中的Cr(VI)是一个化学吸附占主导的反应过程。
3 结论
(1)采用羊栖菜提取液制备球状纳米铁,粒径大约在17~40 nm的球状颗粒,晶态分析表明生成的纳米铁多为无定形态。

图5 HFE与HF-Fe NPs对Cr(VI)溶液的去除率Fig. 5 The removal of Cr(VI) with HFE and HF-Fe NPs

铬浓度Cr(VI) concentionCr(VI)/mg·L-1实验值Experiment valueqe/ mg·g-1一级动力学模型First-order kinetic model二级动力学模型Second-order kinetic modelqe/ mg·g-1k1/g·mg-1·min-1R2qe/mg·g-1k2/ min-1R2109.568 31.364 30.052 20.758 99.596 90.015 20.943 4
(2)UV-Vis和FTIR的研究表明,羊栖菜提取液中含有岩藻黄素和褐藻多酚类物质。这些物质含有的二烯键和—OH等官能团与氯化铁作用生成纳米铁,多酚类物质覆盖在纳米铁表面,提高了纳米铁的稳定性。
(3)以水中Cr(VI)为目标污染物,反应90 min后,HF-Fe NPs对初始浓度为10 mg·L-1去除率达到92.76%。动力学分析表明HF-Fe NPs去除Cr(VI)符合二级动力学反应。
参考文献:
[1] Zhang W X. Nanoscale iron particles for environmental remediation: An overview[J]. Journal of Nanoparticle Research, 2003, 5(3): 323-332.
[2] 秦泽敏,董黎明,刘平,等. 零价纳米铁吸附去除水中六价铬的研究[J]. 中国环境科学, 2014, 34(12): 3106-3111.
[3] Li Y M, Zhang Y, Li J F, et al. Enhanced removal of pentachlorophenol by a novel composite: Nanoscale zerovalent iron immobilized on organobentonite[J]. Environmental Pollution, 2011, 159: 3744-3749.
[4] Oxana V, Kharissova H V, Rasika Dias, et al. The greener synthesis of nanoparticles[J]. Trends in Biotechnology, 2013, 31(4): 240-248.
[5] Njagi C E, Huang H, Stafford L, et al. Biosynthesis of iron and silver nanoparticles at room temperature using aqueous sorghum bran extracts[J]. Langmuir, 2011, 27(1): 264-271.
[6] Hoag George E, Collins J B, Holcomb J L, et al. Degradation of bromothymol blue by ‘greener’ nano-scale zero-valent iron synthesized using tea polyphenols[J]. Journal of Materials Chemistry, 2009, 19(45): 86-71.
[7] Kumar S P, Pooja G, Kaliaperumal S. Synthesis of green nano iron particles(GnIP) and their application in adsorptive removal of As(III) and As(V) from aqueous solution[J]. Applied Surface Science, 2014. 317: 1052-1059.
[8] Mittal A K, Chisti Y, Banerjee U C. Synthesis of metallic nanoparticles using plant extracts[J]. Biotechnology Advances, 2013, 31(2): 346-356.
[9] Machado S, Stawiński W, Slonina P, et al. Application of green zero-valent iron nanoparticles to the remediation of soils contaminated with ibuprofen[J]. Science of the Total Environment, 2013(461-462): 323-329.
[10] Huang L L, Luo F, Chen Z L, et al. Green synthesized conditions impacting on the reactivity of Fe NPs for the degradation of malachite green[J]. Spectrochimica Acta A: Molecular and Biomolecular Spectroscopy, 2015, 137(2): 154-159.
[11] Debarati M, Sourja G, Swachchha M, et al. Green synthesis of α-Fe2O3nanoparticles for arsenic(V) remediation with a novel aspect for sludge management[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 639-650.
[12] Zou D H, Gao K, Ruan K S. Seasonal pattern of reproduction of hizikia fusiformis (sargassaceae, phaeophyta) from Nanao Island, Shantou, China[J]. Journal of Applied Phycology, 2006, 18(2): 195-201.
[13] Nakkarike M, Sachindra E S, Maeda H. Radical scavenging and singlet oxygen quenching activity of marine carotenoid fucoxanthin and its metabolites[J]. J Agric Food Chem, 2007, 55(21): 8516-8522.
[14] Cheng S P. Heavy metal pollution in China: origin, pattern and control[J]. Environ Sci Pollut Res, 2003, 10(3): 192-198.
[15] Yin X C, Liu W, Ni J R. Removal of coexisting Cr(VI) and 4-chlorophenol through reduction and Fenton reaction in a single system[J]. Chemical Engineering Journal, 2014, 248: 89-97.
[16] Wang T, Lin J J, Chen Z L, et al. Green synthesized iron nanoparticles by green tea and eucalyptus leaves extracts used for removal of nitrate in aqueous solution[J]. Journal of Cleaner Production, 2014, 83: 413-419.
[17] Makarov V V, Makarova S S, Love A J, et al. Biosynthesis of stable iron oxide nanoparticles in aqueous extracts of hordeum vulgare and rumex acetosa rlants[J]. Langmuir, 2014, 30(20): 5982-5988.
[18] Wang Z Q, Fang C, Megharaj M. Characterization of iron-polyphenol nanoparticles synthesized by three plant extracts and their fenton oxidation of Azo dye[J]. ACS Sustainable Chemistry & Engineering, 2014, 2(4): 1022-1025.
[19] Wang T, Jin X Y, Chen Z L, et al. Green synthesis of Fe nanoparticles using eucalyptus leaf extracts for treatment of eutrophic wastewater[J]. Science of the Total Environent, 2014(466-467): 210-213.
[20] Kuang Y, Wang Q P, Chen Z L, et al. Heterogeneous fenton-like oxidation of monochloro benzene using green synthesis of iron nanoparticles[J]. Journal of Colloid and Interface Science, 2013, 410: 67-73.
[21] Chrysochoou M, Johnston C P, Dahal G. A comparative evaluation of hexavalent chromium treatment in contaminated soil by calcium polysulfide and green-tea nanoscale zero-valent iron[J]. Journal of Hazardous Materials, 2012(201-202): 33-42.
[22] Huang L L, Weng X L, Chen Z L, et al. Green synthesis of iron nanoparticles by various tea extracts: Comparative study of the reactivity[J]. Spectrochimica Acta A: Molecular and Biomolecular Spectroscopy, 2014, 130: 295-301.
[23] Shahwan T, Sirriah S A, Nairat M, et al. Green synthesis of iron nanoparticles and their application as a Fenton-like catalyst for the degradation of aqueous cationic and anionic dyes[J]. Chem Eng J, 2011, 172(1): 258-266.
[24] Machado S, Pacheco J G, Nouws H P, et al. Characterization of green zero-valent iron nanoparticles produced with tree leaf extracts[J]. Science of the Total Environment, 2015, 533: 76-81.
[25] Sangeetha R K, Bhaskar N, Baskaran V. Comparative effects of β-carotene and fucoxanthin on retinol deficiency induced oxidative stress in rats[J]. Molecular and Cellular Biochemistry, 2009, 331: 59-67.
[26] Kumar K M, Mandal B K, Kumar K S, et al. Biobased green method to synthesis palladium and iron nanoparticles using Terminalia Chebula aqueous extract[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 102: 128-133.
[27] Das R K, Borthakur B B, Bora U. Green synthesis of gold nanoparticles using ethanolic leaf extract of Centella asiatica[J]. Materials Letters, 2010, 64(13): 1445-1447.

