c-jun基因沉默对放射抗拒鼻咽癌裸鼠移植瘤生长及血管生成的影响
林国享 李龄 曲颂 余彬彬 梁忠国 孙永楚 周磊 陈凯华 卢其腾 朱小东,3
c-jun基因作为转录因子1(activating protein-1,AP-1)的重要组成部分,与细胞增殖、凋亡、迁移、侵袭等密切相关[1-2]。血管内皮生长因子(vascularendothelial growth factor,VEGF)是常见的促血管生成因子,在肿瘤血管生成过程中起核心作用。研究表明,c-jun对VEGF表达有重要调控作用[3],可调节肿瘤组织血管生成[4-5]。本课题组前期实验通过间歇大剂量γ射线多次照射人鼻咽癌细胞CNE-2,成功构建了具有稳定放射抗拒性的人鼻咽癌放射抗拒细胞株CNE-2R[6],并发现c-jun在人鼻咽癌放射抗拒细胞株CNE-2R中高表达[7],沉默c-jun可抑制CNE-2R细胞增殖,并增加其放射敏感性[8]。本研究在前期实验基础上,探究c-jun基因沉默对人鼻咽癌放射抗拒细胞CNE-2R VEGF表达的影响,并构建裸鼠模型观察c-jun基因沉默对CNE-2R细胞移植瘤生长及其血管生成的影响,以期为阐明鼻咽癌发生发展机制提供参考。
1 材料与方法
1.1 主要材料
人鼻咽癌放射抗拒细胞株CNE-2R由广西医科大学附属肿瘤医院实验研究部构建并保存;IPA裂解液、BCA蛋白定量试剂盒和ECL化学发光试剂购自上海碧云天技术有限公司;兔抗人VEGF、c-jun及β-actin抗体购于美国CST公司,兔抗人CD34抗体购于福州迈新生物科技有限公司,山羊抗兔二抗购于上海碧云天技术有限公司;凝胶成像分析仪购自美国Bio-Rad公司;免疫组化试剂盒购于北京中杉生物技术有限公司。4~6周龄实验用裸鼠,18~20 g/只,均为雄性,购于上海斯莱克实验动物有限公司,在SPF条件中饲养(合格证编号:2015000530021)。
1.2 方法
1.2.1 细胞培养 将鼻咽癌放射抗拒细胞CNE-2R分成3组:siRNA技术介导c-jun基因沉默的c-junshRNA-CNE-2R细胞组(c-jun-shRNA组)、阴性对照NC-shRNA-CNE-2R细胞组(NC组),以CNE-2R细胞为空白对照组。细胞培养用RPMI-1640培养液(含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素),在37℃、5%CO2培养箱中常规培养。胰蛋白酶消化传代,取对数生长期的细胞用于实验。
1.2.2 Western blot检测CNE-2R细胞VEGF蛋白的表达 收集对数期生长的CNE-2R细胞,RIPA裂解液抽提细胞总蛋白,BCA法行蛋白定量。每组细胞取20 μL蛋白质,加上样缓冲液,12%SDS-PAGE电泳、转膜、5%脱脂牛奶封闭后,分别加入相应的一抗(1∶1 000)和 β-atin抗体(1∶1 000),4 ℃孵育过夜,分别与相应HRP 标记的二抗(1∶1 000)室温摇床孵育 1 h,ECL显影,凝胶成像系统拍照和分析。以各组内参基因蛋白β-atin表达量为基准,ImageJ软件分析条带灰度值并计算各组VEGF蛋白的相对表达量。
1.2.3 裸鼠人鼻咽癌模型的建立及鉴定 细胞慢病毒转染后传代培养4周,将4~6周龄雄性裸鼠随机分成c-jun-shRNA组、NC组和空白对照组,每组5只。取对数期的各组细胞,将细胞消化并混悬调整浓度为2×107/mL,分别于3组裸鼠右腹股沟皮下注射细胞悬液0.2 mL/只。观察成瘤情况,观察肿瘤出现的时间、肿瘤体积、肿瘤大小等。2周后用游标卡尺测量裸鼠肿瘤直径,连续观察6周,游标卡尺测量肿瘤长短径,计算肿瘤体积(V),绘制肿瘤生长曲线。至第6周末处死裸鼠,完整分离瘤体并称重,计算肿瘤体积。完整瘤组织用石蜡包埋,连续切片10张,片厚5 μm,HE染色。按成瘤的裸鼠数计算成瘤率。肿瘤体积=长径(a)×短径(b)2×0.5。
1.2.4 免疫组化法检测移植瘤组织中VEGF、CD34的表达 石蜡切片常规脱蜡,枸橼酸缓冲液微波92~98℃抗原修复,3%H2O2作用10 min,加入工作液兔抗人VEGF 抗体(1∶600)、小鼠抗人 CD34(1∶100),4 ℃过夜。复温后滴加二抗,DAB显色,苏木精复染。CD34以血管内皮为阳性对照,指标均用PBS代替第一抗体作为阴性对照。
1.2.5 VEGF蛋白表达计算 VEGF蛋白表达均以细胞质或细胞膜出现棕黄色颗粒为阳性,镜下每个切片随机选取5个高倍镜视野,判断染色强度,并计算阳性细胞百分比。将染色强度分为4个等级:不着色为0分、浅黄色为1分、棕黄色为2分、棕褐色为3分。依据每个视野阳性细胞数所占百分比,划分为4个等级:0~19%为 0分、20%~39%为 1分、40%~59%为 2分、≥60%为3分。每张切片所取视野的得分取其平均值。免疫组化染色结果由2位病理科专家同时评定,以两者之积作为最终得分,0~3分定义为低表达,6~9分定义为高表达。
1.2.6 微血管密度结果判定(microvesseldensity,MVD)
CD34标记血管内皮细胞并计数微血管密度。光镜下以100倍视野选取5个微血管染色方法区(新生血管热点区),然后在200倍视野下计算每一方法区中的微血管,取其平均值,即为组织的MVD。
1.3 统计学方法
采用SPSS 17.0统计软件对数据进行分析。实验数据以均数±标准差(x±s)表示,两组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析(one way ANOVA),肿瘤体积生长采用单因素重复测量方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 c-jun基因沉默后CNE-2R细胞中VEGF的表达
Western blot实验结果(图 1)显示,c-jun-shRNA组细胞c-jun蛋白表达较NC和空白对照组明显降低(P<0.05),表明该组细胞c-jun基因沉默效果好,成功构建c-jun基因沉默的c-jun-shRNA-CNE-2R细胞。空白对照组VEGF蛋白的相对表达量为0.97±0.01,NC组为 0.99±0.01,c-jun-shRNA 组为0.48±0.03。与NC组及空白对照比较,c-jun-shRNA组细胞中VEGF的表达量明显下降(P<0.05),而NC组及空白对照组差异无统计学意义(P>0.05)。
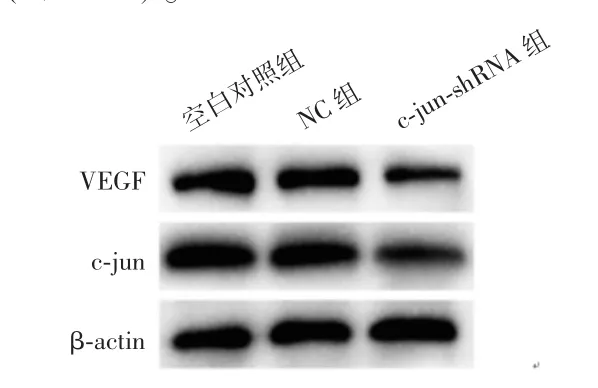
图13 组细胞VEGF的表达
2.2 裸鼠皮下移植瘤生长情况
3组裸鼠成瘤率均为100%。在第1周、第2周,3组裸鼠移植瘤体积差异无统计学意义(P>0.05)。c-junshRNA组裸鼠移植瘤体积增长速度缓慢,体积增长幅度较NC组和空白对照组小,第3~6周c-jun-shRNA组移植瘤体积明显小于NC组和空白对照组(P<0.05);整个观察期NC组及空白对照组裸鼠移植瘤体积差异无统计学意义(P>0.05)。见表1。
表1 3 组裸鼠移植瘤体积的变化[(±s),mm3]
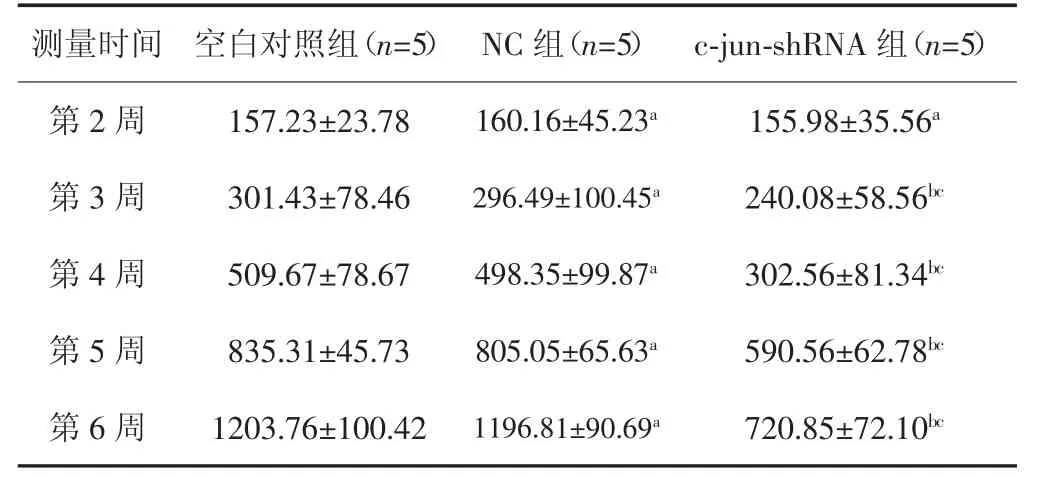
表1 3 组裸鼠移植瘤体积的变化[(±s),mm3]
与空白对照组比较,aP>0.05;与空白对照组比较,bP<0.05;与NC组比较,cP<0.05
测量时间 空白对照组(n=5) NC组(n=5) c-jun-shRNA组(n=5)第 2 周 157.23±23.78 160.16±45.23a 155.98±35.56a第 3 周 301.43±78.46 296.49±100.45a 240.08±58.56bc第 4 周 509.67±78.67 498.35±99.87a 302.56±81.34bc第 5 周 835.31±45.73 805.05±65.63a 590.56±62.78bc第 6 周 1203.76±100.42 1196.81±90.69a 720.85±72.10bc
选取第2~6周5个时间点行重复测量方差分析,结果显示,组间效应有统计学意义(F=52.276,P=0.001),说明c-jun-shRNA组裸鼠移植瘤体积明显小于空白对照组及NC组;时间效应有统计学意义(F=89.437,P<0.001),表明3组移植瘤的体积均随时间延长而增长,分组和时间具有交互作用(F=25.187,P=0.001)。
2.3 裸鼠皮下移植瘤质量的变化
6周观察期结束,处死裸鼠,剥离裸鼠移植瘤组织,称取其质量,c-jun-shRNA 组质量为(0.42±0.04)g,NC组为(0.80±0.08)g和空白对照组为(0.83±0.05)g。c-jun-shRNA组移植瘤移植瘤质量较NC组及空白对照组轻(P<0.05);NC组与空白对照组比较,差异无统计学意义(P>0.05)。
2.4 裸鼠移植瘤组织中VEGF的表达情况
镜下观察发现,VEGF阳性信号表达于组织细胞质。NC组和空白对照组VEGF阳性信号为棕褐色,表达率均≥60%,呈强阳性;而c-jun-shRNA组仅呈浅黄色或不着色,表达率约30%,呈弱阳性,见图2。c-junshRNA组移植瘤组织中VEGF表达得分为2分,NC组为6分,空白对照组为6分,c-jun-shRNA组得分明显较NC组和空白对照组低(P<0.05)。
2.5 裸鼠移植瘤组织中CD34蛋白的表达
用CD34标记血管内皮细胞计算微血管数,免疫组化结果示,内皮细胞可见棕黄色或黄色颗粒(图3),计算血管数,c-jun-shRNA组MVD为11.69±3.30,NC组为 32.56±7.33,空白对照组为 35.45±4.87,c-junshRNA组MVD较NC组和空白对照组明显减少(P<0.05),而空白对照组与NC组差异无统计学意义(P>0.05)。
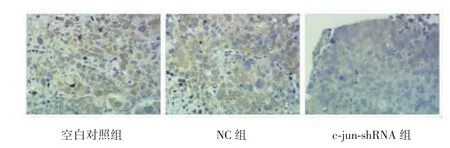
图2 3组裸鼠移植瘤组织中VEGF蛋白的表达(HE染色,×100)
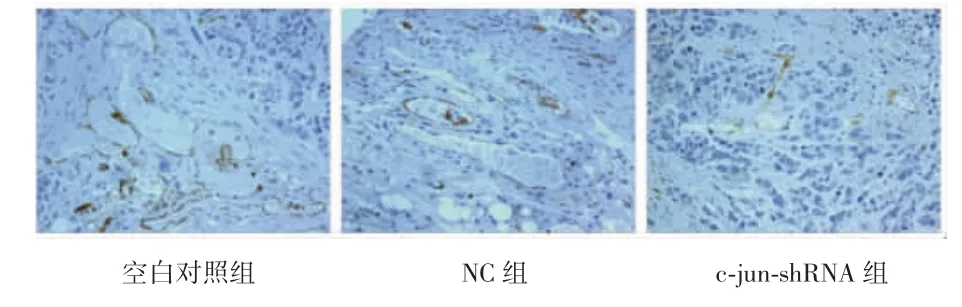
图3 3组裸鼠移植瘤组织中CD34蛋白的表达(HE染色,×100)
3 讨论
放疗是鼻咽癌的主要治疗手段,但临床上约20%的患者治疗后发生局部复发和远处转移[9-11],血管生成与肿瘤发生、发展及远处转移密切相关,抑制血管生成对肿瘤治疗意义重大[12]。c-jun原癌基因是即刻早期基因Jun家族成员之一,与多种细胞因子及生长因子的转录调控密切相关,在多种恶性肿瘤中呈高表达。研究表明,c-jun基因或其相关信号通路的作用改变可影响肿瘤血管生成,可能参与肿瘤形成、侵袭和转移等过程[13-15]。但目前c-jun基因对鼻咽癌影响的研究较少。
VEGF是一种重要的促血管形成因子,通过增加微血管的通透性和特异性,与血管内皮细胞受体结合,促进血管内皮细胞分裂和增殖,进而导致新生血管生成,还可以自分泌的形式促进肿瘤细胞自身生长。研究表明,VEGF在鼻咽癌组织中呈高表达,且其表达与鼻咽癌远处转移密切相关[16-17]。c-jun在VEGF的表达过程中起重要调控作用,从而调节肿瘤等组织血管生成[18]。以上研究说明,研究c-jun在鼻咽癌细胞血管生成中的作用,对抑制鼻咽癌生长、转移及治疗可能有重要作用。
本课题组前期研究[7-8]发现,沉默c-jun基因可影响CNE-2R细胞增殖、凋亡,并可提高其放射敏感性。本研究继续采用前期研究方法,采用siRNA技术将CNE-2R细胞中的c-jun基因敲除,从体内、体外两种实验模式研究c-jun在鼻咽癌生长和血管生成中的作用。裸鼠动物模型实验结果显示,随时间延长,c-junshRNA组裸鼠皮下移植瘤体积增长速度明显较阴性对照组和空白对照组慢,且增长幅度较小,可见c-jun基因沉默可抑制鼻咽癌CNE-2R细胞皮下移植瘤生长,与前期研究中沉默c-jun基因可降低CNE-2R细胞增殖的结论一致。进一步研究其可能的机制,发现沉默c-jun基因可使CNE-2R细胞中VEGF表达水平下降;裸鼠移植瘤组织切片的免疫组化结果也发现c-jun-shRNA组VEGF表达较NC组及空白对照组明显下降,说明抑制c-jun基因可使鼻咽癌组织中VEGF表达下降,提示对c-jun调控可能影响鼻咽癌肿瘤血管相关因子表达水平。进一步检测裸鼠移植瘤组织中CD34的表达情况,发现NC组和空白对照组表达均较c-jun-shRNA组高。进行血管密度分析发现,c-jun-shRNA组MVD明显低于NC组和空白对照组,再次印证c-jun可能通过影响裸鼠移植瘤血管生成,从而影响细胞增殖和组织生长。结合实验中c-jun在体内外对VEGF表达的影响,分析其作用机制可能是通过调控VEGF表达而影响移植瘤血管生成。在前列腺癌研究[19]中亦发现通过调节c-jun相关通路,可改变c-jun表达,从而影响前列腺癌生长及肿瘤血管生成。Shen等[20]研究表明c-Jun氨基末端激酶激活可通过调控VEGF表达而诱发血管生成,而cjun下调可降低肿瘤生长[21],以上研究结果均与本实验结果相符。
综上所述,c-jun基因沉默可抑制人鼻咽癌放射抗拒性肿瘤生长,通过降低VEGF表达可能抑制肿瘤血管生成。对c-jun基因与鼻咽癌放射抗拒关系的深入研究,或可为鼻咽癌放疗提供新的思路。
[1] Zhang Y,Pu X,Shi M,et al.Critical role of c-Jun overexpression in liver metastasis of human breast cancer xenograft model[J].BMC Cancer,2007,7:145.
[2] Sioletic S,Czaplinski J,Hu L,et al.c-Jun promotes cell migration and drives expression of the motility factor ENPP2 in soft tissue sarcomas[J].J Pathol,2014,234(2):190-202.
[3] 刘传磊,邓跃华,王从玉,等.C-jun与VEGF-C在结直肠癌组织中的表达及临床意义[J].中华普通外科学文献(电子版),2010,4(5):440-444.
[4] Jia J,Ye T,Cui P,et al.AP-1 transcription factor mediates VEGF-induced endothelial cell migration and proliferation[J].Microvasc Res,2016,105:103-108.
[5] Huang Y,Miao Z,Hu Y,et al.Baicalein reduces angiogenesis in the inflammatory microenvironment via inhibiting the expression of AP-1[J].Oncotarget,2017,8(1):883-899.
[6] 苏芳,朱小东,曲颂,等.人鼻咽癌放射抗拒细胞株建立及其细胞周期的观察[J].中华肿瘤防治杂志,2009,16(16):1221-1224.
[7] Guo Y,Zhu XD,Qu S,et al.Identification of genes involved in radioresistance of nasopharyngeal carcinoma by integrating gene ontology and protein-protein interaction networks[J].Int J Oncol,2012,40(1):85-92.
[8] Guo SY,Zhu XD,Ge LY,et al.RNAi-mediated knockdown of the c-jun gene sensitizes radioresistant human nasopharyngeal carcinoma cell line CNE-2R to radiation[J].Oncol Rep,2015,33(3):1155-1160.
[9] 曾雷,卢泰祥.鼻咽癌综合治疗策略[J].中国癌症防治杂志,2012,4(3):205-209.
[10] Zhang L,Zhao C,Ghimire B,et al.The role of concurrent chemoradiotherapy in the treatment of locoregionally advanced nasopharyngeal carcinoma among endemic population:a meta-analysis of the phase III randomized trials[J].BMC Cancer,2010,10:558.
[11]Shen X,Li Y,Zhang Y,et al.An analysis of brachytherapy with computed tomography-guided permanent implantation of Iodine-125 seeds for recurrent nonkeratin nasopharyngeal carcinoma[J].Onco Targets Ther,2015,8:991-997.
[12]Albini A,Tosetti F,Li VW,et al.Cancer prevention by targeting angiogenesis[J].Nat Rev Clin Oncol,2012,9(9):498-509.
[13] Fan F,Bashari MH,Morelli E,et al.The AP-1 transcription factor JunB is essential for multiple myeloma cell proliferation and drug resistance in the bone marrow mi croenvironment[J].Leukemia,2017,31(7):1570-1581.
[14]Hsieh MJ,Chen JC,Yang WE,et al.Dehydroandrographolide inhibits oral cancer cell migration and invasion through NF-kappaB-,AP-1-,and SP-1-modulated matrix metalloproteinase-2 inhibition[J].Biochem Pharmacol,2017,130:10-20.
[15]Lin ZY,Chen G,Zhang YQ,et al.MicroRNA-30d promotes angiogenesis and tumor growth via MYPT1/c-JUN/VEGFA pathway and predictsaggressiveoutcomeinprostatecancer[J].Mol Cancer,2017,16(1):48.
[16]Ribatti D.Tumor refractoriness to anti-VEGF therapy[J].Oncotarget,2016,7(29):46668-46677.
[17]Huang D,Song SJ,Wu ZZ,et al.Epstein-barr virus-induced VEGF and GM-CSF drive nasopharyngeal carcinoma metastasis via recruitment and activation of macrophages[J].Cancer Res,2017,77(13):3591-3604.
[18] Jiang J,Slivova V,Jedinak A,et al.Gossypol inhibits growth,invasiveness,and angiogenesis in human prostate cancer cells by modulating NF-kappaB/AP-1 dependent-and independent-signaling[J].Clin Exp Metastasis,2012,29(2):165-178.
[19]Lin ZY,Chen G,Zhang YQ,et al.MicroRNA-30d promotes angiogenesis and tumor growth via MYPT1/c-JUN/VEGFA pathway and predicts aggressive outcome in prostate cancer[J].Mol Cancer,2017,16(1):48.
[20] Shen K,Sheng Y,Ji L,et al.Involvement of c-Jun N-terminal kinase and extracellular signal-regulated kinase 1/2 in EGF-induced angiogenesis[J].Cell Biol Int,2010,34(12):1213-1218.
[21]Elahy M,Dass CR.Dz13:c-Jun downregulation and tumour cell death[J].Chem Biol Drug Des,2011,78(6):909-912.

