不同锰处理对镉胁迫下2种油菜重金属累积和根系形态的影响
李然,徐应明,王林,*,谷朋磊, 孙约兵,梁学峰
1. 沈阳农业大学土地与环境学院,沈阳 110161 2. 农业部环境保护科研监测所,天津 300191 3. 农业部产地环境污染防控重点实验室,天津 300191
近年来,我国土壤镉(Cd)污染问题日益凸显,全国土壤Cd污染点位超标率高达7%,居于各种污染物首位[1]。由于利用强度高、化肥农药等投入量大、污水灌溉比例高等原因,菜地土壤Cd污染问题尤为突出。研究表明,我国菜地土壤样本Cd超标率高达24.1%[2]。以天津市为例,在长期使用污水灌溉的菜地中土壤Cd含量超标率达到43.48%,生产的叶类蔬菜Cd含量超标率高达45%[3-4]。蔬菜是人体膳食Cd摄入的主要来源之一,累积在蔬菜中的Cd会通过食物链进入人体,进而造成毒害作用[5]。因此,有必要探寻有效方法降低蔬菜Cd含量,保障蔬菜生产安全。
锰(Mn)是植物必需的微量元素,由于Mn、Cd在土壤-作物系统内迁移时多以二价阳离子形式存在,植物体内多种载体蛋白既可以转运Mn2+也可以转运Cd2+,因此二者在植物体内吸收转运过程中常发生拮抗作用[6-7]。基于这种拮抗作用,近年来人们开展了数项施用Mn肥减少作物Cd累积的研究[8-10]。研究表明,在生长介质中Mn供应充足或过量(胁迫)条件下,Mn、Cd互作会显著抑制普通植物和超富集植物对Cd的吸收转运[11-12],然而在Mn缺乏状态下Mn、Cd互作对植物镉累积有何影响,还很少见诸报道。Mn、Cd互作对植物Cd耐性也有显著影响,研究表明,添加外源Mn可以在光合作用、氧化还原系统、水分吸收等方面有效缓解植物Cd毒害[13-14],然而Mn、Cd互作对根系形态影响的研究还未见报道。根系是植物与营养物质及污染物直接接触的器官,根系形态的变化不仅是植物对根际化学过程的重要生理响应,而且也会深刻影响植物对营养元素和污染物的吸收转运[15],因此,研究Mn、Cd互作对植物根系形态的影响有助于揭示Mn缓解植物Cd毒害的生理机制。
本文以镉累积能力不同的2个叶用油菜(Brassicachinensis)品种为试验材料,采用水培方法,研究Cd胁迫条件下不同浓度Mn处理对油菜生物量、镉锰含量及根系形态的影响,明确不同Mn营养条件下油菜生物量和根系形态对Cd毒害的响应规律及基因型差异,揭示Mn/Cd互作对油菜Cd吸收转运的影响,以期为施用锰肥降低蔬菜镉累积提供理论依据。
1 材料与方法 (Materials and methods)
1.1 试验材料与培养条件
供试叶用油菜采用前期研究筛选的镉低积累品种“华骏”和普通品种“寒绿”[16],油菜种子由天津市农业科学院提供。
试验采用水培方法,营养液配方如下(mmol·L-1):K2SO40.75,KCl 0.1,KH2PO40.25,MgSO40.65,Ca(NO3)22.0 ;H3BO30.01,CuSO41.0×10-4,ZnSO41.0×10-3,(NH4)6Mo7O245.0×10-6, Fe-EDTA 0.1[17];营养液中MnSO4根据试验处理设置不同浓度添加;营养液pH值为6.5,用1.0 mol·L-1的HCl和NaOH调节。配制营养液的药品均为分析纯,购自国药集团化学试剂有限公司。
水培试验于2016年9—10月在农业部环保所玻璃温室内开展,室内温度为15~30 ℃,光照为自然光照。
1.2 试验处理与方法
试验采用双因素完全组合设计,第一个因素为油菜品种,种植2种油菜;第二个因素为营养液的Mn营养水平,设置Mn浓度分别为0, 0.1, 1.0, 10.0, 100.0 μmol·L-1,分别记作:Mn0、Mn0.1、Mn1、Mn10、Mn100,其中Mn1为正常营养水平,Mn0和Mn0.1为缺乏,而Mn10和Mn100为过量。所有处理中Cd浓度全部设定为10.0 μmol·L-1,以CdCl2·2.5H2O(分析纯)溶液加入。共设10个处理,3次重复,共计30盆。
油菜采用装有蛭石的穴盘育苗,幼苗生长过程中浇灌全素营养液。待长出4片真叶后,将油菜移栽到容积1.5 L的塑料水培皿中,每盆4棵,24 h不间断曝气,每2天更换一次营养液。油菜移栽后就进行不同浓度的Mn处理,在Mn处理的第4天进行Cd处理,在Mn+Cd处理的第12天收样。
1.3 样品处理与分析
收获的油菜样品分为地上部和根部,根部采用0.02 mol·L-1的Na2EDTA溶液浸泡15 min,以去除表面残留的Mn和Cd[18];浸泡后的根系和地上部样品使用去离子水和超纯水冲洗干净,吸干水分,称取鲜重,备用。
根系形态特征分析采用的根系扫描仪为中晶ScanMaker i800 Plus (上海中晶科技有限公司), 分析软件为万深LA-S植物根系分析系统(杭州万深检测科技有限公司);分析指标包括:根长、表面积、体积、平均直径、根尖数,并将根系划分为:细根(直径 ≤ 0.4 mm)、中根(直径0.4~1.0 mm)、粗根(直径 ≥ 1.0 mm),分析不同直径范围根系的表面积。
完成根系形态分析后,将地上部和根部样品在90 ℃杀青30 min,70 ℃烘干至恒重,称量干重,粉碎混匀,加入浓HNO3(优级纯),在电热消解仪上(DigiBlock ED54,北京莱伯泰科仪器股份有限公司)进行消解,消解后样品的Mn、Cd含量使用电感耦合等离子体质谱仪(ICAPQc, Thermo Fisher Scientific)测定,采用波兰核化学与技术学院提供的东方巴斯马烟叶INCT-OBTL-5作为油菜元素含量分析的质量控制样品,各元素回收率均在95%~105%范围内。
1.4 数据分析及统计
采用SPSS 19.0软件对试验数据进行统计分析。通过单因素方差分析和最小显著差数法(LSD法)分析同一品种各处理间的差异显著性;采用配对t检验分析2个品种间的差异显著性。
2 结果与分析(Results and analysis)
2.1 镉胁迫下不同浓度锰处理对油菜生长的影响
由图1可知,2种油菜的根部和地上部生物量均受不同浓度Mn、Cd处理的影响。与正常Mn营养处理(Mn1)相比,Mn缺乏和过量处理没有对普通品种“寒绿”的根部生物量造成显著影响;而与Mn1相比,除Mn100处理外,Mn缺乏和过量处理均能显著减少(P< 0.05)镉低积累品种“华骏”的根部生物量,最高降幅分别达到51.7%和36.7%。就地上部来看,2种油菜生物量随Mn浓度升高表现出相同的变化规律。与Mn1处理相比,Mn缺乏和过量处理下油菜生物量都呈现降低趋势,其中Mn0、Mn0.1、Mn100处理显著降低“寒绿”和“华骏”的地上部生物量,降幅分别为32.0%~46.0%以及25.5%~42.0%,而Mn10处理下油菜生物量没有显著变化。
在油菜收获时发现Mn100处理下2种油菜均表现出明显的Mn中毒症状,即叶片皱缩,边缘发黄并伴有褐色斑点,根系呈现褐色,且分布有大量黑色斑点[19],其他处理下植株则没有这些症状。总的来看,“华骏”根系对Mn缺乏和过量的响应比“寒绿”敏感,2种油菜的地上部对Mn缺乏和过量的响应则没有显著差异。
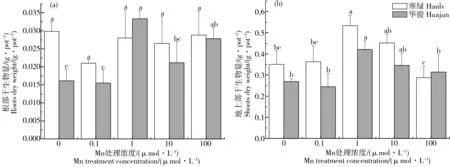
图1 不同Mn/Cd处理下油菜生物量注:(a)根部,(b)地上部;不同小写字母表示同一品种不同处理间差异显著(P < 0.05),下同。Fig. 1 Root and shoot biomass of Brasicia chinensis under different treatments of Mn and CdNote: (a) Roots, (b) Shoots; different letters show significant differences at the 0.05 level in the same cultivar, and the same below.
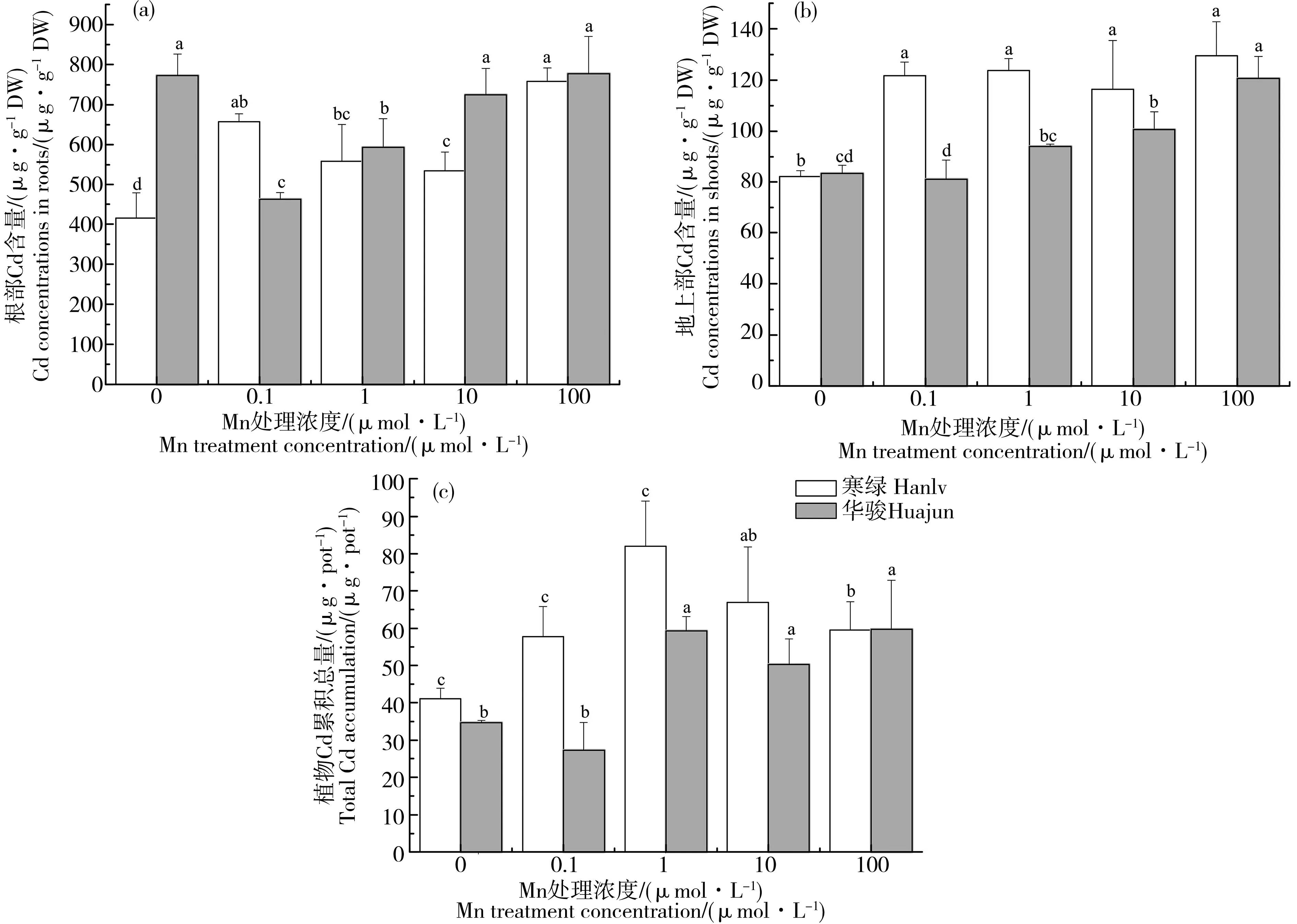
图2 不同Mn/Cd处理下油菜Cd累积注:(a)根部Cd含量,(b)地上部Cd含量,(c)植株Cd累积总量。Fig. 2 Cd accumulation in Brassica chinensis under different treatments of Mn and CdNote: (a) Cd concentrations in roots, (b) Cd concentrations in shoots, (c) total Cd accumulation.
2.2 镉胁迫下不同浓度锰处理对油菜镉累积的影响
由图2(a)可知,Cd胁迫下,不同浓度Mn处理对2种油菜根部Cd含量产生了不同影响。就“寒绿”来说,与Mn1处理相比,Mn0处理能显著降低其根部Cd含量且降幅达25.6%,Mn100处理能显著增加根部Cd含量且增幅达35.9%,而Mn0.1和Mn10处理均没有显著影响;就“华骏”来说,其根部Cd含量随Mn处理浓度的增加呈现先降低后升高的趋势, Mn0.1处理下根部Cd含量显著低于Mn1处理且降幅为22.0%,而Mn0、Mn10和Mn100处理下根部Cd含量显著高于Mn1处理,增幅为22.2%~31.1%。
图2(b)表明,2种油菜地上部Cd含量随Mn处理浓度升高呈上升趋势。对于“寒绿”,Mn0处理下Cd含量显著低于其他处理,而其他处理间没有显著差异;对于“华骏”,与Mn1处理相比,Mn0.1处理显著降低地上部Cd含量且降幅为13.8%,Mn100处理显著提高地上部Cd含量,增幅达28.4%,而Mn0和Mn10处理对地上部Cd含量没有显著影响。配对t检验表明,2个品种的根部Cd含量没有显著差异,而“华骏”的地上部Cd含量显著低于“寒绿”,与前期研究结果一致[16]。
植株Cd累积总量表示植株整体(包括根部和地上部)对Cd的累积量,能反映根系对Cd的吸收能力[20]。如图2(c)所示,对于“寒绿”,与正常Mn营养处理相比,缺Mn和Mn过量处理均能降低植株Cd累积总量,其中Mn0、Mn0.1和Mn100处理下植株Cd累积总量显著低于Mn1处理,降幅为27.4%~49.9%。对于“华骏”,与Mn1处理相比,Mn0和Mn0.1处理下植株Cd累积总量显著降低,降幅分别为41.4%和53.9%;而Mn10和Mn100处理下Cd累积总量没有显著变化。
2.3 镉胁迫下不同浓度锰处理对油菜锰含量的影响
由表1可知,不同浓度Mn处理下,2种油菜根部和地上部Mn含量变化规律相同,随着营养液中Mn浓度升高,油菜体内Mn含量呈现逐步升高的趋势。其中,Mn0、Mn0.1、Mn1 3个处理下油菜Mn含量没有显著差异;而在Mn过量处理下,除了Mn10处理下的“寒绿”地上部Mn含量外,油菜体内Mn含量显著高于Mn1处理。另外,配对t检验结果表明,2种油菜的根部和地上部Mn含量都没有显著差异。
2.4 镉胁迫下不同浓度锰处理对油菜根系形态的影响
在Cd胁迫下,不同浓度Mn处理对2种油菜根系形态参数有不同影响。对于“寒绿”,其根长随Mn处理浓度增加呈现先升高后降低的趋势,Mn0.1处理下根长值最大,显著高于其他处理,Mn10和Mn100处理下根长值显著低于Mn1处理,降幅分别为28.5%和33.3%;其余4个形态参数,包括表面积、体积、平均直径和根尖数,在不同浓度Mn处理下均无显著变化。对于“华骏”,根据各参数随Mn处理浓度变化的趋势可以将其分为2组。第一组为根长和根尖数,随Mn处理浓度升高呈上升趋势,Mn0和Mn0.1处理下2个参数值大部分显著低于Mn1处理,而Mn10和Mn100处理下参数值与Mn1处理相比没有显著变化;第二组包括表面积、体积和平均直径,随Mn处理浓度升高呈现先升高后降低的趋势,Mn1处理下各参数值最大,其余处理下绝大部分显著降低,其中根体积变化幅度最大,与Mn1处理相比,Mn0、Mn0.1、Mn10和Mn100处理下的降幅分别为85.1%、81.4%、71.0%和57.5%,其次是表面积,相应的降幅分别为70.2%、65.7%、49.4%和36.3%。
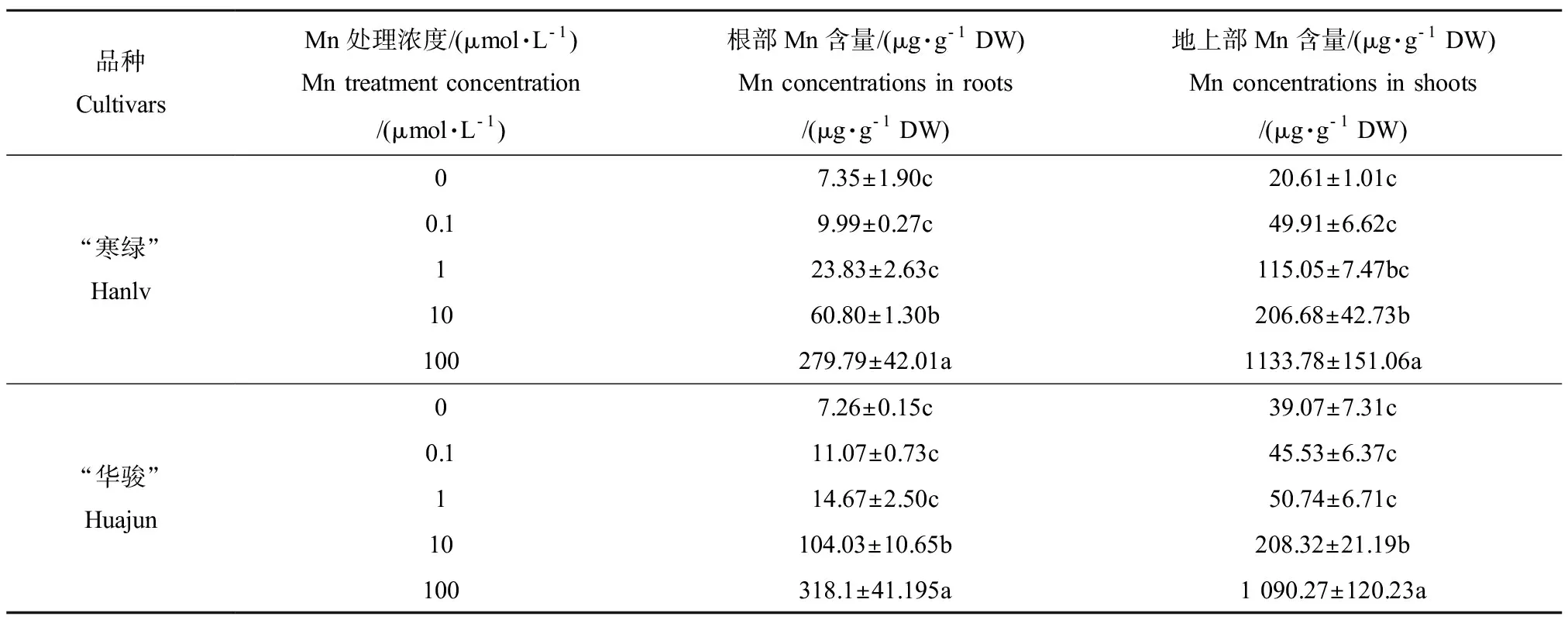
表1 不同Mn处理下油菜根部和地上部Mn含量Table 1 Mn concontrations in roots and shoots of Brassicia chinensis under different treatments of Mn
注:平均值±标准差(n=3)。同列不同小写字母表示同一品种不同处理间差异显著(P< 0.05),下同。
Note:Values are Means ± SD (n= 3). Different letters in the same column show significant differences at the 0.05 level in the same cultivar, and the same below.
表面积是根系与环境介质直接接触的重要指标。分析不同直径范围内的根系表面积分布可知(图3),Cd胁迫条件下不同浓度Mn处理对油菜细根和粗根的表面积影响较大,而对中根的表面积影响较小。对于“寒绿”,随着Mn处理浓度升高,细根表面积所占比例明显降低,从50.3%降低至36.6%,而粗根表面积所占比例呈现升高趋势,从31.4%升高至44.4%。对于“华骏”,在Mn1处理下细根表面积所占比例最低,为27.4%,而在Mn缺乏和过量处理下,细根比例都明显提高;相应地,粗根表面积所占比例在Mn1.0处理下最大,为51.4%,而在Mn缺乏和过量处理下,粗根比例都明显降低。
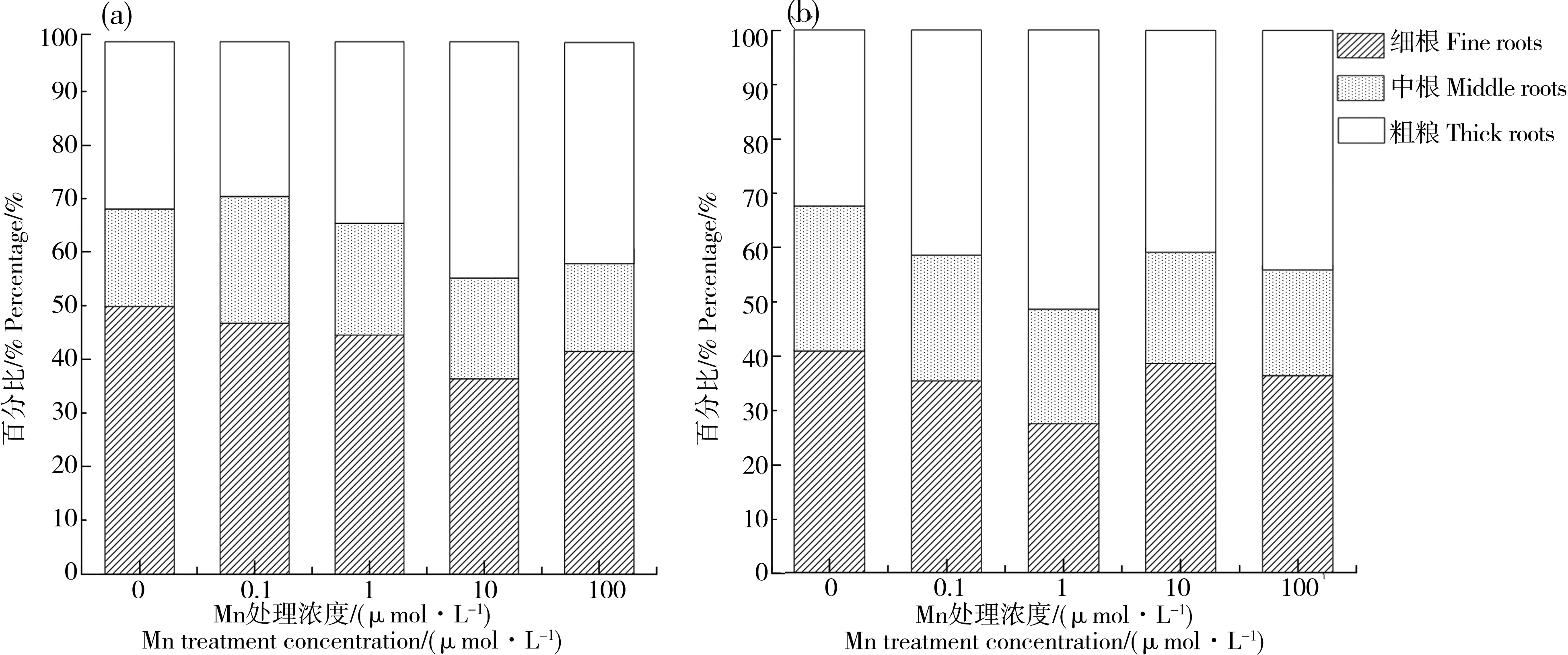
图3 不同Mn处理下油菜细根、中根及粗根的表面积所占比例注:(a) “寒绿”,(b) “华骏”。Fig. 3 The proportion of root surface area of fine, middle and thick roots of Brassicia chinensis under different Mn treatmentsNote: (a) Hanlv, (b) Huajun.
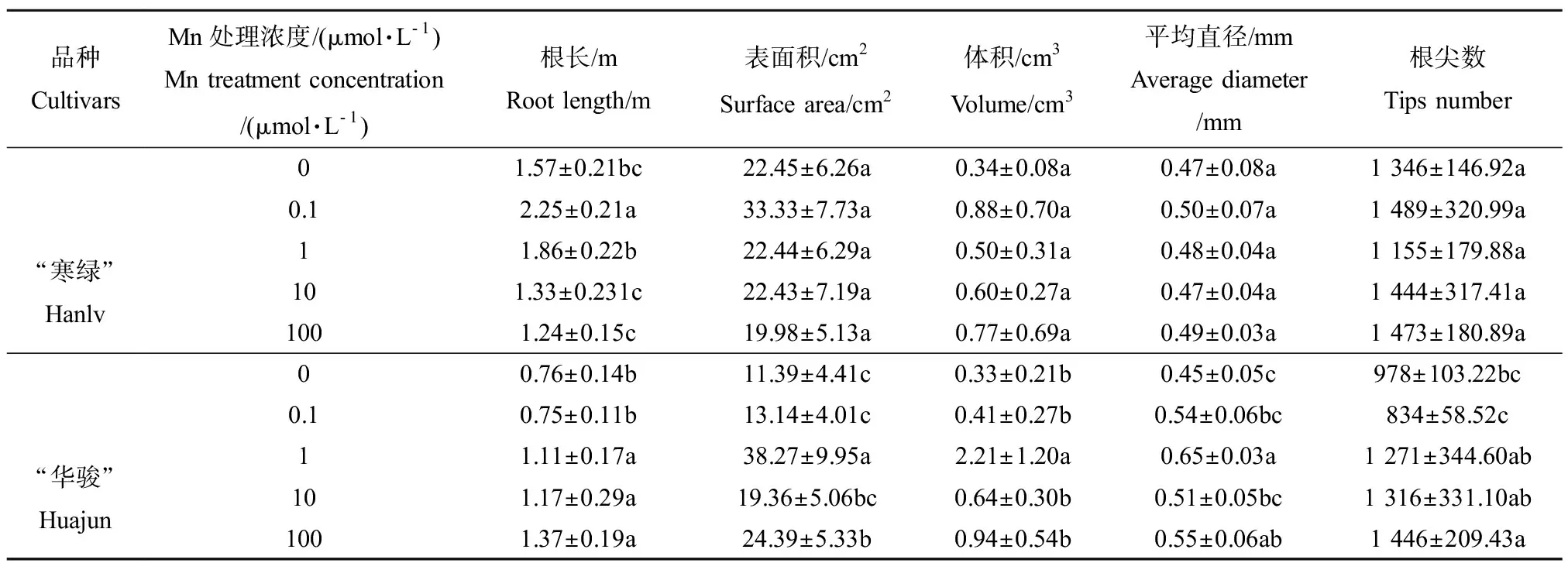
品种CultivarsMn处理浓度/(μmol·L-1)Mn treatment concentration/(μmol·L-1)根长/mRoot length/m表面积/cm2Surface area/cm2体积/cm3Volume/cm3平均直径/mmAverage diameter/mm根尖数Tips number“寒绿”Hanlv01.57±0.21bc22.45±6.26a0.34±0.08a0.47±0.08a1 346±146.92a0.12.25±0.21a33.33±7.73a0.88±0.70a0.50±0.07a1 489±320.99a11.86±0.22b22.44±6.29a0.50±0.31a0.48±0.04a1 155±179.88a101.33±0.231c22.43±7.19a0.60±0.27a0.47±0.04a1 444±317.41a1001.24±0.15c19.98±5.13a0.77±0.69a0.49±0.03a1 473±180.89a“华骏”Huajun00.76±0.14b11.39±4.41c0.33±0.21b0.45±0.05c978±103.22bc0.10.75±0.11b13.14±4.01c0.41±0.27b0.54±0.06bc834±58.52c11.11±0.17a38.27±9.95a2.21±1.20a0.65±0.03a1 271±344.60ab101.17±0.29a19.36±5.06bc0.64±0.30b0.51±0.05bc1 316±331.10ab1001.37±0.19a24.39±5.33b0.94±0.54b0.55±0.06ab1 446±209.43a
3 讨论 (Discussion)
Mn既是植物必需的微量元素,也是一种重金属元素,因此它在植物体内的作用具有两面性。一般认为,植物体内的正常Mn含量范围为20~600 mg·kg-1,体内Mn含量低于20 mg·kg-1可能会导致Mn缺乏。由于Mn在植物体内光合作用和氮代谢过程中发挥重要作用,因此Mn缺乏会显著影响植物光合作用和干物质积累,进而导致植物生长受到抑制,严重的会出现叶片失绿黄化症状[17-18]。在本研究中,缺Mn处理下2种油菜根系Mn含量都低于20 mg·kg-1,但是只有“华骏”的根系生物量显著降低,而“寒绿”则没有明显变化,这可能与二者对Mn缺乏的耐受能力不同有关;而2种油菜地上部Mn含量在缺Mn条件下都高于20 mg·kg-1,但是地上部生物量与正常Mn营养处理相比都显著降低。研究发现,在严重缺Mn土壤上不施用Mn肥的条件下,多个品种的小麦地上部生物量显著降低,而其Mn含量却高于20 mg·kg-1,且不同品种间没有显著差异,研究者据此认为地上部Mn含量不宜作为评价小麦耐缺Mn能力的指标[22]。当Mn含量超过600 mg·kg-1,植物可能会出现Mn中毒症状,包括叶片萎蔫坏死、叶片厚度减小、节间缩短和生物量降低等[19]。在本研究中,Mn100处理下,2种油菜地上部Mn含量明显高于600 mg·kg-1,这是导致该处理下油菜出现Mn中毒症状的主要原因。
研究表明,同种植物的不同基因型对Mn缺乏和毒害的耐受能力不同,生理生化响应也存在差异[23-24]。本研究中在Mn缺乏和过量处理下,2种镉吸收能力不同的油菜生物量、根系形态以及镉累积也表现出不同的变化规律。对于“华骏”,在Mn缺乏时,根部Mn含量低于临界水平,根系生长受到严重影响,从而制约了其对养分的吸收,根部干重和5个根系形态参数大部分都显著降低,其Cd累积总量、地上部Cd含量大部分也显著降低。而在Mn过量时,由于Mn毒害作用,“华骏”根部干重以及表面积、体积、平均直径等根系形态参数受到了严重影响。有研究表明,Mn毒害会严重影响多种植物的根系质膜透性和完整性[25],这可能会削弱根系镉吸收的屏障,进而提高植物被动镉吸收量,在Mn过量处理下“华骏”根部和地上部镉含量升高可能与此有关,但是由于根部和地上部生物量都明显降低,最终植株Cd累积总量并没有显著变化。
对于“寒绿”,情况更为复杂。在Mn0.1处理下,根系生物量并未受到显著影响,根长反而显著升高,这说明“寒绿”根系对Mn缺乏耐受能力较强,在Mn缺乏时会提高根系吸收能力,以获取更多营养,然而这也提高了其根部Cd含量,但是由于地上部生物量显著降低,最终其Cd累积总量显著降低;而在Mn100处理下,“寒绿”根系生物量虽未受到影响,但是其根长显著降低,地上部生物量也明显降低,并表现出Mn毒害症状,这表明Mn过量处理同样严重影响了“寒绿”的生长发育,与“华骏”类似,其镉吸收的屏障也可能遭到破坏,进而导致根系镉含量显著升高,但是由于地上部生物量显著降低和镉含量没有显著变化,造成其Cd累积总量显著降低。
总的来看,在Mn缺乏时,2种油菜根系生长发育和养分吸收功能会受到显著影响,同时地上部生物量也显著降低,地上部Cd含量有所降低,最终导致植株Cd累积总量显著降低;而在Mn过量时,由于Mn的毒害作用,根系镉吸收屏障被破坏,对镉的吸收随之提高,造成根系Cd含量升高,但是由于生物量降低,Cd累积总量没有变化或显著降低。
在植物生长过程中,不同直径的根系发挥不同的生理功能,其中直径较小的细根是根-土界面物质交换的主要位置,在养分和水分吸收方面发挥主要作用;而直径较大的粗根,其内部运输组织发育完全,是水分和养分储存运输的主要部位,因此不同直径根系比例的变化和根系的养分吸收功能密切相关[26]。从根系表面积分级的变化规律来看,在缺Mn时2个品种策略一致,即增加细根比例,降低粗根比例,增强对养分的吸收能力,“华骏”的变化更明显,有研究发现,在低氮胁迫下,玉米主要通过增加细根比例,增加根表面积,从而使植物能吸收更多的氮素[27],这和本研究的结果相似;在Mn过量时2个品种策略不同,“寒绿”提高了粗根比例,减少细根比例,力图减少吸收,降低过量Mn的毒害,在研究硒镉互作对水稻根系的影响时也发现,添加硒会提高水稻粗根比例,降低细根比例,从而抑制根系对镉的吸收[28];而“华骏”则提高了细根比例,减少粗根比例,增强根系的养分和水分吸收能力,提高对Mn毒害的抗性,在研究CO2浓度升高对2个黑麦草属植物根系和Cd累积影响时也发现,在镉胁迫条件下CO2浓度升高会提高植物细根比例,增强根系吸收水分和养分能力,从而有效缓解Cd毒害[29]。
通讯作者简介:王林(1980—),男,生态学博士,副研究员,主要从事农田重金属污染修复与安全利用研究,在国内外学术期刊发表20余篇相关论文。
参考文献(References):
[1] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17) [2017-07-19]. http://www.mlr.gov.cn/xwdt/jrxw/201404 /t20140417_1312998.htm.
[2] Zeng X B, Li L F, Mei X R, et al. Heavy metal content in Chinese vegetable plantation land soils and related source analysis [J]. Agricultural Sciences in China, 2008, 7(9):1115-1126
[3] 徐震, 田丽梅, 江应松, 等. 天津市污灌区农田环境质量现状分析[J]. 天津农林科技, 1999, 152(6): 26-28
Xu Z, Tian L M, Jiang Y S, et al. Analysis on present situation of farmland environmental quality in sewage irrigation district of Tianjin [J]. Tianjin Agricultural Science and Tecnology, 1999, 152(6): 26-28 (in Chinese)
[4] 师荣光, 赵玉杰, 高怀友, 等. 天津市郊蔬菜重金属污染评价与特征分析[J]. 农业环境科学学报, 2005, 24 (S1): 169-173
Shi R G, Zhao Y J, Gao H Y, et al. Metals influencing the level of heavy metal contamination of vegetables in Tianjin City as derived by principal components anlysis [J]. Journal of Agro-Environment Science, 2005, 24 (S1):169-173 (in Chinese)
[5] Videa J P, Lopez M L, Narayan M, et al. The biochemistry of environmental heavy metal uptake by plants: Implications for the food chain [J]. The International Journal of Biochemistry and Cell Biology, 2009, 41(8-9): 1665-1677
[6] Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice [J]. The Plant Cell, 2012, 24(5): 2155-2167
[7] Yang M, Zhang Y Y, Zhang L J, et al. Nramp5 contributes to manganese translocation and distribution in rice shoots [J]. Journal of Experimental Botany, 2014, 65(17):4849-4861
[8] 蓝兰, 喻华, 冯文强, 等. 不同中微量及有益元素对小麦吸收镉的影响[J]. 水土保持学报, 2010, 24(5): 54-58
Lan L, Yu H, Feng W Q, et al. Effects of secondary, micro-and benificial elements on wheat growth and cadmium uptake[J]. Journal of Soil and Water Conservation, 2010, 24(5): 54-58 (in Chinese)
[9] 覃都. 水稻镉积累的锰、氮调控研究[D]. 重庆: 西南大学, 2009: 63
Tan D. Investigation of manganese, nitrogen regulation on cadmium accumulation in rice plants [D]. Chongqing: Southwest University, 2009: 63 (in Chinese)
[10] 周相玉, 冯文强, 秦鱼生, 等. 镁、锰、活性炭和石灰及其交互作用对小麦镉吸收的影响[J]. 生态学报, 2013, 33(14): 4289-4296
Zhou X Y, Feng W Q, Qin Y S, et al. Effects of magnesium, manganese, activated carbon and lime and their interactions on cadmium uptaked by wheat [J]. Acta Ecologica Sinica, 2013, 33(14): 4289-4296 (in Chinese)
[11] Hernández L E, Lorodrgue E L, Gárate A, et al. Influence of cadmium on the uptake, tissue accumulation and subcellular distribution of manganese in pea seedlings[J]. Plant Science, 1998, 132(2): 139-151
[12] Peng K J, Luo C L, You W X, et al. Manganese uptake and interactions with cadmium in the hyperaccumulator—PhytolaccaamericanaL [J]. Journal of Hazardous Materials, 2008, 154(1-3): 674-681
[13] Liu H M, Zhang Y X, Chai T Y, et al. Manganese-mitigation of cadmium toxicity to seedling growth ofPhytolaccaacinosaRoxb. is controlled by the manganese/cadmium molar ratio under hydroponic conditions [J]. Plant Physiology and Biochemistry, 2013, 73: 144-153
[14] Zornoza P, Sánchezpard O B, Carpena R O. Interaction and accumulation of manganese and cadmium in the manganese accumulatorLupinusalbus[J]. Journal of Plant Physiology, 2010, 167: 1027-1032
[15] 何俊瑜, 王阳阳, 任艳芳, 等. 镉胁迫对不同水稻品种幼苗根系形态和生理特性的影响[J]. 生态环境学报, 2009, 18(5): 1863-1868
He J Y, Wang Y Y, Ren Y F, et al. Effect of cadimium on root morphology and physiology characteristics of rice seedlings [J]. Ecology and Environment, 2009, 18(5): 1863-1868 (in Chinese)
[16] Wang L, Xu Y M, Sun Y B, et al. Identification of pakchoi cultivars with low cadmium accumulation and soil factors that affect their cadmium uptake and translocation[J]. Frontiers of Environmental Science & Engineering, 2014, 8(6): 877-887
[17] 王景安, 张福锁. 锌对不同基因型玉米缺锌后的恢复效果及胚乳在缺锌中的作用[J]. 中国生态农业学报, 2003, 11(3): 78-81
Wang J A, Zhang F S. Effects of different zinc concentrations on maize restoration after zinc deficiency and the function of endosperm in zinc deficency [J]. Chinese Journal of Eco-Agriculture, 2003, 11(3): 78-81 (in Chinese)
[18] 代晶晶, 徐应明, 王林, 等. 不同锌营养下喷施锌肥对油菜生长和元素含量的影响[J]. 环境化学, 2017, 36(5): 1017-1025
Dai J J, Xu Y M, Wang L, et al. Effect of foliar zinc application on growth and elements concentrations of pakchoi under different zinc nutrition status [J]. Environmental Chemistry, 2017, 36(5): 1017-1025 (in Chinese)
[19] 张玉秀, 李林峰, 柴团耀, 等. 锰对植物毒害及植物耐锰机理研究进展[J]. 植物学报, 2010, 45(4): 506-520
Zhang Y X, Li L F, Chai T Y, et al. Mechanisms of manganses toxicity and manganese tolerance in plants [J]. Chinese Bulletin of Botany, 2010, 45(4): 506-520 (in Chinese)
[20] Xin J L, Huang B F, Dai H W, et al. Characterization of cadmium uptake, translocation, and distribution in young seedlings of two hot pepper cultivars that differ in fruit cadmium concentration[J]. Environmental Science and Pollution Research, 2014, 21(12): 7449-7456
[21] 安振锋, 方正. 植物锰营养研究进展[J]. 河北农业科学, 2002, 4(6): 35-42
An Z F, Fang Z. The advance of manganese nutrition in plant [J]. Journal of Hebei Agricultural Sciences, 2002, 4(6): 35-42 (in Chinese)
[22] 陆景陵. 植物营养学(上册)[M]. 北京: 中国农业大学出版社, 2005: 87-91
Lu J L. Plant Nutrition (volime one) [M]. Beijing: China Agricultural University Press, 2005: 87-91 (in Chinese)
[23] 张福锁, 吕世华, 方正. 不同小麦品种(品系)耐缺锰能力的比较研究[J]. 植物营养与肥料学报, 1998, 4(3): 277-283
Zang F S, Lv S H, Fang Z. Sdudy on tolerance of different wheat cultivars or lines to manganese deficiency [J]. Journal of Plant Nutrition and Fertilizer, 1998, 4(3): 277-283 (in Chinese)
[24] 严炜. 大豆适应锰毒害的生理和分子机理研究[D]. 海口: 海南大学, 2010: 58
Yan W. Physiological and molecular mechanisms of soybean (Glycinemax) adaptation to manganese stress [D]. Haikou: Hainan University, 2010: 58 (in Chinese)
[25] 任立民, 刘鹏, 蔡妙珍, 等. 水蓼、小飞蓬、杠板归和美洲商陆对锰毒的生理响应[J]. 水土保持学报, 2007, 21(3): 81-85
Ren L M, Liu P, Cai M Z, et al. Physiological response ofPolygonumhydropiper,Comnyzacanadensis,PolygonumperfoliatumandPhytolaccaamericanato manganese toxicity [J]. Jounral of Soil and Water Conservation, 2007, 21(3): 81-85 (in Chinese)
[26] Wang R G, Dai S X, Tang S R, et al. Growth, gas exvhange, root morphology and cadmium uptake responses of poplars and willows grown on cadmium-contaminated soil to elevated CO2[J]. Environmental Earth Sciences, 2012, 67(1): 1-13
[27] 屈佳伟, 高聚林, 王志刚, 等. 玉米根系特征的基因型差异及与氮吸收效率的关系[J]. 玉米科学, 2016, 24(2): 72-78
Qu J W, Gao J L, Wang Z G, et al. Genotype differences in root characteristics by maize and its relations to nitrogen uptake efficiency [J]. Journal of Maize Science, 2016, 24(2): 72-78 (in Chinese)
[28] Ding Y Z, Feng R W, Wang R G, et al. A dual effect of Se on Cd toxicity: Evidence from plants growth, root morphology and responses of the antioxidative systems of paddy rice [J]. Plant and Soil, 2014, 375(1-2): 289-301
[29] Jia Y, Tang S R, Ju X H, et al. Effects of elevated CO2levels on root morphological traits and Cd uptakes of two lolium species under Cd stress [J]. Journal of Zhejiang University-Science, 2011, 12(4): 313-325

