沙尘暴源区土壤盐碱扬尘对大鼠呼吸系统的免疫损伤
程志斌,刘艳菊,*,郭青云,李俊芳,单云芳,钟震宇,张婷婷
1. 北京麋鹿生态实验中心,北京 100076 2. 北京市理化分析测试中心, 北京 100089
经济社会发展给我国带来的环境污染问题日益加剧[1-3],其中春季频繁发生的沙尘暴天气,给人们生活和健康带来很大威胁[4-5]。沙尘暴是潜在的过敏性和非过敏性系统疾病的诱发因素[6],且与风湿病、黑热病、尤其与肺炎发病有关[7-9]。沙尘暴发生时高浓度的细颗粒物在传输过程中可吸附重金属元素、有机污染物以及病毒、细菌等物质,经呼吸道进入人体后可导致免疫功能下降,引起肺病、中风、心血管等疾病[8, 10-12]。甘肃武威地区在沙尘暴出现时儿童咳嗽、气短等呼吸道疾病以及眼睛干涩、流泪等症状均升高,当天及此后的1~2 d内呼吸系统疾病案例显著增加,研究表明这与PMl0浓度正相关[13-14]。北京地区沙尘天气时高浓度的PM2.5和PM10也导致心脑血管疾病日入院人次增加[15]。因此,沙尘暴的源地解析[16-19]和细颗粒物毒理效应[20-22]的研究日益受到关注。近年来,中国北部、伊朗、印度北部、沙特阿拉伯西部等地区相继报道大规模沙尘暴暴发源头的研究[23-26]。细颗粒毒理效应研究发现,沙尘暴期间的PM2.5悬液对大鼠心、肝、肺等组织有不同程度的氧化损伤作用,且对肺细胞DNA损伤程度与浓度正相关,而急剧增高的浓度使沙尘暴毒性作用更强[27-28]。Naimabadi等[21]的研究也表明,沙尘暴天气比正常天气的PM2.5浓度更高,对人肺的生物学毒性更严重,而且沙尘暴PM2.5对人支气管上皮细胞造成的伤害与其组成成分密切相关[29]。
我国北方沙尘暴主要来自河西走廊及阿拉善高原区、内蒙古中部农牧交错带及草原区、塔克拉玛干沙漠周边区、蒙陕宁长城沿线旱作农业区等四大沙尘源区[30]。而盐碱地是沙尘暴一个新的来源[31]。北京属于沙尘暴高发的城市之一,沙尘暴发生时,内蒙盐碱地附近被风卷起的扬尘往往会导致牲畜呼吸困难、流泪甚至死亡的现象,然而关于沙尘暴源区土壤盐碱扬尘对动物健康的影响机制尚未见报道。本文旨在通过大鼠急性染毒实验,分析观察采自安固里诺尔干盐湖的不同浓度土壤盐碱扬尘对大鼠血常规、气管和肺组织结构,及对肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和血浆中氧化炎症因子的影响,为揭示沙尘暴污染源土壤盐碱扬尘对动物的毒害机理提供重要依据。
1 材料与方法(Materials and methods)
1.1 材料制备
土壤盐碱扬尘样品及实验溶剂制备:2014年4月在距北京200多公里的张家口张北地区的安固里诺尔干盐湖(N41.316°,E114.350°)采集0~5 cm盐碱表土,风干过200 目钢筛,获得土壤盐碱扬尘样品。取5 g土壤盐碱扬尘样本浸入15 mL去离子水中,超声提取60 min,用一次性针筒和 0.45 μm PTFE过滤头过滤后进行离子浓度测定。另取5 g土壤盐碱扬尘用于配制染毒试剂。
供试大鼠:北京华阜康生物科技股份有限公司提供(合格证号:11003800008188)的32只7周龄SPF级Wistar雄性大鼠,在北京实验动物研究中心SPF实验动物房饲养,实验前适应环境饲养一周。实验时体重(200±20) g。
1.2 土壤盐碱扬尘水溶液制备及水溶性离子分析
水溶性离子采用ICS 2000 离子色谱仪(美国,Dionex公司) 分析。水溶性阴离子(F-、Cl-、NO3-、SO42-)采用阴离子分析柱(IonpacAS19 型,美国Dionex公司)(250 mm ×4 mm),EGC 淋洗液自动发生器在线自动产生15 mmol·L-1的KOH 淋洗液,以1 mL·min-1的流速等浓度淋洗,进样量25 μL。抑制器采用外接水模式,59 mA 抑制。水溶性阳离子(Na+、NH4+、Ca2+、K+、Mg2+) 采用阳离子分析柱(IonpacCS12A,美国Dionex公司)(250 mm×4 mm),淋洗液为20 mmol·L-1甲烷磺酸,1 mL·min-1等浓度淋洗,进样量25 μL,抑制器采用外接水模式,60 mA抑制。实验在选定的色谱条件下考察了方法的检出限、精密度和线性范围。配制2 μg·mL-1混合标准溶液,连续进样7针,按峰面积计算,标准偏差小于6%。按照信噪比(S/N=3)计算,方法检出限为1.3~4.2 ng·mL-1,在0.01~100 μg·mL-1范围内线性良好,线性系数大于0.9990。为了考察提取方法的可靠性,对样品进行加标回收实验,加标回收率在92.3%~99.8%之间。
1.3 染毒试剂的配制及实验分组
用0.9%的生理盐水为溶剂配制土壤盐碱扬尘浓度分别为0 mg·mL-1、1.5 mg·mL-1、7.5 mg·mL-1和37.5 mg·mL-1的急性染毒滴剂,-80 ℃低温冰箱保存备用。依据大鼠单位体重滴注不同土壤盐碱扬尘浓度,将实验分为4个处理:生理盐水对照组(0 mg·kg-1)、低浓度组(1.5 mg·kg-1)、中浓度组(7.5 mg·kg-1)和高浓度组(37.5 mg·kg-1)。
1.4 染毒方式
染毒前,将土壤盐碱扬尘悬液超声振荡5 min。用乙醚将大鼠麻醉后,取仰位固定于染尘架上,使用灌胃针进行非暴露式气管内注入法滴注实验[32],32 只鼠分4个处理,分别滴注0.2 mL上述已配制好的相应浓度的染毒滴剂,每个处理8只大鼠。染毒24 h,乙醚麻醉,进行后续采样分析。
1.5 大鼠呼吸系统免疫指标的测试
1.5.1 大鼠血液、血浆及BALF样品的制备
眼球采血,一部分置EDTA-K2抗凝管,4 ℃保存,24 h内进行血常规检测;另一部分置普通促凝管,3 000 r·min-1离心,取上层血浆于-80 ℃保存,用于检测炎症因子。
取血后打开胸腔,暴露出完整的气管和肺组织,对右肺做肺泡灌洗,将3 mL生理盐水缓慢注入肺内,同时轻轻按摩胸壁,3秒后缓慢抽出灌洗液,3 000 r·min-1、4 ℃离心,上清液分装,-80 ℃保存,用于检测炎症因子。
1.5.2 血细胞分析
使用全自动动物血液细胞分析仪(BC-2800Vet,中国迈瑞)分析血液里的18 个血常规指标,可归结为3类功能细胞,即白细胞(白细胞数WBC、淋巴细胞数目LYM#、中间细胞数目MID#、中性粒细胞数目GRA#、淋巴细胞百分比LYM%、中间细胞百分比MID%、中性粒细胞百分比GRA%),红细胞(红细胞数目RBC、血红蛋白HGB、平均红细胞血红蛋白浓度MCHC、平均红细胞体积 MCV、平均红细胞血红蛋白含量MCH、红细胞分布宽度变异系数RDW-CV、红细胞压积HCT),和血小板(血小板数目PLT、平均血小板体积MPV、血小板分布宽度PDW、血小板压积PCT)。
1.5.3 血浆及BALF的炎症因子测试
TGF-β1(transforming growth factor-β1,转化生长因子β1)检测方法为双抗体夹心法。试剂盒为大鼠TGF-β1 ELISA检测试剂盒(CK-E00078R,北京冬歌博业生物科技有限公司)。仪器为全自动光吸收酶标仪(Sunrise,瑞士Tecan)。
LDH(lactate dehydrogenase,乳酸脱氢酶)检测方法为乳酸底物法。试剂盒为北京北检·新创源生物技术有限公司(20160120)。仪器为全自动生化仪(120,日本东芝)。
T-AOC(total antioxidation,总抗氧化能力)检测方法为可见光法。试剂盒为南京建成生物工程研究所(A015)。仪器为可见光分光光度计(721型,中国上海光学仪器厂)。
IL-6(interleukin-6,白介素-6)和TNF-α(tumor necrosis factor-α,肿瘤坏死因子-α)检测方法为放射免疫法。试剂盒为北京北方生物技术研究所自行研制(20160320)。仪器为放射免疫仪(XH6080,中国西安核仪器厂)。
1.5.4 肺和气管组织病理切片制备和染色
采集左肺(同一部位)和气管组织(避开咽喉部位),用福尔马林固定,制作肺细支气管切片、气管切片。肺组织采用HE染色,气管组织采用HE染色和PAS染色。
1.6 数据分析
使用Excel和SPSS 17.0求平均值和标准差,对各组之间的差异性进行单因素方差分析(One-Way ANOVA),方差齐性采用LSD检验,方差非齐性采用Dunnett’s T3检验,并绘制柱状图(平均值和标准误)。
2 结果(Results)
2.1 土壤盐碱扬尘水溶性离子含量
土壤盐碱扬尘中10种水溶性离子含量见表1,其中,Cl-的含量为16 581.4μg·g-1,在所有离子中占绝对优势,其次是Na+的含量,为13 547.1μg·g-1,SO42-含量位居第三,为4 536.2μg·g-1, F-和Mg2+含量最低。与河北地区农耕地水溶性离子[33]相比,Na+、K+、Mg2+、Ca2+、NH4+、F-、Cl-、NO2-、NO3-、SO42-分别是其589.0倍、0.6倍、1.2倍、0.2倍、192.6倍、2.2倍、554.6倍、2.1倍、5.1倍和7.6倍,表明盐碱地的离子浓度普遍高于农耕地离子浓度。
2.2 土壤盐碱扬尘染毒对雄性大鼠血液生理指标的影响
白细胞能吞噬异物,浆细胞产生抗体,在机体损伤治愈、防御病原的入侵和对疾病的免疫方面起着重要作用。由表2和差异显著性分析可知,染毒可提高雄性大鼠的WBC、Lymph#和Gran%的平均值,且中浓度染毒可显著提高大鼠的Lymph#(P< 0.05),暗示大鼠存在感染或感染风险。染毒后大鼠的Mid#、Gran#、Lymph%、Mid%未表现出规律变化。
红细胞是体内携带、运输及清除循环免疫复合物(CIC)的主要承担者,且与其他免疫活性细胞如T 淋巴细胞、B淋巴细胞及吞噬细胞等有着密切的联系。本实验分析结果表明,染毒可普遍提高雄性大鼠的HGB、MCHC、MCH和MCV均值,中、高浓度土壤盐碱扬尘染毒还可提高RBC均值,且低浓度土壤盐碱扬尘染毒可显著提高大鼠的MCV(P< 0.05),高浓度土壤盐碱扬尘染毒可显著降低大鼠的RDW-CV%(P< 0.05),暗示大鼠通过提高红细胞数目和调整红细胞分布宽度来协助清除炎症细胞的可能性。HCT%染毒后没有表现出规律变化。
血小板在止血、伤口愈合、炎症反应、血栓形成及器官移植排斥等生理和病理过程中有重要作用。血小板增多症常见于急慢性炎症、缺铁性贫血及癌症患者。本实验结果表明,低浓度土壤盐碱扬尘染毒可升高PLT、MPV、PDW均值,高浓度土壤盐碱扬尘染毒可升高PCT%,但不具有显著性(P> 0.05),且随着染毒浓度增高未呈现规律变化。
综合血常规指标,土壤盐碱扬尘染毒具有普遍提高雄性大鼠的白细胞、红细胞关键参数指标的趋势,但差异多不显著(P> 0.05)。
2.3 土壤盐碱扬尘染毒对雄性大鼠血浆氧化炎症因子的影响
由图1可知,中、高浓度土壤盐碱扬尘染毒可显著降低雄性大鼠血浆中T-AOC的活性(P< 0.05)。所有浓度染毒均显著提高TGF-β1的分泌(P< 0.05)。土壤盐碱扬尘染毒可降低IL-6含量(P>0.05)、高浓度染毒可升高LDH含量,中、高浓度染毒升高TNF-α含量,但均不存在显著差异(P> 0.05)。可见,土壤盐碱扬尘染毒后,通过抗氧化能力的显著降低和TGF-β1的显著升高来造成对雄性大鼠的伤害。
2.4 土壤盐碱扬尘染毒对雄性大鼠BALF氧化炎症因子的影响
由图2可知,随着土壤盐碱扬尘浓度增加,大鼠BALF中T-AOC活性也逐渐降低,但无显著差异(P> 0.05);不同土壤盐碱扬尘浓度对大鼠BALF中IL-6含量影响与T-AOC变化相似,但高浓度染毒组大鼠BALF中IL-6含量显著低于生理盐水对照组(P< 0.05)。但是,不同土壤盐碱扬尘浓度对大鼠BALF中TGF-β1含量的影响则与T-AOC和IL-6相反,且中、高浓度土壤盐碱扬尘组大鼠BALF中TGF-β1含量显著高于生理盐水对照组和低浓度土壤盐碱扬尘组(P< 0.05)。另外,随着土壤盐碱扬尘浓度的升高,大鼠BALF中TNF-α和LDH含量先降低后升高,且高浓度染毒组显著高于低浓度染毒组(P< 0.05)。总之,土壤盐碱扬尘染毒造成肺泡细胞中T-AOC活性呈下降趋势,代表大鼠肺抗氧化功能的降低。高浓度染毒显著降低了肺泡细胞IL-6的分泌,表现出对肺抗炎功能的抑制;同时中、高浓度染毒下肺泡细胞中TGF-β1的分泌显著升高,表现出肺抗炎功能的促进,这些结果显示土壤盐碱扬尘染毒对不同氧化炎症因子的复杂效应。

表1 土壤盐碱扬尘水溶性离子浓度(μg ·g-1)Table 1 Concentration of soluble ionic in soil saline-alkali dust (μg·g-1)
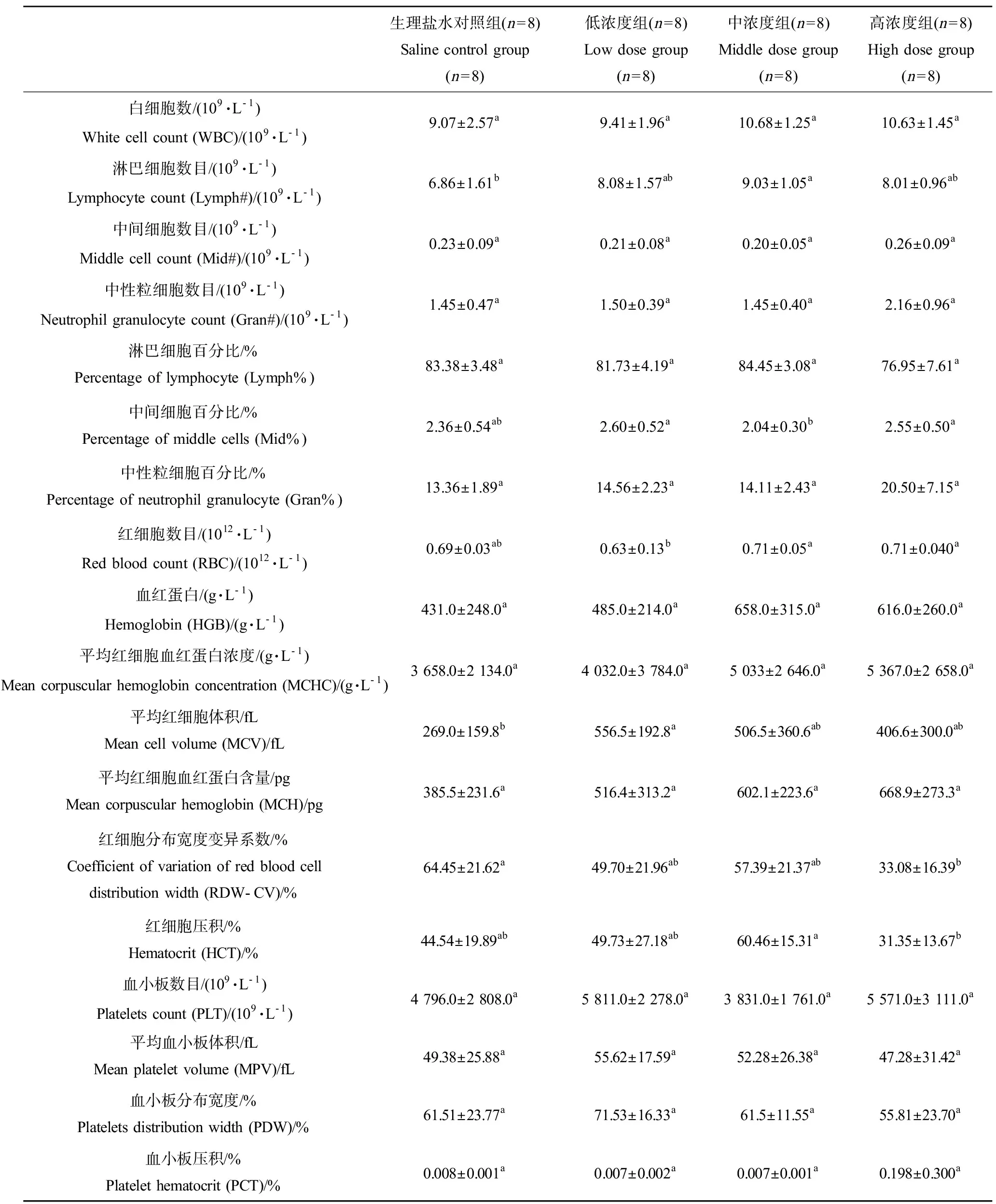
表2 不同浓度土壤盐碱扬尘急性染毒对雄性大鼠血液生理指标的影响Table 2 Influence of acute exposure to different concentration of soil saline-alkali dust on blood physiological parameters of male rats
注:同一参数具有相同字母的2个处理之间无显著差异(P> 0.05),不具有相同字母的2个处理之间具有显著差异(P< 0.05)。
Notes: There is no significant difference between two treatments with same letter atP> 0.05, and there is significant difference between two treatments without same letter atP< 0.05.

图1 不同浓度土壤盐碱扬尘急性染毒对雄性大鼠血浆中氧化炎症因子的影响注:同一参数具有相同字母的2个处理之间无显著差异(P >0.05),不具有相同字母的2个处理之间具有显著差异(P <0.05)。Fig. 1 Influence of acute exposure to different concentrations of soil saline-alkali dust on plasma inflammatory factors of male ratsNotes: There is no significant difference between two treatments with same letter at P > 0.05, and there is significant difference between two treatments without same letter at P < 0.05.
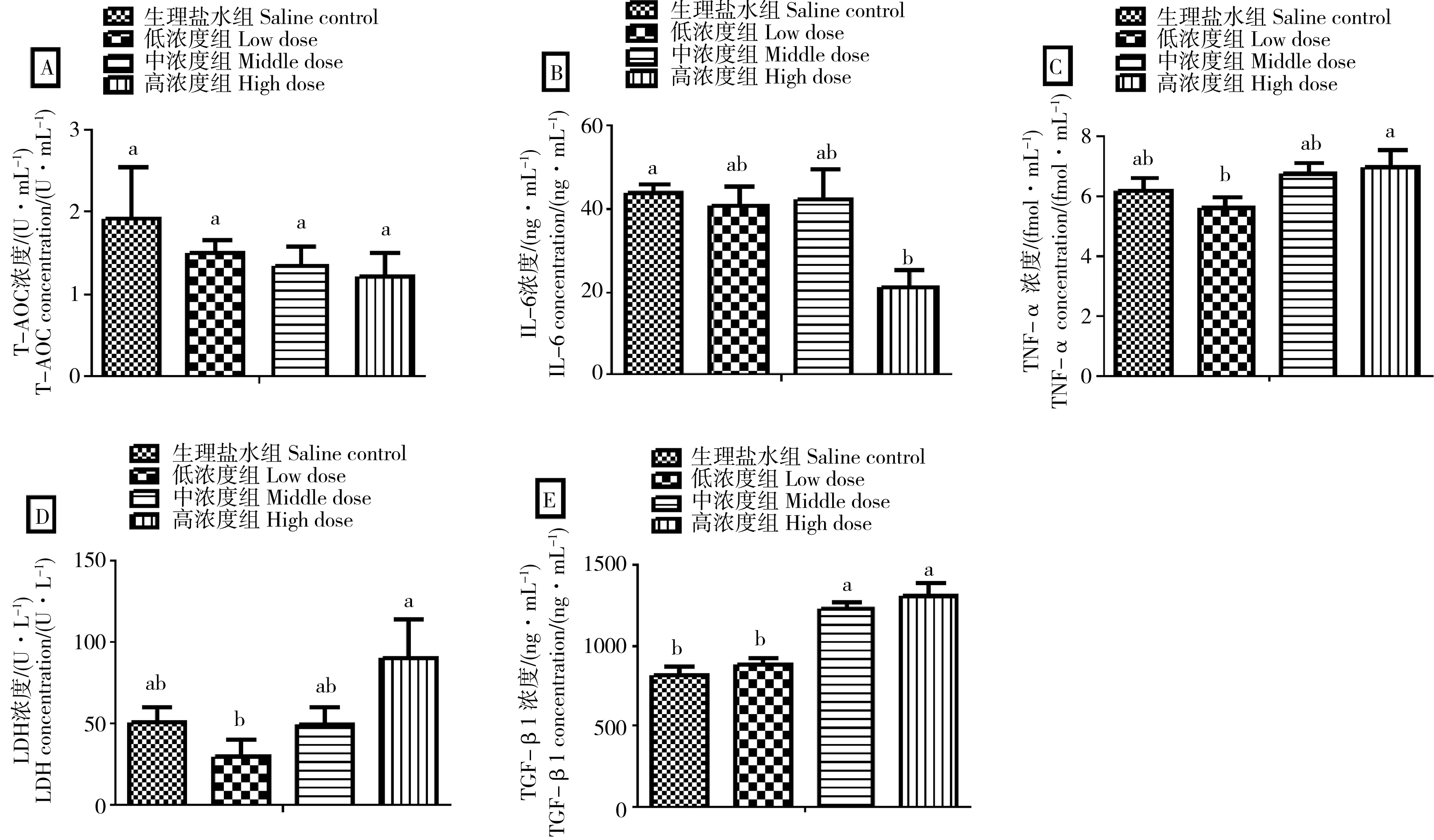
图2 不同浓度土壤盐碱扬尘对雄性大鼠BALF的炎症因子的影响注:同一参数具有相同字母的2个处理之间无显著差异(P > 0.05),不具有相同字母的2个处理之间具有显著差异(P < 0.05)。Fig. 2 Influence of acute exposure to different concentrations of soil saline-alkali dust on BALF inflammatory factors of male ratsNotes: There is no significant difference between two treatments with same letter at P > 0.05, and there is significant difference between two treatments without same letter at P < 0.05.
2.5 不同浓度土壤盐碱扬尘染毒对雄性大鼠的肺及气管组织病理变化的影响
病理组织观察发现,生理盐水对照组大鼠气管黏膜轻微充血或轻微脱落(图3 A-1、A-2),而土壤盐碱扬尘染毒后气管黏膜充血较严重:低浓度染毒后气管黏膜块状脱落(图3 B-1、B-2),中、高浓度染毒气管黏膜脱落较严重、气管黏膜与气管软骨之间的间质细胞死亡较多(图3 C-1、C-2),且高浓度染毒后气管软骨容易脱离并严重损伤(图3 D-1、D-2)。这一现象表明:尽管生理盐水急性染毒也会对气管组织造成轻微伤害,但土壤盐碱扬尘急性染毒会对气管组织造成明显的炎症病变,会导致气管软骨和膜性组织损伤,对气管存在急性毒性作用,且随着土壤盐碱扬尘染毒试剂浓度的升高,气管病理组织伤害加重。
土壤盐碱扬尘急性染毒实验中,生理盐水对照组肺泡存在轻微充血,肺泡壁增厚,肺泡细支气管黏膜细胞轻微脱落(图3 A-3);低浓度染毒后肺泡壁轻微充血,肺泡壁增厚,肺泡细支气管黏膜细胞轻微脱落,肺泡细支气管中有少量血液渗出液(图3 B-3);中浓度组肺组织充血较严重,肺泡壁增厚较严重并充血,肺泡细支气管黏膜细胞脱落较严重,肺泡细支气管中有一定血液渗出液(图3 C-3);高浓度组肺泡壁增厚,充血严重,且肺泡细支气管黏膜细胞脱落严重,肺泡细支气管中有大量血液渗出液,且细支气管旁炎症细胞浸润形成结节(图3 D-3)。这表明生理盐水急性染毒也会对肺部造成轻微伤害,但土壤盐碱扬尘染毒试剂急性染毒会对肺组织造成明显的炎症病变,会导致肺实质和膜性组织损伤,对肺存在急性毒性作用,且随着染毒试剂浓度的升高,对肺部病理组织伤害加重。
3 讨论(Discussion)
3.1 土壤盐碱扬尘染毒对大鼠血液生理指标的影响
实验鼠的血液生理指标会随着种群、性别、周龄、饲养环境等一系列环境因素的改变而改变。本实验中土壤盐碱扬尘对雄性大鼠血液生理指标的影响总体上较小,但也表现出急性感染趋势。这与舒加乐等[34]的研究结果相似,他认为大气颗粒物7 mg·mL-1染毒组与生理盐水对照组相比,C57小鼠组中WBC、HGB、PLT和Lymph#有差异性变化(P<0.05),其中PLT下降更显著(P< 0.01)。
3.2 土壤盐碱扬尘染毒对大鼠氧化炎症指标的影响
当机体T-AOC降低时,则易引起炎症、肿瘤、免疫系统疾病等。本实验研究发现土壤盐碱扬尘急性染毒可降低大鼠血浆(显著)和BALF中T-AOC活性,即导致抗氧化能力减弱。沙尘暴发生时细颗粒物毒性研究表明,由于沙尘暴的PM2.5可直接攻击细胞DNA,使组织细胞的抗氧化能力减弱,破坏体内抗氧化系统的平衡,并使抗氧化酶活性降低和细胞膜功能系统受损,最终导致机体免疫功能下降[35]。作为沙尘暴来源之一的土壤盐碱扬尘,其降低大鼠抗氧化能力的原因,可能始于对细胞DNA的损伤。
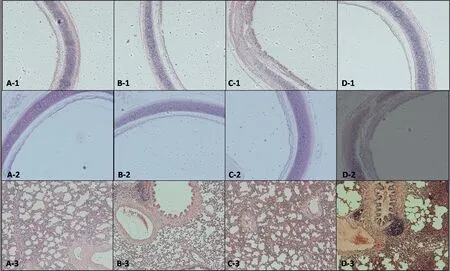
图3 不同浓度土壤盐碱扬尘染毒对雄性大鼠气管组织病理变化的影响注:10×10 倍HE染色,A-2、B-2、C-2、D-2为PAS染色;A,生理盐水对照组;B,低浓度组;C,中浓度组;D,高浓度组。Fig. 3 Influence of acute exposure to different concentrations of soil saline-alkali dust on pathological changes of trachea in male ratsNote: 10×10 HE stained, A-2, B-2, C-2 and D-2 were PAS stained; A, saline control group; B, low dose group; C, middle dose group; D, high dose group.
IL-6为前炎性细胞因子,可促进激活的巨噬细胞分化和浸润,影响粘附分子和相关细胞因子的分泌,导致炎性反应[36]。TNF-α为最早释放并发挥关键作用的细胞因子,会促进IL-6、MIP-2(巨噬细胞炎性蛋白-2)等因子释放,使中性粒细胞、巨噬细胞等炎症细胞聚集,导致炎症效应[37]。大气颗粒物能使大鼠血清和肺组织中IL-6呈现正向剂量效应[38-39]。翟文慧等[40]的研究表明,北京大气中随着PM2.5浓度升高,肺上皮细胞分泌IL-6和TNF-α水平显著升高。沙尘暴PM2.5急性染毒24 h后,低浓度组大鼠BALF中IL-6和TNF-α含量与生理盐水对照组差异不显著,但37.5 mg·kg-1高浓度组显著高于生理盐水对照组,显著造成大鼠呼吸系统损伤[41]。虽然本实验中染毒未显著提高雄性大鼠血浆IL-6含量,且高浓度染毒还使BALF中IL-6含量显著低于生理盐水对照组。但染毒会提高血浆和BALF中TNF-α含量,且高浓度染毒后BALF中TNF-α含量显著高于低浓度染毒,与以往研究所呈现的沙尘暴PM2.5、PM10浓度依赖性地增加肺泡巨噬细胞的TNF-α分泌[42]的结论相一致。
LDH是活细胞胞浆内含酶,为颗粒物细胞毒性的敏感指标[43]。陈晓燕[13]的研究表明,沙尘暴PM2.5急性染毒大鼠24 h后,中(15 mg·kg-1)、高(75 mg·kg-1)浓度组的血清和BALF中LDH含量均显著高于生理盐水对照组。金昱等[44]研究认为,沙尘暴PM对人肺成纤维细胞可产生明显的毒性作用,在150 μg·mL-1以上染毒浓度,沙尘暴颗粒物可引起细胞外LDH和酸性磷酸酶的漏出增加。耿红等[6]的研究表明,沙尘暴PM2.5水溶性成分可抑制质膜Ca2+-Mg2+-ATP 酶等酶活性,增加胞质 LDH 外渗,并使细胞脂质过氧化作用增强、抗氧化能力减弱。本实验结果也显示了高浓度染毒后BALF中LDH含量的显著升高。
抗炎细胞因子TGF-β1是致肺纤维化的关键性细胞因子,又可诱导大量炎性细胞趋化[45]。大气PM2.5暴露加重博来霉素致大鼠肺纤维化,使博来霉素组大鼠肺TGF-β1分泌显著增多[46];50 μg·mL-1和 100 μg·mL-1浓度的沙尘暴PM10可促使人支气管上皮细胞分泌TGF-β1显著增加[47]。本实验中土壤盐碱扬尘染毒均显著升高雄性大鼠血浆(所有浓度)和BALF(中、高浓度)的TGF-β1含量,表现出在血浆和BALF中对大鼠的伤害特性。
3.3 土壤盐碱扬尘染毒对大鼠肺组织和气管组织病理变化的影响
PM急性染毒可使妊娠小鼠肺组织中细支气管、肺间质、肺泡等发生炎症损伤,且存在染毒剂量-效应关系[48]。本实验中土壤盐碱扬尘的急性染毒使大鼠气管和肺组织产生炎症损伤,且随着染毒试剂浓度的升高而加剧,这与王广鹤和宋伟民[49]研究认为PM2.5连续暴露会使大鼠肺组织呈现不同程度的炎症损伤,并随暴露浓度的增加有加重趋势的研究结果相一致。
3.4 土壤盐碱扬尘染毒对大鼠损伤的机制探讨
扬尘粒径的大小可直接影响健康损害的程度。PM10可进入肺终末细支气管和肺泡区,PM2.5可直接进入肺泡,颗粒物粒径越小表面积就越大,其有害物质就更易与组织细胞结合而发挥其毒性作用。沙尘暴PM2.5的细胞毒性比相同浓度的PM10大,对肺泡巨噬细胞吞噬功能造成的损伤更严重[42];抑制人肺成纤维细胞的线粒体琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力及引起细胞外LDH和酸性磷酸酶(acid phosphatase,ACP)的漏出增加更强[44]。相同浓度的20 nm SiO2引发的小鼠毒性效应较 60 nm的显著[50]。本实验中使用的染毒试剂为盐碱湖表土样品中小于74 μm的部分,所含的毒性物质理论上不及纯盐碱浓度的PM10和PM2.5的多,其所反映的染毒效应理论上比可吸入颗粒物的低,故没有对血浆或BALF中IL-6、TNF-α和LDH等炎症指标造成显著影响。
另外,不同成分的污染物会导致炎性和抗性反应的差异性。如,钨矿和锡矿扬尘比瓷厂扬尘更强诱导巨噬细胞产生前炎性细胞因子(TNF-α和IL-6),标准石英扬尘比钨矿、锡矿扬尘诱导的TGF-β1水平更高[51]。苏州地区城市大气颗粒物染毒对大鼠BALF中LDH、TNF-α等水平无影响,却能降低碱性磷酸酶(AKP)水平[52]。沙尘暴天气和非沙尘暴天气PM2.5对人支气管上皮细胞分泌TNF-α、LDH等因子影响均较小,但能够促使IL-6分泌量显著增加,且Cr、Si浓度均与IL-6含量显著相关[29]。因此推测,扬尘组成成分的不同是导致本实验炎症指标中IL-6、TNF-α和LDH与生理盐水对照组差异不显著,而T-AOC和TGF-β1反应明显的重要原因之一。大气颗粒物的化学成分及其携带的细菌、病毒对动物和人造成伤害[53]。PM2.5浓度在沙尘暴发生期间大增,颗粒反应的表面积随之增加,在运移和传输过程中成为病毒、细菌等有害物质的载体,其碱性特征有利于二次反应,会引起机体呼吸道正常菌群的紊乱,使致病菌易侵入,影响机体健康[54-55]。沙尘暴时北京大气气溶胶的污染水平极高,其中来源于土壤的离子和元素浓度骤增[56]。北京沙尘暴期间PM10的SO42-、NO3-和NH4+浓度均高于非沙尘期间[57],本实验所用的染毒剂来自北京沙尘暴污染源区盐碱表土,其扬尘中的盐碱性细颗粒是北方地区沙尘暴的主要成分之一,其中含有大量的NO2-、NO3-、SO42-和NH4+离子,这些均是大气二次源气溶胶反应的主要成分。因此,与直接取自于沙尘暴污染源地表土相比而言,城市沙尘暴天气中PM的成分更为复杂,是造成本次研究结果与前人研究差异的原因之一。
通讯作者简介:刘艳菊(1969-),女,博士,研究员,研究方向为环境生物学。
参考文献(References):
[1] Wang Y, Zhang Y, Schauer J J, et al. Relative impact of emissions controls and meteorology on air pollution mitigation associated with the Asia-Pacific Economic Cooperation (APEC) conference in Beijing, China [J]. Science of the Total Environment, 2016, 571: 1467-1476
[2] Petäjä T, Järvi L, Kerminen V M, et al. Enhanced air pollution via aerosol-boundary layer feedback in China [J]. Scientific Reports, 2016, 6: 18998. DOI:10.1038/srep18998
[3] Lelieveld J, Crutzen P J, Ramanathan V, et al. The Indian Ocean Experiment: Widespread Air Pollution from South and Southeast Asia [M]//Paul J. Crutzen: A Pioneer on Atmospheric Chemistry and Climate Change in the Anthropocene. Springer International Publishing, 2016: 197-209
[4] Wang Y, Wang R, Ming J, et al. Effects of dust storm events on weekly clinic visits related to pulmonary tuberculosis disease in Minqin, China [J]. Atmospheric Environment, 2016, 127: 205-212
[5] Pui D, Cao Q, Lipinski W. Large-scale solar applications to mitigate PM2.5pollution and yellow dust storm in East Asia [C]. Optics for Solar Energy, Optical Society of America, 2015
[6] 耿红, 孟紫强, 张全喜. 沙尘暴PM2.5水溶和有机成分对巨噬细胞的损伤[J]. 中国环境科学, 2006, 26(1): 20-24
Geng H, Meng Z Q, Zhang Q X. Damage of water-soluble and organic compositions of dust storm PM2.5on macrophages [J]. China Environmental Science, 2006, 26(1): 20-24 (in Chinese)
[7] Kwaasi A A, Parhar R S, al-Mohanna F A, et al. Aeroallergens and viable microbes in sandstorm dust—Potential triggers of allergic and nonallergic respiratory ailments [J]. Allergy, 1998, 53(3): 255-265
[8] Chen Y S, Shen P C, Chen E R, et al. Effects of Asian dust storm events on daily mortality in Taipei, Taiwan [J]. Environmental Research, 2004, 95: 151-155
[9] Goudie A S. Desert dust and human health disorders [J]. Environment International, 2014, 63: 101-113
[10] Yang C Y, Chen Y S, Chiu H F, et al. Effects of Asian dust storm events on daily stroke admissions in Taipei, Taiwan [J]. Environmental Research, 2005, 99(1): 79-84
[11] 孟紫强, 杨振华, 潘竞界, 等. 沙尘天气多发区民勤县发现多例非职业性尘肺病[J]. 生态毒理学报, 2008, 3(4): 337-342
Meng Z Q, Yang Z H, Pan J J, et al. Cases of non-occupational pneumoconiosis from farmers in Minqin County, a desert area in Northwest China [J]. Asian Journal of Ecotoxicology, 2008, 3(4): 337-342 (in Chinese)
[12] Esmaeil N, Gharagozloo M, Rezaei A, et al. Dust events, pulmonary diseases and immune system [J]. American Journal of Clinical and Experimental Immunology, 2014, 3(1): 20
[13] 陈晓燕. 沙尘暴对人群健康的影响及其细颗粒物PM2.5的毒理学研究[D]. 兰州: 兰州大学出版社, 2007: 1-58
Chen X Y. Study on effects of the sand dust storm to population health and toxicology of PM2.5[D]. Lanzhou: Lanzhou University Press, 2007: 1-58 (in Chinese)
[14] 孟紫强, 张雷. 沙尘暴对暴露儿童健康效应的研究[J]. 生态毒理学报, 2007, 2(4): 390-395
Meng Z Q, Zhang L. Relationship between dust storms and acute impacts of children’s health [J]. Asian Journal of Ecotoxicology, 2007, 2(4): 390-395 (in Chinese)
[15] 孙兆彬, 安兴琴, 崔甍甍, 等. 北京地区颗粒物健康效应研究——沙尘天气、非沙尘天气下颗粒物 (PM2.5, PM10) 对心血管疾病入院人次的影响[J]. 中国环境科学, 2016, 36(8): 2536-2544
Sun Z B, An X Q, Cui M M, et al. The effect of PM2.5and PM10on cardiovascular and cerebrovascular diseases admission visitors in Beijing areas during dust weather, non-dust weather and haze pollution [J]. China Environmental Science, 2016, 36(8): 2536-2544 (in Chinese)
[16] 韩力慧, 庄国顺, 孙业乐, 等. 北京大气颗粒物污染本地源与外来源的区分——元素比值Mg/Al示踪法估算矿物气溶胶外来源的贡献[J]. 中国科学 B辑 化学, 2005, 35(3): 237-246
Han L H, Zhuang G S, Sun Y L, et al. Distinction between local and exotic sources of atmospheric particulate pollution in Beijing: Estimation of contribution of exotic sources of mineral aerosol using element ratio Mg/Al tracing method [J]. Science in China Ser. B Chemistry, 2005, 35(3): 237-246 (in Chinese)
[17] Notaro M, Alkolibi F, Fadda E, et al. Trajectory analysis of Saudi Arabian dust storms [J]. Journal of Geophysical Research: Atmospheres, 2013, 118(12): 6028-6043
[18] Liu Q, Liu Y, Yin J, et al. Chemical characteristics and source apportionment of PM10during Asian dust storm and non-dust storm days in Beijing [J]. Atmospheric Environment, 2014, 91: 85-94
[19] Wang R, Zou X, Cheng H, et al. Spatial distribution and source apportionment of atmospheric dust fall at Beijing during spring of 2008-2009 [J]. Environmental Science and Pollution Research, 2015, 22(5): 3547-3557
[20] Watanabe M, Kurai J, Sano H, et al. Difference in pro-inflammatory cytokine responses induced in THP1 cells by particulate matter collected on days with and without Asian dust storms [J]. International Journal of Environmental Research and Public Health, 2015, 12(7): 7725-7737
[21] Naimabadi A, Ghadiri A, Idani E, et al. Chemical composition of PM10and itsinvitrotoxicological impacts on lung cells during the Middle Eastern Dust (MED) storms in Ahvaz, Iran [J]. Environmental Pollution, 2016, 211: 316-324
[22] He M, Ichinose T, Song Y, et al. Desert dust induces TLR signaling to trigger Th2-dominant lung allergic inflammation via a MyD88-dependent signaling pathway [J]. Toxicology and Applied Pharmacology, 2016, 296: 61-72
[23] Liu Q, Baumgartner J, Zhang Y, et al. Oxidative potential and inflammatory impacts of source apportioned ambient air pollution in Beijing [J]. Environmental Science and Technology, 2014, 48(21): 12920-12929
[24] Kumar R, Barth M C, Pfister G G, et al. WRF-Chem simulations of a typical pre-monsoon dust storm in northern India: Influences on aerosol optical properties and radiation budget [J]. Atmospheric Chemistry and Physics, 2014, 14(5): 2431-2446
[25] Cao H, Liu J, Wang G, et al. Identification of sand and dust storm source areas in Iran [J]. Journal of Arid Land, 2015, 7(5): 567-578
[26] Alghamdi M A, Almazroui M, Shamy M, et al. Characterization and elemental composition of atmospheric aerosol loads during springtime dust storm in western Saudi Arabia [J]. Aerosol and Air Quality Research, 2015, 15: 440-453
[27] 孟紫强, 张全喜. 沙尘暴PM2.5对大鼠肺、心、肝组织的氧化损伤效应[J]. 卫生研究, 2006, 35(6): 690-693
Meng Z Q, Zhang Q X. Effects of dust storm fine particles instillation on oxidative damage in hearts, livers, lungs of rats [J]. Journal of Hygiene Research, 2006, 35(6): 690-693 (in Chinese)
[28] 徐大琴, 牛静萍, 万学中, 等. 沙尘暴细颗粒物致大鼠肺细胞DNA损伤研究[J]. 环境与健康杂志, 2008, 25(1): 67-68
Xu D Q, Niu J P, Wan X Z, et al. Study on DNA damage in lung cells of rats exposed to sand storm particles [J]. Journal of Environment and Health, 2008, 25(1): 67-68 (in Chinese)
[29] Wang B, Li N, Deng F, et al. Human bronchial epithelial cell injuries induced by fine particulate matter from sandstorm and non-sandstorm periods: Association with particle constituents [J]. Journal of Environmental Sciences, 2016, 47: 201-210
[30] 谢在永. 沙尘暴天气危害健康[J]. 绿化与生活, 2002, 1: 30
Xie Z Y. Harmful to health in sand storm weather [J]. Greening and Living, 2002, 1: 30 (in Chinese)
[31] 韩同林. 京津地区沙尘暴与盐碱尘暴浅析[J]. 科学(上海), 2008, 60(1): 46-49
Han T L. Cause and ecological control of salt dust storm in Beijing and Tianjin [J]. Science (Shanghai), 2008, 60(1): 46-49 (in Chinese)
[32] 林本成, 袭著革, 张英鸽, 等. 微纳尺度SiO2对雄性大鼠生殖功能及子代的影响[J]. 解放军预防医学杂志, 2008, 26(3): 172-175
Lin B C, Xi Z G, Zhang Y G, et al. Effect of micro-nano-scale SiO2on male reproductive ability and offsprings in rats [J]. Journal of Preventive Medicine of Chinese People's Liberation Army, 2008, 26(3): 172-175 (in Chinese)
[33] 刘艳菊, 韩同林, 刘清珺, 等. 北京尘暴与环境[M]. 北京: 科学出版社, 2017: 169, 176
Liu Y J, Han T L, Liu Q J, et al. Beijing Dust Storm and the Environment [M]. Beijing: Science Publishing, 2017: 169, 176 (in Chinese)
[34] 舒加乐, 邹亚娟, 孙新明, 等. 大气细颗粒物致C57小鼠急性肺损伤的试验[J]. 实验室研究与探索, 2015, 34(3): 58-62
Shu J L, Zou Y J, Sun X M, et al. Acute pulmonary injury induced by atmospheric particulate matter in mice [J]. Research and Exploration in Laboratory, 2015, 34(3): 58-62 (in Chinese)
[35] 徐大琴. 沙尘暴PM2.5的毒理学效应及对人群的健康效应研究[D]. 兰州: 兰州大学出版社, 2008: 1-59
Xu D Q. Study on toxicological effects of fine particles in sand dust storm and human health effects [D]. Lanzhou: Lanzhou University Press, 2008: 1-59 (in Chinese)
[36] Choussat R, Montalescot G, Collet J, et al. Effect of prior exposure toChlamydiapneumoniae,Helicobacterpylori, or cytomegalovirus on the degree of inflammation and one-year prognosis of patients with unstable angina pectoris or non-Q-wave acute myocardial infarction [J]. The American Journal of Cardiology, 2000, 86(4): 379-384
[37] Sharma A K, Fernandez L G, Awad A S, et al. Proinflammatory response of alveolar epithelial cells is enhanced by alveolar macrophage-produced TNF-α during pulmonary ischemia-reperfusion injury [J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2007, 293(1): L105-L113
[38] 邵国军. 大气颗粒物PM2.5对大鼠呼吸系统免疫损伤机制研究[D]. 兰州: 兰州大学出版社, 2006: 1-30
Shao G J. Study on immunologic injury of respiratory system of rats induced by PM2.5[D]. Lanzhou: Lanzhou University Press, 2006: 1-30 (in Chinese)
[39] 姜瑞雪, 万运方, 刘雁云, 等. PM2.5对Wistar大鼠肺组织中HMGB1、TNF-α、IL-6表达的影响[J]. 环境卫生学杂志, 2014(6): 514-517
Jiang R X, Wan Y F, Liu Y Y, et al. Effects of PM2.5on HMGB1, TNF-α and IL-6 expression in Wistar rats lung [J]. Journal of Environmental Hygiene, 2014(6): 514-517 (in Chinese)
[40] 翟文慧, 黄志刚, 冯聪, 等. 大气细颗粒污染物PM2.5浓度及对肺上皮细胞炎性因子的影响[J]. 现代生物医学进展, 2015, 15(6): 1028-1031
Zhai W H, Huang Z G, Feng C, et al. Atmospheric fine particulate pollutants concentrations of PM2.5and its effects on inflammatory factors in pulmonary epithelial cells [J]. Progress in Modern Biomedicine, 2015, 15(6): 1028-1031 (in Chinese)
[41] 晓开提·依不拉音, 地丽拜尔·斯拉木, 范妙丽. 沙尘暴PM2.5对大鼠呼吸系统免疫损伤机制研究[J]. 新疆医科大学学报, 2011, 34(10): 1097-1099
Xiaokaiti Y B L Y, Dilibaier S L M, Fan M L. Immunologic injury of respiratory system of rats induced by dust storm PM2.5[J]. Journal of Xinjiang Medical University, 2011, 34(10): 1097-1099 (in Chinese)
[42] 黄雪莲, 金昱, 郭新彪, 等. 沙尘暴 PM2.5, PM10对大鼠肺泡巨噬细胞炎性因子分泌的影响[J]. 环境与健康杂志, 2004, 21(1): 38-40
Huang X L, Jin Y, Guo X B, et al. Study on the effects of PM2.5and PM10in sand storm dust on secretion of inflammatory factors in alveolar macrophages of rat [J]. Journal of Environment and Health, 2004, 21(1): 38-40 (in Chinese)
[43] Hill J O, Gray R H, DeNee P B, et al. Comparative damage to alveolar macrophages after phagocytosis of respirable particles [J]. Environmental Research, 1982, 27(1): 95-109
[44] 金昱, 郭新彪, 黄雪莲, 等. 沙尘暴颗粒物对人肺成纤维细胞的细胞毒性研究[J]. 环境与健康杂志, 2004, 21(4): 199-201
Jin Y, Guo X B, Huang X L, et al. Study on the cytotoxicity of dust storm PM10and PM2.5on human lung fibroblasts [J]. Journal of Environment and Health, 2004, 21(4): 199-201 (in Chinese)
[45] 于露, 刘跃建. 肿瘤坏死因子-α及转化生长因子-β1在肺纤维化形成中的作用研究进展[J]. 实用医院临床杂志, 2012, 9(3): 163-165
Yu L, Liu Y J. TNF alpha and TGF-β1 and the research progress of pulmonary fibrosis [J]. Practical Journal of Clinical Meicine, 2012, 9(3): 163-165 (in Chinese)
[46] 段争, 吴翠红. 细颗粒物PM2.5暴露加重博来霉素致大鼠肺纤维化[J]. 基础医学与临床, 2015, 35(6): 781-785
Duan Z, Wu C H. Exposure to PM2.5enhances Bleomycin-induced pulmonary fibrosis in rats [J]. Basic and Clinical Medicine, 2015, 35(6): 781-785 (in Chinese)
[47] Kyung S Y, Yoon J Y, Kim Y J, et al. Asian dust particles induce TGF-β1 via reactive oxygen species in bronchial epithelial cells [J]. Tuberculosis and Respiratory Diseases, 2012, 73(73): 84-92
[48] 洪新如, 王育梅, 刘超斌, 等. 大气颗粒物暴露对小鼠妊娠和胚胎发育的影响[J]. 中华妇产科杂志, 2011, 46(1): 45-51
Hong X R, Wang Y M, Liu C B, et al. Effect of airborne particulate matter exposure on pregnancy and fetal development in female mice [J]. Chinese Journal of Obstetrics and Gynecology, 2011, 46(1): 45-51 (in Chinese)
[49] 王广鹤, 宋伟民. 大气细颗粒物(PM2.5)对大鼠心肺系统的毒性研究[C]. 厦门: 中国环境科学学会PM2.5监测及防治技术高级研讨会, 2012: 267-275
Wang G H, Song W M. Toxicity study of fine paticular matter PM2.5on rat heart-lung system [C]. Xiamen: Advanced Symposium on PM2.5Monitor and Control Techniques of Chinese Society for Environmental Sciences, 2012: 267-275 (in Chinese)
[50] 吴秋云, 唐萌, 谢彦昕, 等. 不同粒径纳米二氧化硅的体外细胞膜毒性作用[J]. 中国生物医学工程学报, 2010, 29(3): 437-445
Wu Q Y, Tang M, Xie Y X, et al. Cell membrane injury induced by different sizes of SiO2nanoparticles invitro[J]. Chinese Journal of Biomedical Engineering, 2010, 29(3): 437-445 (in Chinese)
[51] 陈建文, 周婷, 荣怿, 等. 金属矿山和陶瓷厂生产性粉尘的致炎性反应[J]. 华中科技大学学报: 医学版, 2012, 41(3): 258-263
Chen J W, Zhou T, Rong Y, et al. Inflammatory responses induced by silica dust from metal mines and pottery factory [J]. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2012, 41(3): 258-263 (in Chinese)
[52] 杨果. 大气细颗粒物对大鼠呼吸系统急性损伤及生物标志物研究[D]. 苏州: 苏州大学出版社, 2014: 1-37
Yang G. Study on acute injury and biomarker of respiratory system in rats induced by airborne PM2.5[D]. Suzhou: Suzhou University Press, 2014: 1-37 (in Chinese)
[53] Liu B, Ichinose T, He M, et al. Lung inflammation by fungus,Bjerkanderaadustaisolated from Asian sand dust (ASD) aerosol and enhancement of ovalbumin-induced lung eosinophilia by ASD and the fungus in mice [J]. Allergy, Asthma and Clinical Immunology, 2014, 10(1): 10
[54] 牛佳钰, 肖纯凌, 陈冬梅, 等. PM2.5对高血压(SHR/NCrl)大鼠呼吸道菌群的影响[J]. 卫生研究, 2016, 45(4): 648-652
Niu J Y, Xiao C L, Chen D M, et al. Effect of PM2.5on respiratory tract flora in SHR/NCrl rats [J]. Journal of Hygiene Research, 2016, 45(4): 648-652 (in Chinese)
[55] 刘庆阳, 刘艳菊, 赵强, 等. 2012年春季京津冀地区一次沙尘暴天气过程中颗粒物的污染特征分析[J]. 环境科学, 2014(8): 2843-2850
Liu Q Y, Liu Y J, Zhao Q, et al. Chemical characteristics in airborne particulate matter (PM10) during a high pollution spring dust storm episode in Beijing, Tianjin and Zhangjiakou, China [J]. Environmental Science, 2014(8): 2843-2850 (in Chinese)
[56] 王玮, 岳欣, 刘红杰, 等. 北京市春季沙尘暴天气大气气溶胶污染特征研究[J]. 环境科学学报, 2002, 22(4): 494-498
Wang W, Yue X, Liu H J, et al. Study on pollution characteristics of aerosols during sand-dust storm weather in Beijing [J]. Acta Scientiae Circumstantiae, 2002, 22(4): 494-498 (in Chinese)
[57] 刘庆阳, 刘艳菊, 杨峥, 等. 北京城郊冬季一次大气重污染过程颗粒物的污染特征[J]. 环境科学学报, 2014, 34(1): 12-18
Liu Q Y, Liu Y J, Yang Z, et al. Daily variations of chemical properties in airborne particulate matter during a high pollution winter episode in Beijing [J]. Acta Scientiae Circumstantiae, 2014, 34(1): 12-18 (in Chinese)

