大气中细颗粒物对肺癌细胞A549迁移和侵袭作用的影响
樊磊,刘顺,包艳英,张英杰,刘颖,屈超,张治然,袭荣刚,王晓波,*
1. 中国人民解放军第210医院药学部,大连 116021 2. 大连市环境监测中心,大连 116023
自1985年以来,肺癌已成为全世界发病率和死亡率最高的恶性肿瘤。据《中国肿瘤登记年报》2015年中国癌症统计[1]数据显示,肺癌也是中国发病率和死亡率最高的恶性肿瘤,在过去的30年中,肺癌死亡率在中国上升了465%。国内外环境流行病学研究表明,大气污染程度与城市居民肺癌的发病率和死亡率关联密切[2]。据Anenberg等[3]统计分析,目前全球每年约有14~30万例肺癌患者的死亡与大气中细颗粒物暴露有关。Pope等[4]调查发现,大气中细颗粒物浓度每升高10 μg·mL-1,肺癌病死率增加约8%。虽然流行病学调查显示肺癌发病率和病死率与大气中细颗粒物具有统计学相关性,但其因果联系尚待进一步的毒理学、生物学等机制研究予以阐明。以PM2.5为代表的大气细颗粒物是目前研究的热点,其粒径小,表面积大,易富集各种重金属及多环芳烃等有机物和病原微生物。这些颗粒物可沉积在细小支气管和肺泡[5],并容易通过肺泡内皮细胞进入血液循环。实验研究发现,PM2.5可通过诱导氧化应激反应产生心血管毒性[6]、加速皮肤细胞衰老、导致胚胎畸形[7]。PM2.5的致癌作用主要与其可导致遗传毒性、激活氧化应激通路、免疫损伤以及慢性炎症反应等作用有关[8-10]。
由于肺癌发病隐匿,早期往往没有任何症状。所以,在临床中发现的肺癌患者确诊时约有80%以上已发展到中晚期,患者五年生存率不足10%[11]。肺癌转移是影响患者生存期限的主要因素,PM2.5是否能促进肺癌细胞转移目前尚不清楚,因此,在本实验中我们观察了PM2.5对A549肺癌细胞转移相关表型的影响,旨在进一步阐明PM2.5对肺癌发生发展的作用及其机制,为对其医学防治提供理论依据。
1 材料与方法(Materials and methods)
1.1 主要试剂与仪器
人肺癌细胞系A549购于中国科学院上海生命科学研究院细胞资源中心。Gibco杜尔伯科改良伊格尔培养基(DMEM)和Gibco胎牛血清均购自美国Invitrogen公司,抗体MMP-2、抗体MMP-9、抗体E-cadherin、抗体N-cadherin和抗体GAPDH-A均购自美国Cell Signaling公司,人工基底膜Matrigel购自美国BD Biosciences公司,TGL-20M高速台式冰冻离心机购自中国湘仪公司,PAC300 型电泳仪购自美国BIO-RAD公司,TS 2000A 型脱色摇床购自江苏海门市分析仪器厂,Amersham Imager 600化学发光成像系统购自美国GE公司,BPN-150CRH型CO2细胞恒温培养箱购自苏州贝茵医疗器械有限公司,PQ200 环境级精细颗粒物采样器购自美国BGI公司。
1.2 大气PM2.5样品采集
采集工作由大连市环境监测中心完成,采样点位于大连市主城区,采样装置流量设定为1.13 m3·min-1。本实验中使用的PM2.5颗粒为11月采集获得,采样时间为24 h连续采样,在空气重污染期间加密采样,采样滤膜密封盒-20 ℃保存。
1.3 PM2.5 染毒悬液制备
制备方法参考文献[12]进行,具体方法如下:将采样滤膜按1 cm×1 cm剪裁,放入0 ℃预冷去离子水中超声振荡3次,每次20 min,收集洗脱液后用多层脱脂纱布过滤,再用 5 μm 微孔滤膜过滤,滤液4 ℃、 12 000 r·min-1离心 30 min,收集下层悬液冷冻过夜,真空冷冻干燥成干粉,称量PM2.5干粉后用环氧乙烷灭菌,再加入无菌生理盐水配制成 1 000 mg· mL-1的母液, -80 ℃避光保存备用。 染毒前超声振荡使颗粒物充分混匀,用细胞培养液稀释成所需工作液。
1.4 MTT 比色法检测PM2.5对A549细胞活性的影响
将细胞消化、重悬并吹打成单个细胞后计数,将细胞密度调整成1×104个·mL-1,按每孔200 μL细胞悬液接种到96孔板中,继续培养24 h后给药。实验分组为:空白对照组,溶剂对照组,不同浓度给药组,每组设置6个复孔。给药24 h后,每孔加入20 μL噻唑蓝溶液(MTT)后继续培养4 h,吸尽各孔培养液,每孔加入200 μL的二甲基亚砜(DMSO),振荡10 min,使结晶物充分溶解。用酶联免疫检测仪在570 nm波长处测定每孔的吸光度值(OD值),计算各组吸光度的平均值,按照下列公式计算细胞生存率:生存率%=(OD给药组-OD空白组)/(OD对照组-OD空白组)×100%。
1.5 PM2.5对A549细胞在细胞外基质上黏附的测定
用10 mg·L-1纤连蛋白(Fibronectin),50 mg·L-1人工基底膜(Matrigel) 1:8稀释液和10 g·L-1牛血清蛋白(BSA)作为基底膜包被96 孔板,BSA为对照基底,4 ℃过夜。加入含1% BSA的DMEM无血清培养液 (50 μL·孔-1) 37 ℃孵育30 min水化基底膜。胰酶消化PM2.5处理24 h的A549细胞,计数并以1×105个·孔-1接种于96孔板中,每组设置6个复孔。37 ℃培养1 h后,移去细胞悬浮液,用磷酸缓冲盐溶液(PBS)轻洗3次,除去未贴壁细胞。按照MTT比色法测定各孔细胞在490 nm波长处光吸收值(OD值),以BSA对照基底膜OD值为参考,按公式分别计算细胞在Matrigel和Fibronectin上的黏附率:黏附率(%)=[(各组细胞OD值/BSA组细胞OD值)-1]×100% 。
1.6 Western blot 法测定PM2.5对A549细胞转移相关蛋白表达的影响
接种A549细胞于6 孔板中,每孔 2×105个细胞,培养24 h后给予PM2.5,继续孵育24 h。提取细胞内总蛋白,采用 BCA法测定蛋白浓度。向细胞裂解液中加入适当体积的5×蛋白上样缓冲液,混匀后置于沸水中5 min。根据蛋白浓度,按照 20 μg/样品的总蛋白量计算电泳上样量。选用6%的浓缩胶和12%的分离胶进行蛋白电泳,电泳结束后将蛋白转移至聚偏二氟乙烯膜(PVDF)上。依据蛋白分子量的指示,按照目标蛋白的分子量剪裁PVDF膜后放入用PBST配制的5%脱脂奶粉溶液中,室温封闭 2 h。加入一抗稀释液4 ℃孵育过夜,加入相应二抗稀释液室温孵育2 h。采用化学法发光,使用Amersham Imager 600凝胶成像系统显影。用Image J软件分析发光得到蛋白条带,记录灰度值用于统计分析。
1.7 细胞划痕愈合实验
用记号笔在6孔板背后画3条间隔均匀的直线作为定位线。将A549细胞按照每孔5×105个接种于6孔板中,继续培养至细胞均匀铺满培养孔底部后用100 μL的移液枪头在细胞上划痕,垂直于定位线。将划痕与定位线的交点作为监测点。用PBS洗净漂浮细胞后加入含1%胎牛血清的培养基,在倒置显微镜下拍照记录监测点的划痕宽度,作为0 h时间点记录。给予相应浓度的PM2.5,将细胞继续培养24 h后拍照记录监测点的划痕宽度。用Image J软件计算划痕宽度,按照公式计算划痕愈合率:划痕愈合率%=[1-( 24 h划痕宽度/ 0 h划痕宽度)]×100%。每组设置3个复孔,实验重复3次。
1.8 细胞侵袭实验
实验方法具体如下[13]:将人工基底膜Matrigel按照1:8的比例与预冷DMEM混匀后按照每孔50 μL加入Transwell小室,使其均匀铺满小室底膜。将Transwell小室置于24孔板中,放入4 ℃冰箱过夜。于接种细胞前2 h将培养板从冰箱中取出,放入37 ℃培养箱中孵育。将A549细胞按照每孔5×104接种于Transwell小室中。小室下部的细胞培养液中加入含10 ng·mL-1的EGF,含10%胎牛血清的细胞培养液1 mL。细胞接种6 h后给予相应浓度的PM2.5,设置一个对照组,每组3个复孔,设置一组不加细胞的小室为空白对照孔。给PM2.5后继续培养细胞24 h,取出Transwell小室,用4%多聚甲醛溶液固定15 min,待风干后置于0.1%的结晶紫乙醇溶液中染色15 min。染色后用PBS漂洗Transwell小室,并用棉签将小室底膜上部未穿膜细胞擦去,小室下部即为侵袭细胞。在显微镜下观察后拍照,再将小室底膜浸入300 μL、33%的乙酸溶液中,使细胞中的结晶紫全部溶解于乙酸中。将溶解了结晶紫的乙酸溶液移入96孔板中,用酶标仪检测乙酸溶液在570 nm波长下的吸光值(OD),将空白对照孔的吸光值作为背景在计算各组OD值时减去。
1.9 明胶酶谱法检测细胞培养液基质金属蛋白酶MMP-2、MMP-9活性
给予A549细胞PM2.5后在无血清培养基DMEM中培养24 h,收集培养液上清,将上清液移入离心管中 2 000 r·min-1离心10 min, 测定上清蛋白浓度后与5×上样缓冲液混合,配制含1%明胶的分离胶和不含明胶的浓缩胶,根据蛋白浓度确定上样量,低温电泳100 V 1.5 h;电泳结束后将凝胶置于洗脱液(2.5% Triton X-100,50 mmol·L-1Tris -HCl,5 mmol·L-1CaCl2,pH=7.6)中振荡洗脱后用漂洗液(除不含Triton X-100外其余同洗脱液) 漂洗,接着将凝胶置于孵育液(50 mmol·L-1Tris - HCl, 10 mmol·L-1CaCl2, 0.02% Brij-35, pH7.6) 中37 ℃孵育42 h;孵育结束后经染色液(0.05% 考马斯亮蓝、30%甲醇、10%乙酸) 染色3 h,以及脱色液A、B、C(甲醇浓度分别为30%、20%、10%,乙酸浓度分别为10%、10%、5%) 分别脱色0.5、1、2 h后,显示出MMP-2(72 KD) 和MMP -9(92 KD)为位于蓝色背景上的透亮带,用凝胶图像分析系统分析读取条带面积、宽度和灰度值,进行统计学分析。
1.10 统计学方法
2 结果(Results)
2.1 不同浓度 PM2.5对A549细胞存活率的影响
给予A549细胞不同浓度的PM2.5作用24 h后,MTT法测定细胞存活率可以得出,细胞的存活率随PM2.5浓度的增加而减少(见图1),当PM2.5浓度大于等于12 μg· mL-1时,细胞存活率与正常对照组相比具有统计学差异(P<0.01),利用软件计算PM2.5对A549细胞的IC50为11 μg·mL-1。
2.2 PM2.5对A549细胞在细胞外基质上黏附性的影响
PM2.5预处理细胞后,A549细胞与Matrigel和Fibronectin这2种基质的黏附能力较正常对照组均有所增强(P<0.01),结果如表1所示。
2.3 PM2.5对A549细胞运动迁移作用的影响
细胞划痕愈合实验是检测细胞运动迁移能力的实验之一。在肿瘤转移过程中,细胞异常增强的迁移能力是肿瘤细胞穿越组织屏障的细胞生物基础[14]。由于高浓度的PM2.5可明显降低细胞存活率,因此为了排除PM2.5的细胞毒作用对实验结果的影响,我们根据之前实验测得的IC50值,选用10 μg·mL-1和 20 μg·mL-1为给药浓度,并在以下实验中,均用该浓度给药。为了避免细胞增殖对结果的影响,本实验选择含低浓度(1%)血清的细胞培养基,并且选择的时间点在细胞增殖周期以内(24 h)。用不同浓度的PM2.5处理细胞,结果发现PM2.5可刺激A549细胞的迁移速率。如图2所示,不同浓度的PM2.5明显增加了细胞划痕的愈合率,与对照组相比有显著差异(P<0.01)。
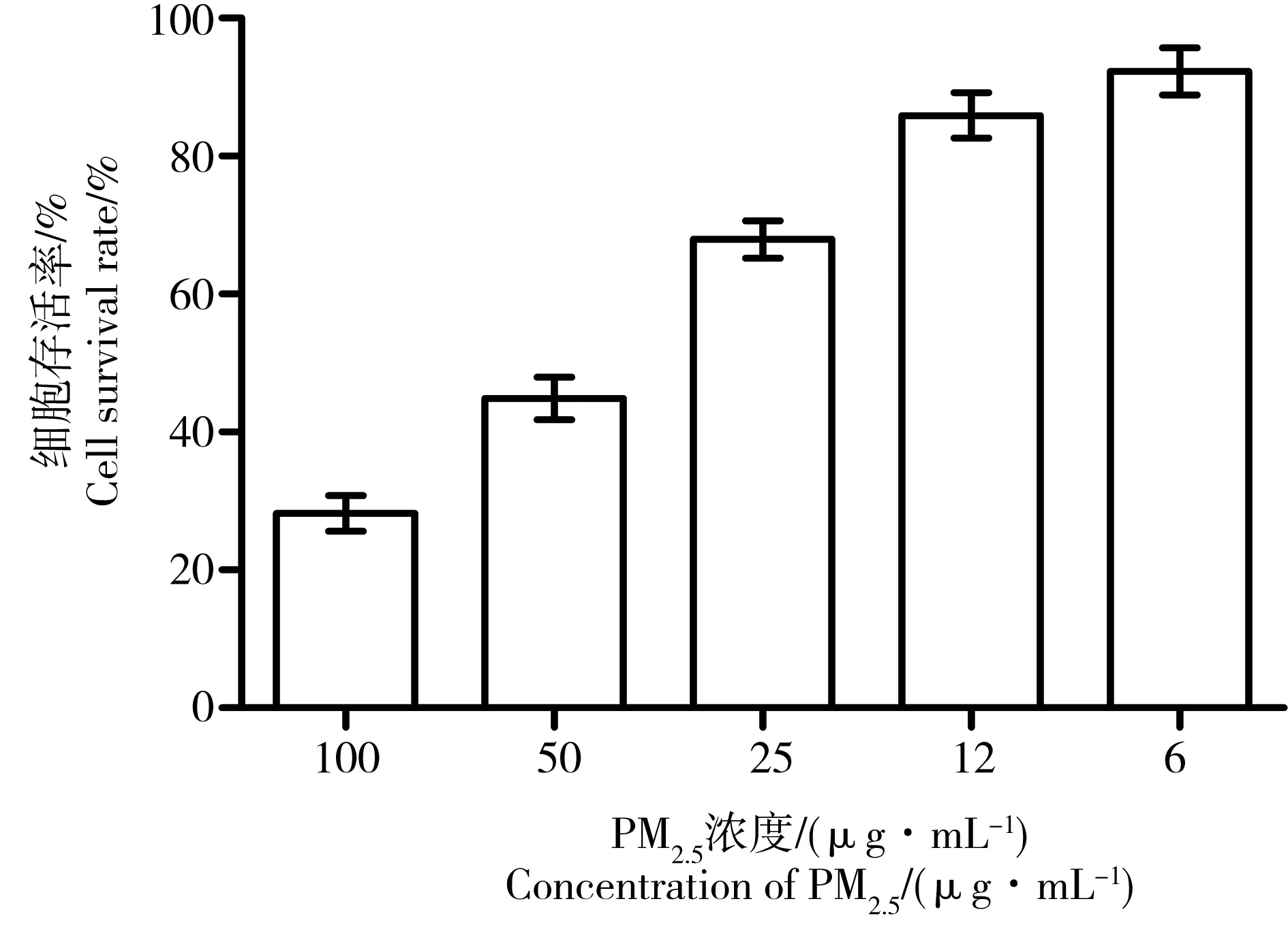
图1 PM2.5对A549细胞存活率的影响Fig. 1 Effects of PM2.5 on the survival rate of A549 cells

组别Group与Matrigel的粘附率/%Adhesion rates with Matrigel/%与Fibronectin的粘附率/%Adhesion rates with Fibronectin/%正常对照组Control group24.6±3.323.1±2.5溶剂对照组Vehicle control group23.2±2.624.5±3.4低浓度PM2.5暴露组Low concentration PM2.5 exposure group37.1±3.5*35.2±2.2*高浓度PM2.5暴露组High concentration PM2.5 exposure group59.3±3.1*56.1±3.3*
注:*P<0.05与正常对照组对比。
Note:*P<0.05 compared with control group.

图2 PM2.5对A549细胞运动迁移的影响注:A. 利用划痕实验观察不同浓度的PM2.5处理A549细胞24 h后,划痕的愈合情况照片;B. 测量划痕宽度,按照公式计算划痕愈合率:划痕愈合率%=[1-( 24 h划痕宽度/ 0 h划痕宽度)]×100%。Fig. 2 Effects of PM2.5 on cell migration of A549 cellsNote:(A) Migration of cancer cell line A549 was assessed by wound-healing assay. A scratch wound was created on the cell surface and then PM2.5 were added. The cultures were photographed at 0 h and 24 h. (B) The cell wound closure rate was measured at 24 h and was calculated according to the equation: Wound closure% = [1 -(wound area at Tt / wound area at T0)] × 100%.
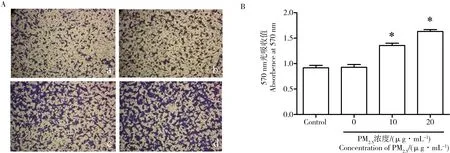
图3 PM2.5对A549细胞侵袭能力的影响注:A. 用不同浓度的PM2.5处理A549细胞24 h后,进入小室下膜的细胞结晶紫染色照片(100×);a. 正常对照组,b. 溶剂对照组,c. 低浓度PM2.5暴露组,d. 高浓度PM2.5暴露组。B. 乙酸溶解小室下膜细胞中结晶紫后在570 nm波长下的吸光值。*P<0.05与正常对照组对比。Fig. 3 Effect of PM2.5 on invasion of A549 cellsNote: A. Cells were treated with various concentrations of PM2.5 for 24 h, and cell invasion assay was performed. The invaded cells were photographed (100× magnification), a. control group, b. vehicle control group, c. low concentration PM2.5 exposure group, d. high concentration PM2.5 exposure group. *P<0.05 compared with control group.
2.4 PM2.5对A549细胞侵袭能力的影响
在肿瘤细胞体外侵袭实验中,肿瘤细胞被小室下部的营养物质所驱动,通过分泌基质酶降解铺在小室内膜表面的基质胶,从膜微孔中穿透后抵达小室下方。抵达小室下方的细胞数量反映了肿瘤细胞的侵袭能力。实验结果表明PM2.5可增加A549细胞进入小室下膜的细胞数量,提示其侵袭能力在PM2.5的作用下得到增强。如图3所示。
2.5 PM2.5对A549细胞基质金属蛋白酶活性的影响
上述研究表明,PM2.5对A549细胞侵袭能力具有明显的促进效应,而基质金属蛋白酶(matrix metalloproteinases, MMPs)是影响细胞侵袭能力的重要酶类,具有侵袭能力的肿瘤细胞均可分泌MMPs。为研究PM2.5对A549细胞侵袭能力的影响是否与MMPs的活性有关,我们利用明胶酶谱试验检测了MMPs的2个亚型MMP-2和MMP-9的活性。肿瘤细胞中MMP-2和MMP-9的活性与其侵袭能力密切相关,明胶是这2种酶的作用底物,通过酶谱法检测样本中MMP-2和MMP-9对明胶的分解效应,可判断其酶活性。结果发现给予A549细胞PM2.5处理24 h后,2个浓度组中细胞分泌的MMP-2和MMP-9活性均明显增加,结果如图3所示。
2.6 PM2.5对A549细胞转移相关蛋白表达的影响
通过Westem blot实验检测A549细胞转移相关蛋白表达的变化。其中与细胞侵袭相关的蛋白MMP-2、MMP-9表达明显增加,而细胞黏附蛋白E-cadherin表达量下降,N-cadherin的表达量升高,如图4所示。
3 讨论(Discussion)
国内外流行病学研究显示PM2.5暴露水平与肺癌的发病率及病死率呈正相关[15-17],PM2.5导致肺癌发生和发展的病理生理机制也得到了实验性研究结论的初步阐明。PM2.5的化学组分中,重金属、多环芳香烃等成分已被证实与肺癌的发生有确切的因果关系,这些物质可通过损伤免疫系统、氧化应激、抑制DNA修复和增加DNA突变率等多种途径诱发肺癌。肿瘤转移是影响肺癌患者预后的重要因素,关于PM2.5促进肺癌转移的研究报道较少,吴鸿章等[12]研究发现,PM2.5暴露能通过上调血管内皮生长因子(VEGF)、MMP-9与低氧诱导因子-1α (HIF-1α)基因的表达,促进肺癌移植瘤新生血管形成。肿瘤转移是多因素、多步骤的生物学过程,细胞的迁移、黏附和侵袭是肿瘤细胞转移中的关键步骤,我们通过细胞-基质黏附实验、细胞划痕愈合实验和细胞侵袭实验研究了大气来源的PM2.5对这3个关键步骤的影响。由于较高浓度的PM2.5可以明显抑制肿瘤细胞的活性,因此我们根据MTT比色实验获得的IC50选用较低的给药浓度以排除PM2.5对细胞增殖和凋亡的影响。细胞划痕实验是一种体外检测细胞迁移运动能力的实验,肿瘤细胞的运动能力与其转移能力密切相关[18],我们发现PM2.5可明显增加A549细胞划痕的愈合速率,说明细胞的迁移能力受到了影响,肿瘤的转移潜力可能增强。高侵袭的肿瘤细胞与基底膜成分的异质性黏附能力通常增高,而肿瘤细胞间的同质性黏附能力则会下降。这有利于肿瘤细胞与肿瘤母体分离,并侵犯基底膜等正常组织。本实验发现,PM2.5能增加A549细胞与细胞外基质Matrigel和Fibronectin的黏附率,细胞间黏附蛋白E-cadherin表达下降,而细胞-基质黏附蛋白N-cadherin表达升高初步揭示了PM2.5影响A549细胞-基质黏附作用的机制。E-cadherin表达下降,N-cadherin表达升高也是肿瘤细胞从上皮细胞向间充质细胞转化(epithelial-mesenchymal transition, EMT)的重要表型,肿瘤细胞可通过EMT获得迁移和侵袭能力[19]。研究发现,香烟提取物可通过激活Rac1/Smad2和Rac1/PI3K/Akt信号通路促进EMT的发生,进而导致肺上皮细胞出现转移潜能增强[20],本实验表明:大气来源的PM2.5同样具备该效应。
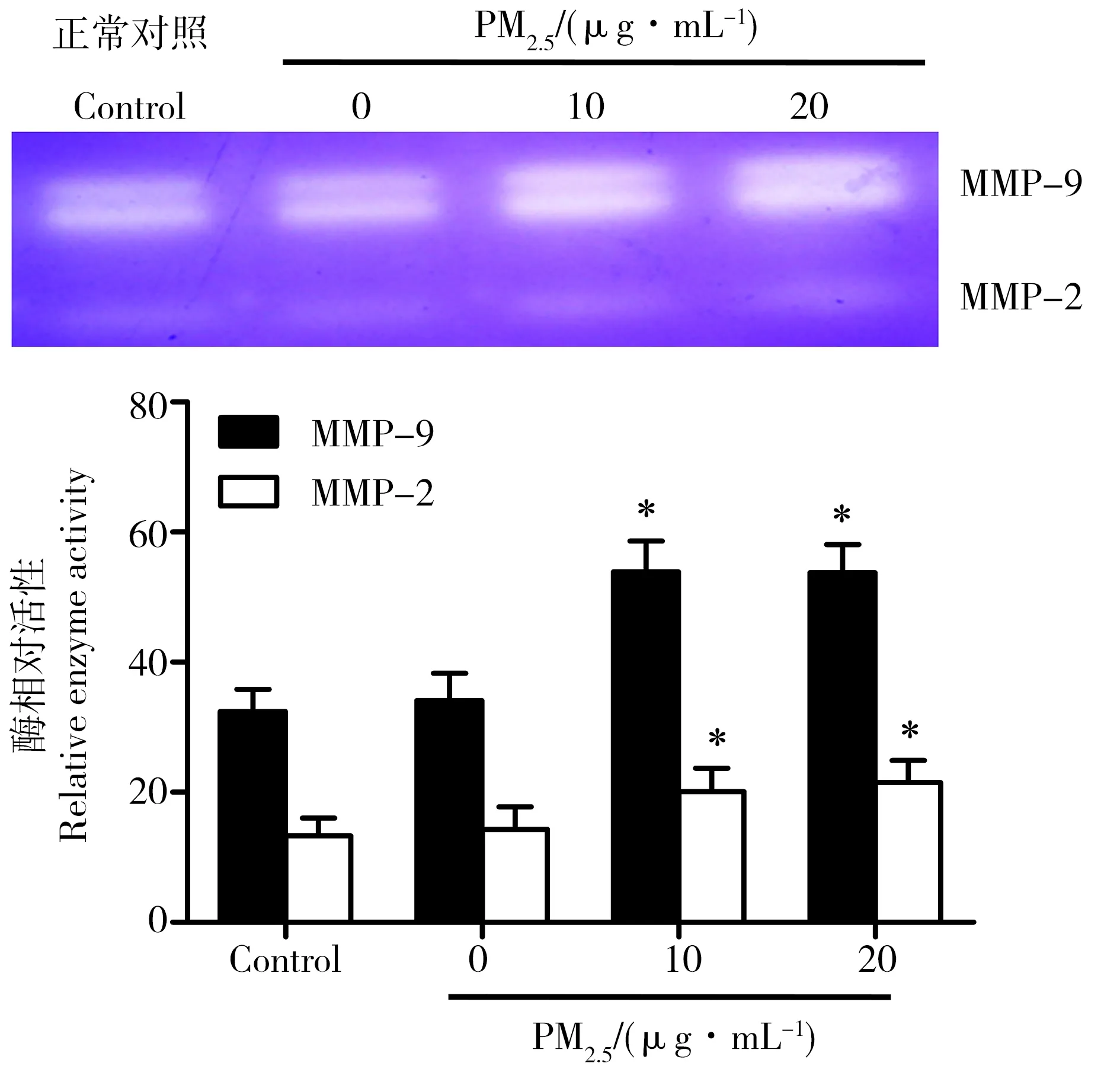
图4 PM2.5对A549细胞基质金属蛋白酶MMP-9和MMP-2活性的影响Fig. 4 Effect of PM2.5 on activities of MMP-2 and MMP-9 in A549 cells
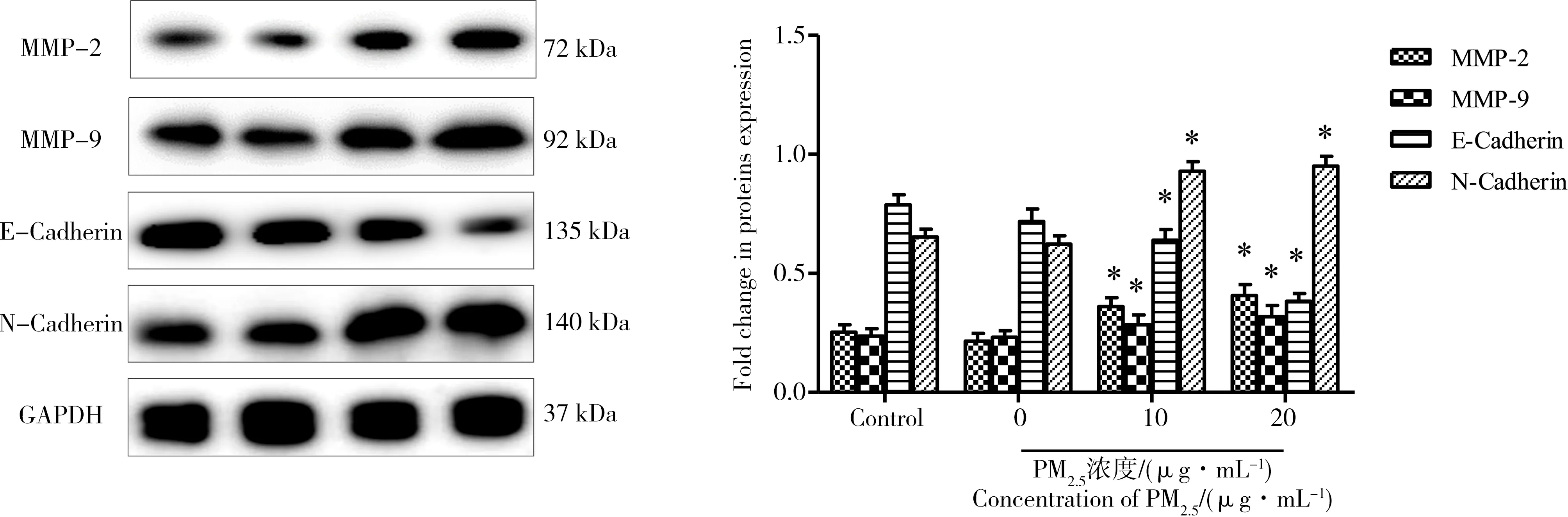
图5 PM2.5对A549细胞转移相关蛋白表达的影响Fig. 5 Effect of PM2.5 on the expression of metastasis associated proteins in A549 cells
随后,我们研究了PM2.5对A549细胞穿透基质胶能力的影响,结果发现PM2.5处理后,可穿透基质胶的细胞数量明显增加,说明PM2.5可明显增加细胞的侵袭能力。由于A549细胞的侵袭能力与其分泌的基质金属蛋白酶(MMPs)相关,我们利用明胶酶谱实验检测了PM2.5对A549细胞培养液中MMPs的活性的影响。结果发现,A549细胞分泌的基质金属蛋白酶MMP-2和MMP-9活力在PM2.5作用后均明显增强。Western blot 结果显示细胞中基质金属蛋白酶MMP-2和MMP-9的蛋白表达量也明显升高,说明这2种基质金属蛋白酶活力增强可能与其蛋白表达量升高有关。
综上所述,高浓度的PM2.5具有较强的细胞毒作用,而较低浓度的PM2.5可促进细胞-基质黏附、增加细胞迁移速率和侵袭能力。该结果提示PM2.5可能通过增强上述细胞生物学作用促进肺癌转移,但本实验仅是体外细胞实验且PM2.5样本来源有限,实验结果具有一定局限性,该效应及其机制还有待进一步体内研究证实和深入。
通讯作者简介:王晓波(1961-),男,药学博士,主任药师,教授,博士研究生导师,主要研究方向为新药研发、药物分析,发表学术论文200余篇。
参考文献(References):
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015 [J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132
[2] 张晓, 杨琼英, 林国桢, 等. 大气污染与居民肺癌发病及死亡灰色关联分析[J]. 中国公共卫生, 2014, 30(2): 165-171
Zhang X, Yang Q Y, Lin G Z, et al. Grey relational analysis on association between urban air pollution and lung cancer in China [J]. Chinese Journal of Public Health, 2014, 30(2): 165-171 (in Chinese)
[3] Anenberg S C, Horowitz L W, Tong D Q, et al. An estimate of the global burden of anthropogenic ozone and fine particulate matter on premature human mortality using atmospheric modeling [J]. Environmental Health Perspectives, 2010, 118(9): 1189-1195
[4] Pope C A, Burnett R T, Thun M J, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution [J]. The Journal of the American Medical Association, 2002, 287(9): 1132-1141
[5] 董雪玲. 大气可吸入颗粒物对环境和人体健康的危害 [J]. 资源产业, 2004, 6(5): 50-53
Dong X L. Impact of inhalable particles in atmosphere on environment and human health [J]. Resources and Industries, 2004, 6(5): 50-53 (in Chinese)
[6] Ying Z, Xie X, Bai Y, et al. Exposure to concentrated ambient particulate matter induces reversible increase of heart weight in spontaneously hypertensive rats [J]. Particle and Fibre Toxicology, 2015, 12: 15
[7] Kim J Y, Lee E Y, Choi I, et al. Effects of the particulate matter 2.5 (PM2.5) on lipoprotein metabolism, uptake and degradation, and embryo toxicity [J]. Molecules and Cells, 2015, 38(12): 1096-1104
[8] 楼煜清, 韩宝惠. PM2.5对呼吸系统肿瘤发生发展的影响[J]. 临床内科杂志, 2015, 32(4): 234-237
Lou Y Q, Han B H. The effects of PM2.5on the occurrence of tumor development in respiratory system [J]. Journal of Clinical Internal Medicine, 2015, 32(4): 234-237 (in Chinese)
[9] Dai L, Mehta A, Mordukhovich I, et al. Differential DNA methylation and PM2.5species in a 450K epigenome-wide association study [J]. Epigenetics, 2017, 12(2): 139-148
[10] Chu J H, Hart J E, Chhabra D, et al. Gene expression network analyses in response to air pollution exposures in the trucking industry [J]. Environmental Health: A Global Access Science Source, 2016, 15(1): 101-111
[11] Frazier J L, Garonzik I M, Rhines L D. Metastatic Lung Cancer [M]. Blackwell Publishing, Inc., 2008: 199-220
[12] 吴鸿章, 方来, 麻庆乐, 等. 大气细颗粒物 PM2.5对肺癌血管新生的影响[J]. 浙江中医药大学学报, 2016, 40(10): 723-734
Wu H Z, Fang L, Ma Q L, et al. Effect of PM2.5induced angiogenesis in lung cancer [J]. Journal of Zhejiang Chinese Medical University, 2016, 40(10): 723-734 (in Chinese)
[13] Fan L, Li Y, Sun Y, et al. Paris Saponin VII inhibits the migration and invasion in human A549 lung cancer cells [J]. Phytotherapy Research, 2015, 29(9): 1366-1372
[14] Friedl P, Wolf K. Tumour-cell invasion and migration: Diversity and escape mechanisms [J]. Nature Reviews Cancer, 2003, 3(5): 362-374
[15] Yang B, Chen D, Zhao H, et al. The effects for PM2.5exposure on non-small-cell lung cancer induced motility and proliferation [J]. Springer Plus, 2016, 5(1): 2059-2068
[16] Chen L, Shi M, Gao S, et al. Assessment of population exposure to PM2.5for mortality in China and its public health benefit based on BenMAP [J]. Environmental Pollution, 2017, 221: 311-317
[17] Badyda A J, Grellier J, Dadrowiecki P. Ambient PM2.5exposure and mortality due to lung cancer and cardiopulmonary diseases in Polish cities [J]. Advances in Experimental Medicine and Biology, 2017, 944: 9-17
[18] Wells A, Grahovac J, Wheeler S, et al. Targeting tumor cell motility as a strategy against invasion and metastasis [J]. Trends in Pharmacological Sciences, 2013, 34(5): 283-289
[19] Seyfried T N, Huysentruyt L C. On the origin of cancer metastasis [J]. Critical Reviews in Oncogenesis, 2013, 18(1-2): 43-73
[20] Shen H J, Sun Y H, Zhang S J, et al. Cigarette smoke-induced alveolar epithelial-mesenchymal transition is mediated by Rac1 activation [J]. Biochimica et Biophysica Acta, 2014, 1840(6): 1838-1849

