固相萃取-气相色谱-串联质谱法测定生活饮用水中18种邻苯二甲酸酯
朱萌萌,周敏,陈卢涛,胡松,俞璐萍,黎斌,胡晋峰,王川丕,*
(1.绿城农科检测技术有限公司,浙江杭州310000;2.安徽农业大学茶与食品科技学院茶叶生物与利用国家重点实验室,安徽合肥230036)
邻苯二甲酸酯(phthalate acid esters,PAEs)又称酞酸酯,是邻苯二甲酸形成酯的统称,是一类环境激素类物质,由于人类的大量生产和使用,目前已广泛存在于空气、水体、土壤、食品[1]和白酒[2]等介质中,成为地球上最广泛存在的环境污染物之一[3]。这类物质可通过呼吸、饮食和皮肤接触进入人类和动物体内,发挥着类似雌性激素的作用,具有不同程度的急慢性毒性、生态毒性、致畸、致突变等毒性[4]。我国塑料工业的发展使得大量的PAEs进入到水环境中,主要途径有:含PAEs工业废水的排放,废旧塑料垃圾填埋,含PAEs的废气随降尘和降水进入到水环境,且PAEs具有亲脂性和难降解的特性,可通过食物链的富集造成对人类的危害[5]。已有研究表明,我国多个地区地表水受到PAEs的污染。时瑶等利用气质联用仪(gas chromatography-massspectrometer,GC-MS)对大辽河表层水中的PAEs含量进行检测,共检出4种PAEs,浓度范围为 0.015 μg/L~0.754 μg/L[6]。王春等对南通市地表水中PAEs类污染物进行研究,测得地表水样品含有邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)和邻苯二甲酸二(2-乙基己)酯(bis(2-ethylhexyl)phthalate,DEHP)3 种 PAEs的浓度范围为 1.27 μg/L~20.4 μg/L[7]。我国GB 5749-2006《生活饮用水卫生标准》规定邻苯二甲酸二乙酯(diethyl phthalate,DEP)、DBP、DEHP 在饮用水中浓度上限分别为 300、3、8 μg/L。GB 3838-2002《地表水环境质量标准》规定集中式生活饮用水中DBP、DEHP 的限量分别为 3、8 μg/L。
目前国内外对PAEs化合物的样品前处理方法主要有玻璃纤维滤膜收集空气中PAEs[8]、中空纤维膜液液萃取[9]、固相微萃取[10]、液液萃取法[11]、QuEChERS 方法[12]。常用的检测方法有气相色谱法(gas chromato graphy-flame ionization detector,GC-FID)[13]、气相色谱-串联质谱法(gas chromatography-tandem mass,GC-MS/MS)[14]、高效液相色谱法[15]、液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)[16]、近红外光谱分析法[17]、酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)[18]等。目前全球生活饮用水中PAEs的浓度一般很低,含量一般为μg/L水平,在接近工业园的水域含量较高。使用传统的液液萃取法,不仅溶剂消耗量较大,富集效率不理想,且易引入溶剂中本身含有的PAEs化合物的干扰,造成结果不准确。王瑞[19]采用分散式液液萃取-高效液相色谱法测定饮料中DBP、邻苯二甲酸丁基苄基酯(butyl benzyl phthalate,BBP)、DEHP 3种PAEs化合物,在回收率满足要求的前提下,富集倍数达到67.2~120,取得较好的效果。本文拟采用固相微萃取的前处理方法,旨在探究一种富集效率高,操作简便,试剂使用量少,分析时间短,检出限低、灵敏度高的检测方法,实现对生活饮用水中18种PAEs化合物的的同时、快速检测分析。
1 材料与方法
1.1 材料与试剂
16种邻苯二甲酸酯类化合物混合标准品:邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二异丁酯(diisobutyl phthalate,DIBP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)、邻苯二甲酸二甲氧基乙酯(bis(2-methoxyethyl)phthalate,DMEP)、邻苯二甲酸二-4-甲基-2-戊酯(bis(4-methyl-2-pentyl)phthalate,BMPP)、邻苯二甲酸双-2-乙氧基乙酯(bis(2-ethoxyethyl)phthalate,DEEP)、邻苯二甲酸二戊酯(din-pentyl phthalate,DPP)、邻苯二甲酸二己酯(di-nhexyl phthalate,DHXP)、邻苯二甲酸丁基苄基酯(butyl benzyl phthalate,BBP)、邻苯二甲酸二丁氧基乙酯(bis(2-n-butoxyethyl)phthalate,DBEP)、邻苯二甲酸二(2-乙基己)酯(bis(2-ethylhexyl)phthalate,DEHP)、邻苯二甲酸二环己酯(dicyclohexyl phthalate,DCHP)、邻苯二甲酸二苯酯(diphenyl phthalate,DPhP)、邻苯二甲酸二正辛酯(di-n-octyl phthalate,DNOP)、邻苯二甲酸二壬酯(dinonyl phthalate,DNP),纯度≥99.0%]:美国o2si smart solutions标准品公司;邻苯二甲酸二烯丙酯(diallyl phthalate,DAP)标准品(纯度≥99.0%):德国Dr.Ehrenstorfer公司;邻苯二甲酸二异壬酯(diisononyl phthalate,DINP)标准品(纯度≥98.5%):德国Dr.Ehrenstorfer公司;二氯甲烷、甲醇、正己烷、乙腈(HPLC级):美国J.T.Baker公司;正己烷、乙腈、甲醇、二氯甲烷(分析纯):上海凌峰化学试剂有限公司;无水硫酸钠(优级纯,经450℃焙烧4 h~6 h后密封保存于广口瓶中,置于干燥器中保存备用):国药集团化学试剂有限公司;试验室所用水均为去离子水;Poly-Sery HLB SPE玻璃小柱(500 mg,6 mL):德国CNW公司。
1.2 仪器与设备
气相色谱-串联质谱仪[GC-2010 plus气相色谱仪配TQ8040质谱仪,VF-5MS色谱柱(30 m×0.25 mm×0.25 μm)]:日本 Shimadzu 公司;BSA2202S 电子天平:德国Sartorius公司;Tailboys VX-3000型漩涡混合器:美国Henry Troemner公司;Rotavapor R-300旋转蒸发仪:瑞士Buchi公司;AP-9925真空泵:天津奥特赛恩斯仪器有限公司;SPE-12A固相萃取装置:广州菲罗门科学仪器有限公司;KQ5200E超声波清洗器:昆山市超声仪器有限公司;MTN-5800氮吹仪:天津奥特赛恩斯仪器有限公司。
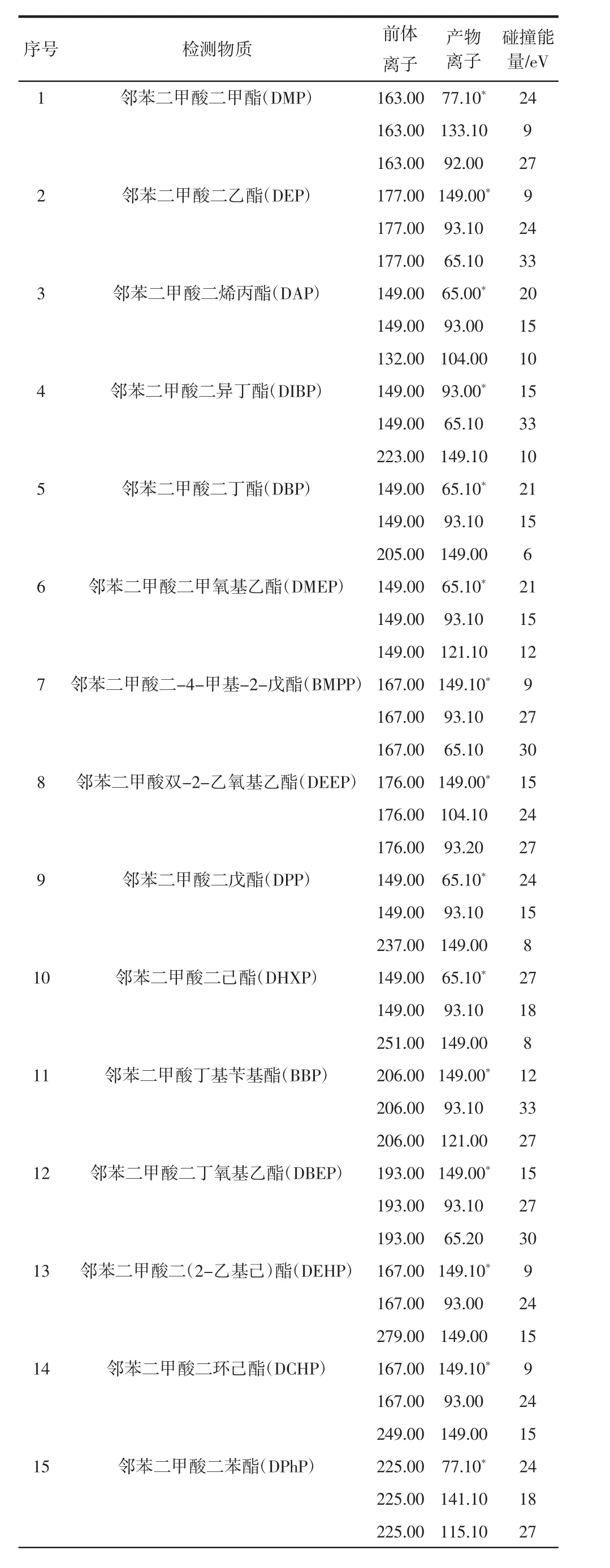
表1 18种邻苯二甲酸酯类化合物质谱检测参数Table 1 The MS/MS parameters of 18 kinds of PAEs
1.3 试验条件
1.3.1 色谱条件
进样口温度:310℃;载气:高纯氦气;碰撞气:高纯氩气,纯度≥99.999%;柱流量:1.50 mL/min;进样方式:不分流进样,1.0 min 后开阀;进样量:1 μL;定量方法:外标法;升温程序:60℃保持1 min,以20℃/min升至220℃,保持1 min,以10℃/min升至310℃,保持5.00 min。
1.3.2 质谱条件
色谱-质谱接口温度:310℃;电离方式:EI;电离能量:70 eV;离子源温度:250℃;检测器电压:0.99 kV(+0.6 kV);测定方式:多重反应监测(multiple reaction monitoring,MRM)模式;定性、定量离子、碰撞能量等参数见表1。
1.4 试验步骤
1.4.1 质量控制
试验过程中涉及到的玻璃仪器以10%稀硝酸浸
泡过夜,再以重铬酸钾洗液润洗浸泡20 min,分别用自来水、蒸馏水冲洗干净,在烘箱中120℃烘干待用。每次试验需同时进行5次不加入样品但按照实际样品的操作分析,取平均值为整个试验操作的过程空白值。
1.4.2 样品预处理
用棕色磨口玻璃瓶收集生活饮用水样品,在灌瓶前需用采样的水冲洗采样瓶3次。采集后的水样密封保存,置于0℃~4℃冰箱内保存待用,分析时用量筒量取静置后的上层水样品500 mL进行分析。
1.4.3 富集
将500 mg HLB玻璃小柱安装在固相萃取装置上,依次加入5.0 mL二氯甲烷、5.0 mL甲醇、5.0 mL蒸馏水活化。加入500 mL过滤后的生活饮用水样品,开启真空泵,使水样的流速恒定在8.0 mL/min。富集完毕后,继续抽滤30 min,使小柱中水完全抽干。抽干后的小柱下接10.0 mL具塞刻度管,以5.0 mL色谱纯二氯甲烷分两次洗脱,注意HLB固相萃取柱填料始终保持湿润状态,收集全部流出液,在常温条件下氮气流吹至1.0 mL,供气相色谱-串联质谱检测。
1.4.4 标准溶液的配制
吸取16种邻苯二甲酸酯类化合物混合标准溶液1 000 mg/L 1.00 mL,用色谱纯正己烷定容至25.0 mL,得到40.0 mg/L标准储备溶液;称取DAP、DINP约0.010 0 g,用色谱纯正己烷定容至25.0 mL,得到约400 mg/L标准储备溶液,于0℃~4℃保存。
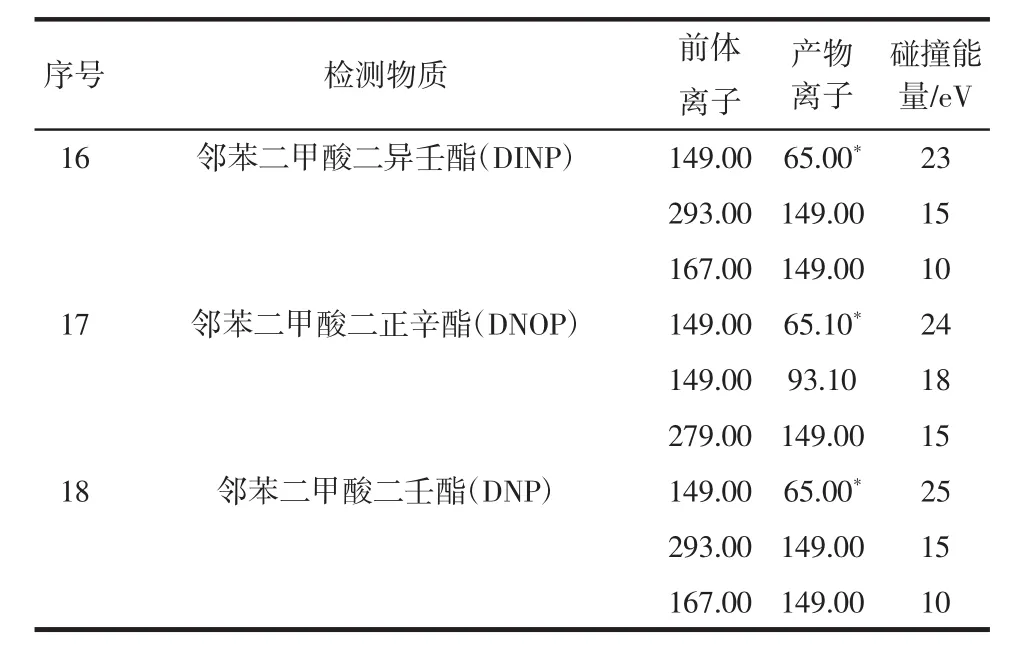
续表1 18种邻苯二甲酸酯类化合物质谱检测参数Continue table 1 The MS/MS parameters of 18 kinds of PAEs
2 结果与分析
2.1 气相色谱-质谱条件的优化
在电子轰击离子源(EI)检测模式下对18种PAEs化合物进行一级质谱分析(Q3 Scan),分别找到各个化合物的前体离子,设定3 eV~45 eV(每3 eV一个间隔)的碰撞能量,对选定的前体离子峰进行二级质谱分析(产物离子扫描),根据二级质谱图,选择离子强度最大的为定量离子,离子强度次之的为定性离子。图1A为使用优化后的气相色谱质谱条件采集18种PAEs化合物的多重反应监测模式(multiple reaction monitoring,MRM)质谱图。而邻苯二甲酸二异壬酯有大量同分异构体存在,沸点高,沸程宽,因此色谱图呈现峰组现象,本文选取6个响应最高的峰作为DINP参与结果计算。图1B为邻苯二甲酸二异壬酯(DINP)MRM质谱图。
2.2 试剂的考察
有机试剂在生产及运输过程中,不可避免的会接触到塑料制品,而PAEs易溶于丙酮、苯、正己烷等多种有机试剂,有机试剂中PAEs化合物残留量的多少,对采用富集、浓缩的方法分析生活饮用水中PAEs残留量会产生一定的干扰。前处理过程中若浓缩了大量溶剂,造成检测液中富集了大量的PAEs,不利于PAEs的检测[20]。因此本试验探究了二氯甲烷、甲醇、正己烷、乙腈4种常用于PAEs的提取试剂中PAEs的残留量,从而在试剂的选择上尽可能减小对本试验的影响。分别量取10 mL二氯甲烷、甲醇、正己烷、乙腈4种有机试剂加入到10 mL刻度管中,常温下缓缓氮吹浓缩至1 mL后GC-MS/MS分析,图2为4种有机试剂浓缩10倍后PAEs残留量的比较。

图2结果表明,4种有机试剂浓缩10倍后,在18种PAEs中均检出DIBP、DBP、DEHP。在分析纯二氯甲烷中,DEHP的检出量最高为1.75 mg/L;在分析纯甲醇中,DIBP的检出量最高为2.17 mg/L;在分析纯正己烷中,DBP的检出量最高为2.42 mg/L。由图2可以看出,4种有机试剂在色谱纯中的含量远低于分析纯中含量,分析纯二氯甲烷中DIBP、DBP的含量分别比色谱纯二氯甲烷高4.6、2.2倍,分析纯甲醇中DBP、DEHP的含量分别比色谱纯甲醇高3.1、3.0倍,分析纯正己烷中DIBP、DEHP分别比色谱纯正己烷高5.4、34.5倍,而DIBP、DBP、DEHP 3种PAEs化合物在分析纯乙腈和色谱纯乙腈中的含量接近。在4种色谱纯有机试剂中,色谱纯正己烷中DIBP、DBP、DEHP的含量最低。综上所述,通常采用色谱纯正己烷作为PAEs标准物质的配置溶剂,4种分析纯的有机试剂不能用于PAEs化合物的萃取试剂,易对试验结果的准确性造成干扰,4种色谱级的有机试剂可作为PAEs化合物的萃取、洗脱试剂。
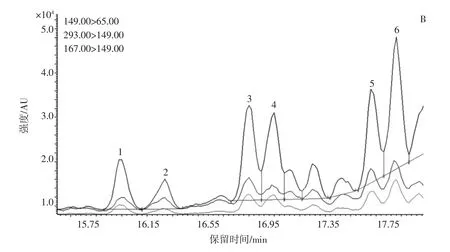
图1 18种PAEs化合物(A)和邻苯二甲酸二异壬酯(DINP)MRM色谱图(B)Fig.1 Chromatogram of 18 kinds of PAEs(A)and DINP(B)in multiple reactions monitoring mode(MRM)
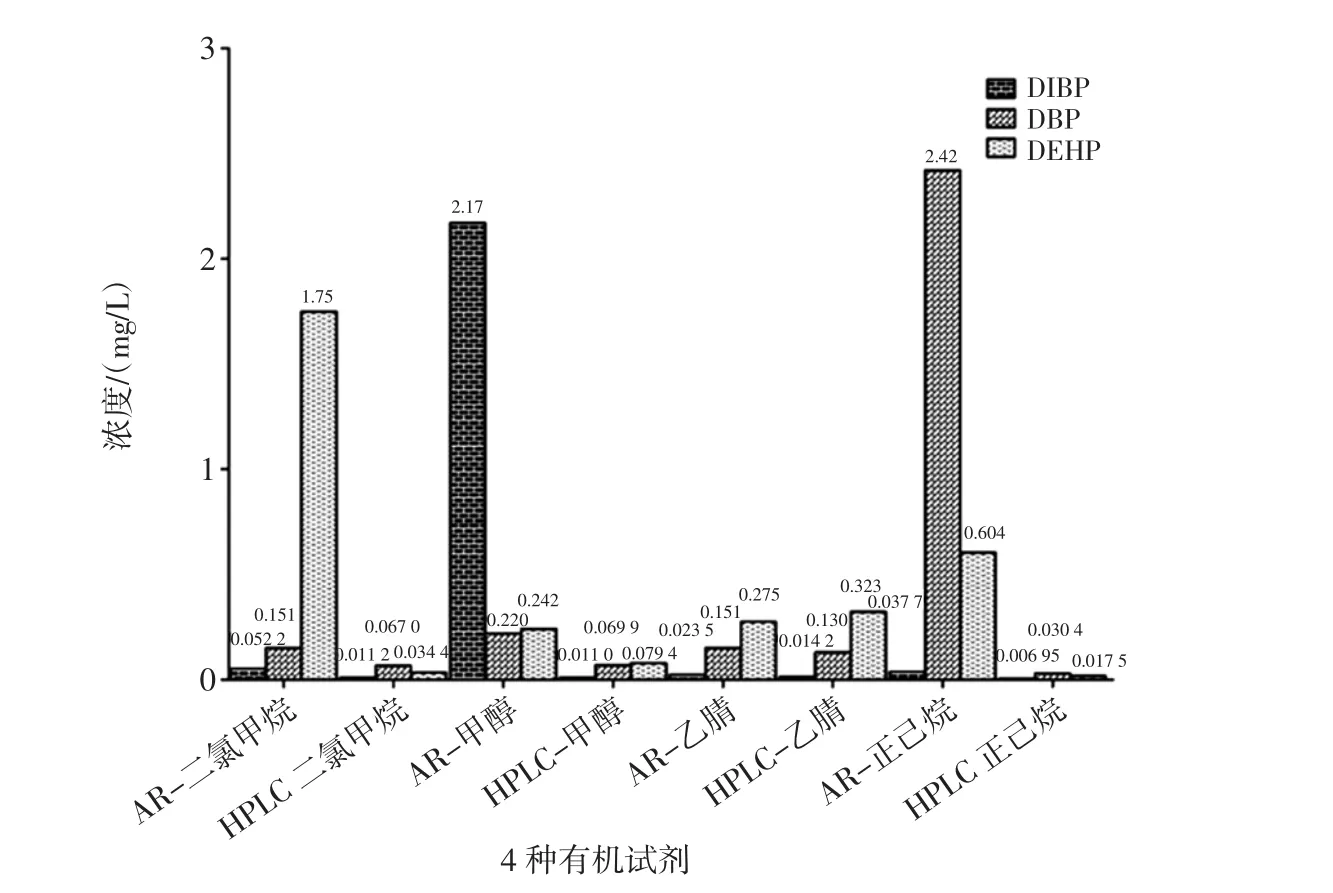
图2 4种AR、HPLC级有机试剂中PAEs残留量比较(浓缩10倍)Fig.2 Comparison of PAEs residues in four kinds of AR and HPLC grade organic reagents(concentrated 10 times)
2.3 洗脱试剂的考察
由2.2的考察,我们选取了色谱纯二氯甲烷、甲醇、乙腈、正己烷4种有机试剂作为18种PAEs化合物的洗脱试剂,按方法1.4进行纯净水添加回收试验,添加浓度为0.200 mg/L,由GC-MS/MS分析结果,并计算回收率,图3为4种洗脱溶剂对18种PAEs洗脱回收率的比较。
图3结果表明,正己烷对分子量较小的几种PAEs化合物洗脱能力较强,但对分子量较大的几种PAEs化合物洗脱能力较差。乙腈、甲醇对18种PAEs化合物的洗脱能力较为接近,但对DNP、BMPP、DINP的洗脱回收率较低,均低于70%。除了DMEP、DBEP两种PAEs化合物的回收率低于乙腈外,二氯甲烷对其它PAEs化合物的洗脱回收率均高于甲醇、乙腈。由图2可看出乙腈在浓缩10倍后,DIBP、DBP和DEHP的含量较二氯甲烷、甲醇中的残留量高,易对结果准确性产生较大干扰。综上所述,选取二氯甲烷作为18种PAEs化合物的洗脱、浓缩试剂。
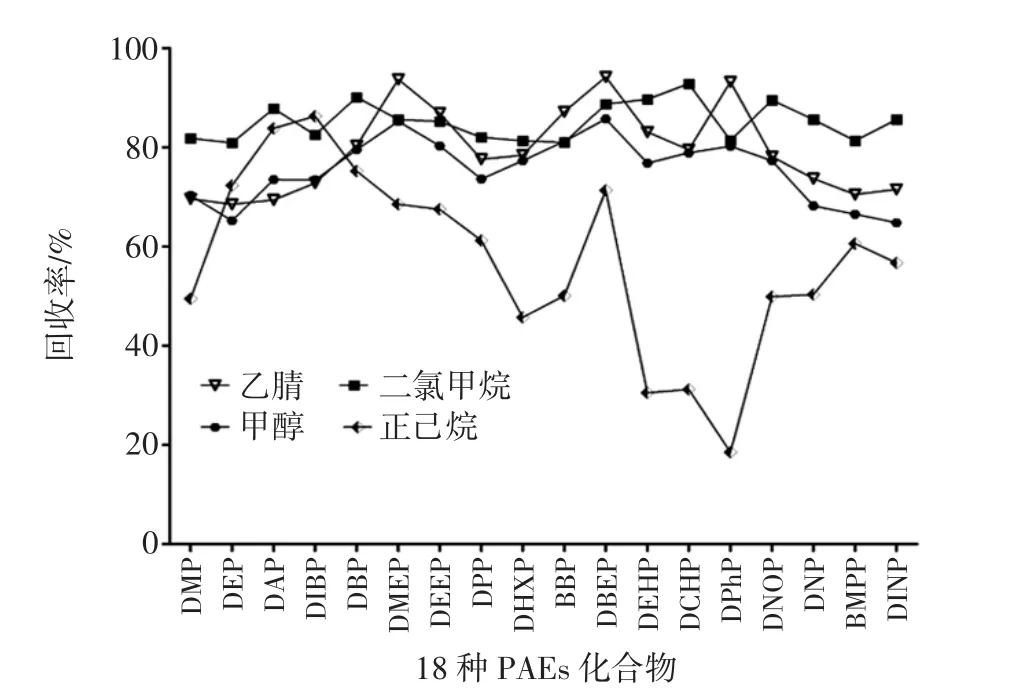
图3 不同洗脱溶剂对18种PAEs化合物回收率的影响Fig.3 Effects of different elution solvents on the recovery of 18 PAEs
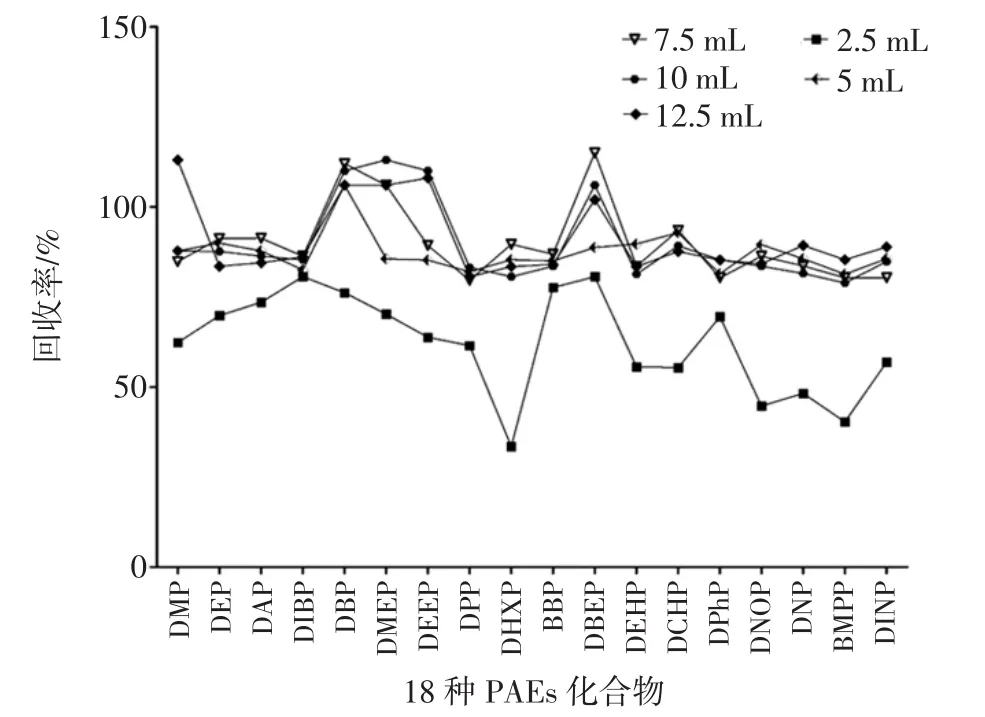
图4 不同洗脱体积对18种PAEs化合物回收率的影响Fig.4 Effects of different elution volumes on the recovery of 18 PAEs
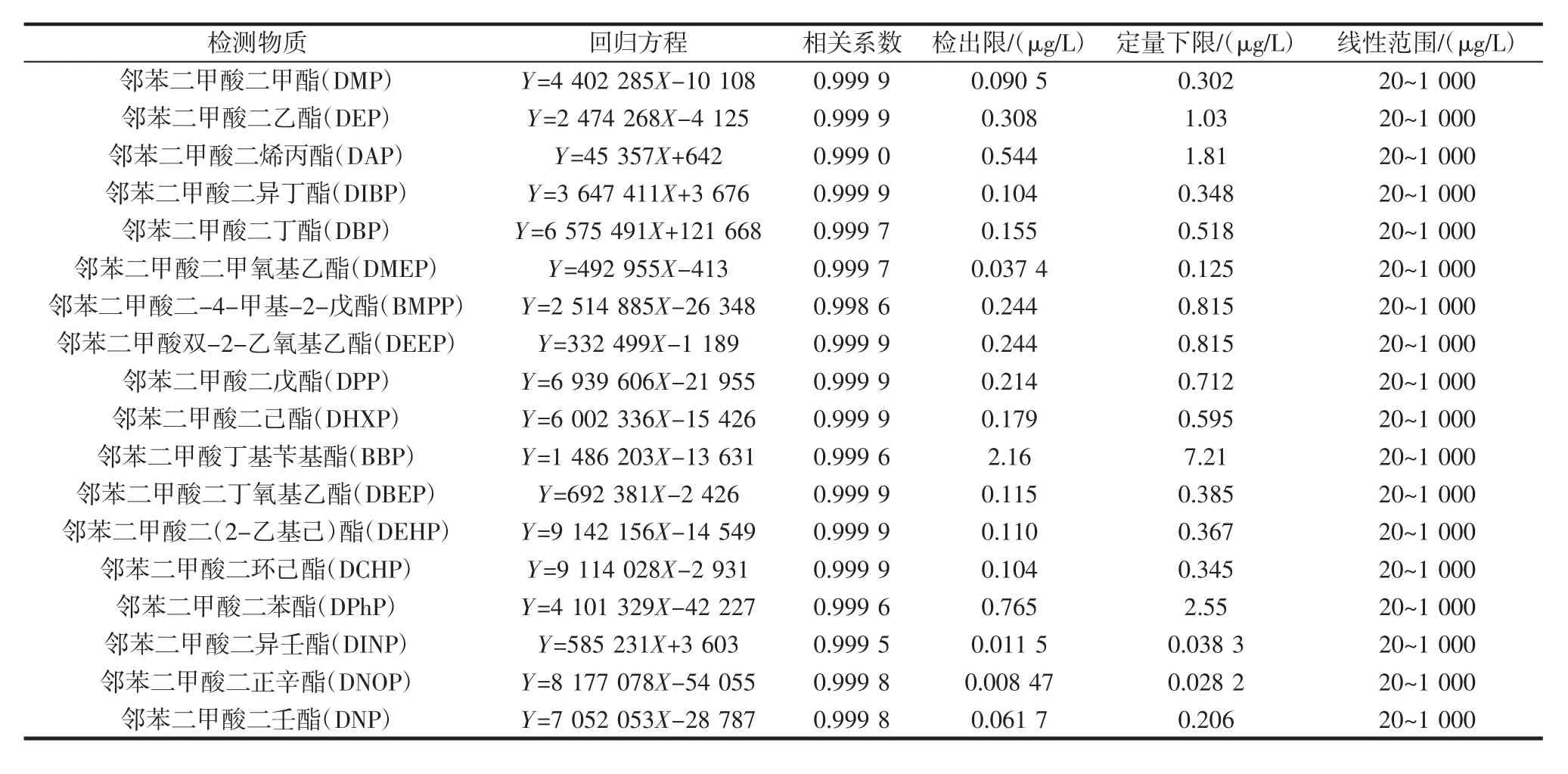
表2 18种邻苯二甲酸酯化合物的回归方程、相关系数、检出限和定量下限Table 2 Regression equation,correlation coefficient,limit of determination(LOD)and limit of quantity(LOQ)of 18 phthalate acid esters
2.4 洗脱体积的考察
不同的洗脱体积会影响到目标化合物的回收率,本试验分别考察了不同体积的二氯甲烷对18种PAEs化合物洗脱回收率的影响,结果见图4。
图4结果表明,当洗脱体积为2.5 mL时,仅有DIBP化合物的回收率在80%以上;随着洗脱体积的增大,当洗脱体积≥5.0 mL时,18种PAEs化合物的回收率均在81.3%以上,且基本保持不变。由于洗脱体积增大会造成溶剂的浪费、延长浓缩时间,空白值的含量也会变高,因此本试验选择作为5.0 mL作为最佳洗脱体积。
2.5 方法的线性范围、加标回收率、精密度和定量限
采用上述色谱条件,取 20.0、50.0、100、200、500、1 000 μg/L 6个质量浓度的18种邻苯二甲酸酯类化合物,按优化色谱条件进样1 μL,以峰面积为纵坐标,标准样品的质量浓度为横坐标绘制标准曲线,其线性回归方程及相关系数见表2,以信噪比S/N≥3估算仪器的检出限(LOD),S/N≥10估算仪器的定量限(LOQ),结果见表2。
为验证方法的准确度,选择娃哈哈纯净水、自来水和生活饮用水为代表性样品,分别添加0.020 0、0.100、0.200 mg/L不同水平的标准溶液进行回收率试验,每个添加水平重复3次,加标回收结果见表3。
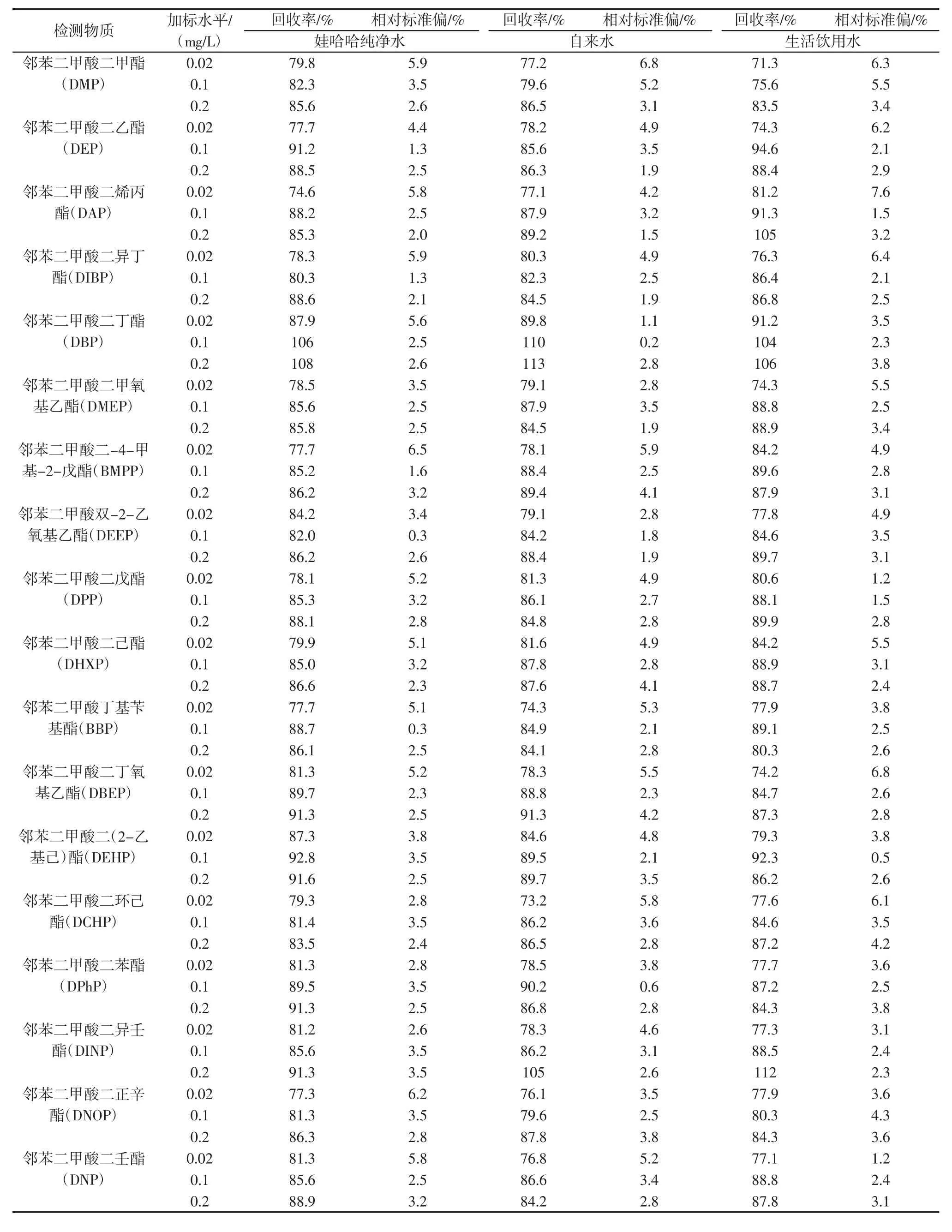
表3 18种PAEs的加标回收率及相对标准偏差(n=3)Table 3 Recoveries and RSD of 18 kinds of in Wahaha purified water,tap water and drinking water
18种PAEs化合物的平均回收率范围为71.3%~113%,相对标准偏差小于6.8%,符合GBT 27404-2008《实验室质量控制规范食品理化检测》附录F中对检测方法确认的要求。
3 结论
本试验建立了生活饮用水中18种邻苯二甲酸酯类化合物(PAEs)残留量的气相色谱-串联质谱(GCMS/MS)检测方法。通过对4种常见PAEs萃取溶剂的浓缩分析,发现不同溶剂中PAEs的含量不同,二氯甲烷、甲醇、正己烷、乙腈浓缩10倍后均检出邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己)酯(DEHP)3种 PAEs,含量范围为0.006 95 mg/kg~0.323 mg/kg,在PAEs的分析过程中,需进行多次过程空白分析,取平均值为整个试验操作的过程空白值,可最大程度的减小试剂中PAEs带入对试验结果准确性的影响。通过对洗脱溶剂的选择、洗脱体积的优化,最终确定了5 mL二氯甲烷作为最佳的洗脱溶剂和洗脱体积。采用优化后的GC-MS/MS方法,在 0.02、0.1、0.2 mg/kg的加标回收率试验,18种PAEs的平均回收率范围为71.3%~113%,相对标准偏差小于6.8%,符合GB/T 27404-2008附录F中对检测方法确认的要求。该方法操作简单,富集倍数高,灵敏度高,适用于生活饮用水中痕量PAEs的定量检测。
参考文献:
[1]Jian G,L Fang,T Deng,et al.Migration of phthalate esters(PAEs)in food simulacrum and their effect on the expression of enzymes(CYP3A4 and aromatase)[J].Journal of Chinese Institute of Food Science&Technology,2014,14(11):165-170
[2]Wang W L,Q Y Wu,C Wang,et al.Health risk assessment of phthalate esters(paes)in drinking water sources of China[J].Environmental Science&Pollution Research International,2015,22(5):3620-3630
[3]Watanabe T.Determination of dialkyl phthalates in high altitude atmosphere for validation of sampling method using a helicopter[J].Bulletin of Environmental Contamination&Toxicology,2001,66(4):456-463
[4]Lovekamp T N,B J Davis.Mono-(2-ethylhexyl)phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J].Toxicology&Applied Pharmacology,2001,172(3):217-224
[5]Staples C A,D R Peterson,T F Parkerton,et al.The environmental fate of phthalate esters:A literature review[J].Chemosphere,1997,35(4):667-749
[6]时瑶,马迎群,秦延文,等.大辽河表层水中邻苯二甲酸酯分布特征及环境健康风险评价[J].生态毒理学报,2016,11(6):197-206
[7]王春,李晓东,史玉坤,等.南通市地表水中邻苯二甲酸酯类污染状况研究[J].南通大学学报(医学版)医学版,2007,27(3):167-170[8]王雪晴.典型交通微环境空气中15种邻苯二甲酸酯的污染特征及健康风险[D].杭州:浙江大学,2015
[9]朱莉萍,朱涛,马运平,等.中空纤维膜液相微萃取-气相色谱质谱法快速测定蔬菜汁中15种邻苯二甲酸酯[J].分析化学,2013,41(7):1019-1024
[10]张泽明,张洪海,李建龙,等.固相微革取-气相色谱-质谱联用测定海水与沉积物中邻苯二甲酸酯类污染物[J].分析化学,2017,45(3):348-356
[11]吴鹏,於香湘,缪建军.小体积液液萃取气相色谱-质谱法测定水体中邻苯二甲酸酯[J].分析科学学报,2013(1):139-142
[12]孙欣,齐莉,秦廷亭,等.QuEChERS-气相色谱-三重四极杆质谱法检测黄瓜中的19种邻苯二甲酸酯[J].色谱,2014,32(11):1260-1265
[13]崔淑敏.分散液液微萃取—气相色谱联用在有机物残留分析中的应用研究[D].杭州:浙江师范大学,2013
[14]张则菊.气相色谱--质谱联用法测定食品中塑化剂与水中挥发性有机化合物[D].大连:辽宁师范大学,2013
[15]Shen H Y,H L Jiang,H L Mao,et al.Simultaneous determination of seven phthalates and four parabens in cosmetic products using HPLC-DAD and GC-MS methods[J].Journal of Separation Science,2007,30(1):48-54
[16]闫蕊,邵明媛,孙长华,等.加速溶剂萃取-高效液相色谱串联质谱法测定土壤中邻苯二甲酸酯[J].分析化学,2014(6):897-903
[17]王运丽,史新元,吴志生,等.利用近红外光谱技术快速检测邻苯二甲酸酯类物质[J].中国实验方剂学杂志,2013,19(5):86-90
[18]万宇平,陶光灿,李勇,等.邻苯二甲酸二丁酯(塑化剂)ELISA检测方法的研究[J].食品工业,2013(9):194-196
[19]王瑞,吴晓萌,栾传磊,等.饮料中邻苯二甲酸酯的分散式液液微萃取-高效液相色谱测定法[J].环境与健康杂志,2015,32(2):158-160
[20]李婷,汤智,洪武兴.分散固相萃取-气相色谱-质谱法测定含油脂食品中17种邻苯二甲酸酯[J].分析化学,2012,40(3):391-396

