围术期异体输血对胃癌患者Th17/Treg失衡的影响
任晓亮,王冰霜,曹娜娜,陈锦霞,王 坤,赵学涛
(河北医科大学第四医院,河北 石家庄 050011)
[作者简介] 任晓亮,男,博士,研究方向为临床输血管理、血液免疫学。
[通信作者] 赵学涛,E-mail: zhaoxuetao7701@163.com
[基金项目] 河北省卫计委青年科技课题资助项目(ZD20140268)
异体输血是恶性肿瘤患者进行根治性手术及术后放、化疗的重要支持治疗手段,其对于肿瘤患者免疫功能的影响及作用机制也成为医学领域研究的热点。研究表明,异体输血可导致肿瘤细胞发生免疫逃逸,促使肿瘤复发及转移,增加术后感染率等,对肿瘤患者的特异性及非特异性免疫均有明显抑制作用[1-2]。辅助性T淋巴细胞17(Th17)和调节性T细胞(Treg)属于新型T细胞亚群,在分化发育和功能发挥的过程中受到多种细胞因子和转录因子的调节,共同维护机体的免疫平衡。Th17可以促进免疫应答,与其分泌的特异性细胞因子白细胞介素-17(IL-17)形成Th17-IL-17轴,在宿主防御、自身免疫性疾病以及肿瘤中发挥着重要作用[3]。Treg细胞表达CD4、CD25,特征性地表达叉头状转录因子3(Foxp3),抑制免疫应答,在机体对抗肿瘤时发挥负向调节作用[4]。Th17、Treg细胞在机体免疫调节中发挥着重要作用[5],Th17/Treg失衡参与自身免疫、感染、肿瘤等疾病的发生和发展[6-9]。本研究通过检测健康者和胃癌患者输血前后外周血Th17、Treg细胞比例变化,评估了围术期输血对于胃癌患者Th17/Treg失衡的影响,现将结果报道如下。
1 临床资料
1.1一般资料 选择2015年1月—2016年3月在我院体检健康者20例作为对照组,男13例,女7例;年龄41~70岁。选择同期在胃肠外科接受胃癌根治手术患者57例作为胃癌组,男39例,女18例;年龄38~72岁;均经组织病理学证实,术前未接受放、化疗治疗,均无输血史,麻醉用药及手术方法相同,临床资料完整;排除伴自身免疫性疾病(类风湿关节炎、系统性红斑狼疮、血管炎)、血液及淋巴系统疾病者,近2年内服用过任何免疫调节药物者,既往其他恶性肿瘤者,有严重心血管基础疾病者。所有患者签署知情同意书,本研究已通过河北医科大学第四医院伦理委员会审查。根据围手术期是否输异体血,将胃癌组患者分为未输血组26例和输血组(术中输注悬浮红细胞)31例,2组性别、年龄、体质量、血红蛋白(Hb)量比较差异无统计学意义(P均>0.05),具有可比性,见表1。

表1 2组胃癌患者一般临床指标比较
1.2试剂和仪器 FITC标记鼠抗人CD4抗体、PE 标记鼠抗人IL-17抗体、PE标记鼠抗人CD25抗体、PerCP-Cy5.5标记鼠抗人Foxp3抗体、Thl7破膜剂、FoxP3固定剂和破膜剂、Permeabilization buffer等抗体及试剂均购自eBioseience公司,Ficoll淋巴细胞分离液(天津川页生化制品有限公司),RPMI1640培养基等用于流式细胞染色的抗体均购自美国Biolegend公司,PMA、Ionomycin、BFA等检测试剂均购自Sigma公司。实验仪器:FACSCalibur流式细胞仪(BD Biosciences)、CO2培养箱(TC 2323型,美国Sheldon公司)、24孔细胞培养板(Costar)。
1.3观察指标 采集对照组和胃癌组术前1 d和术后1 d、7 d、14 d空腹外周静脉血标本5 mL,3 000 r/min离心10 min后取血清保存。流式细胞术分别检测并计算Th17、Treg细胞占CD4淋巴细胞比例(分别以其特征性分泌的CD4+IL-17+和CD25+Foxp3+细胞因子所占CD4+T淋巴细胞的百分比表示)。
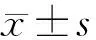
2 结 果
2.1对照组与胃癌组外周血Th17、Treg细胞比例及Th17/Treg比值比较 胃癌组患者外周血中Th17、Treg细胞比例及Th17/Treg比值均明显高于对照组(P均<0.05)。见表2。
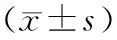
表2 对照组与胃癌组外周血Th17、Treg细胞比例及Th17/Treg比值比较
注:①与对照组比较,P<0.05。
2.2未输血组与输血组术前及术后外周血Th17、Treg细胞比例及Th17/Treg比值比较 术后14 d,未输血组外周血Th17、Treg细胞比例及Th17/Treg比值与术前1 d比较差异无统计学意义(P均>0.05);输血组外周血Th17、Treg细胞比例均明显高于术前1 d及同期未输血组(P均<0.05),而Th17/Treg比值明显低于术前1 d及同期未输血组(P均<0.05)。见表3。
3 讨 论
异体输血可能与恶性肿瘤患者的不良预后相关。肿瘤免疫和移植相关医学研究表明:异体血中的可溶性白细胞抗原、细胞因子等生物活性成分可能通过抑制免疫效应细胞,同时刺激免疫抑制细胞,对肿瘤患者的特异性及非特异性免疫产生明显抑制作用,包括降低辅助性T细胞(Th)及自然杀伤细胞(NK)的活性,增加抑制性T细胞(Ts)等[1-2]。异体血中的异型白细胞可直接活化受血者体内的CD4+T细胞,导致细胞因子分泌[10]。Th1细胞主要分泌IL-2、IFN-γ和TNF-β等,可介导与细胞毒和局部炎症有关的免疫应答;Th2细胞主要分泌IL-4、IL-5、IL-6和IL-10,主要功能为刺激B 细胞增生并产生抗体,可抑制Th1的功能[11]。输血引发的主要免疫学改变为Th1细胞因子产量降低,Th2细胞因子产量增加[12]。而除Th1、Th2外,初始CD4+T细胞还可分化为Th17和Treg两种新型T细胞亚群。其分化、发育调节机制不同于Th1、Th2,与自身免疫性疾病和感染性疾病的发生发展关系密切[4-5]。Th17细胞主要分泌IL-17,在炎症、自身免疫性疾病[13]以及移植物抗宿主病[12]等疾病中具有重要的致病作用;Treg特征性表达 Foxp3,可通过分泌IL-4、IL-10和转化生长因子-β(TGF-β)等细胞因子抑制抗肿瘤免疫应答,不利于肿瘤免疫监视和抗肿瘤免疫[7]。Th17细胞和Treg细胞在分化过程中具有高度相关性,在功能上相互拮抗,即TGF-β诱导初始T细胞分化为Treg,而TGF-β和IL-6共同作用下可诱导初始T细胞分化为Th17[6]。
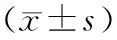
表3 未输血组与输血组术前及术后外周血Th17、Treg细胞比例及Th17/Treg比值比较
注:①与术前1d比较,P<0.05;②与未输血组比较,P<0.05。
目前研究表明,胃癌[7-8]、宫颈癌[9]、肺癌[14]、子宫内膜癌[15]等患者的外周血或肿瘤组织中Th17细胞水平明显升高,提示Th17细胞利于肿瘤的生长;在肿瘤微环境中,Treg细胞对T细胞免疫应答有很强的免疫抑制活性,对机体抗肿瘤免疫意义重大[16]。Li 等[7]发现胃癌患者Th17、Treg细胞及Th17/Treg细胞比值明显增高,并与患者TNM分期、淋巴结转移、肿瘤分化程度相关,提示胃癌患者存在Th17/Treg失衡并促进了胃癌的进展。本研究结果显示,胃癌患者外周血中Th17、Treg细胞比例及Th17/Treg比值均明显高于对照组,与上述结论一致。Maruyama等[17]认为在胃癌早期以Th17细胞增高为主,并随着肿瘤的进展减少;Treg细胞则随肿瘤进展显著增高,提示Treg细胞与胃癌进展相关,在Th17/Treg失衡中占主导地位。Wolf 等[18]在对卵巢癌的研究中发现,增多的Treg细胞可导致患者存活率降低。本研究结果显示,胃癌患者输血后14 d,Th17、Treg细胞比例均增高,其中Treg细胞比例增高更为显著,导致Th17/Treg比值明显降低,加剧Th17/Treg失衡,影响患者的细胞免疫,可能促进胃癌进展并影响预后。
综上所述,胃癌患者存在Th17/Treg失衡;围术期异体输血可能通过调节Th17、Treg免疫细胞表达导致Th17/Treg失衡加剧,影响胃癌患者的细胞免疫状态。故对于恶性肿瘤患者输血应更加审慎,合理应用血液制品,推广去白及辐照血液制品[19-20]的使用,对于维持胃癌患者的细胞免疫功能状态具有重要意义。本研究未涉及患者肿瘤性质、分期及淋巴结转移等因素,还有待进一步研究。
[参考文献]
[1] Squires MH,Kooby DA,Poultsides GA,et al. Effect of perioperative transfusion on recurrence and survival after gastric cancer resection:A 7-institution analysis of 765 patients from the US gastric cancer collaborative[J]. J Am Coll Surg,2015,221(3):767-777
[2] Pacelli F,Rosa F,Marrelli D,et al. Do perioperative blood transfusions influence prognosis of gastric cancer patients? Analysis of 927 patients and interactions with splenectomy[J]. Ann Surg Oncol,2011,18(6):1615-1623
[3] Jiang W,Su J,Zhang X,et al. Elevated levels of Th17 cells and Th17-related cytokines are associated with disease activityin patients with inflammatory bowel disease[J]. Inflamm Res,2014,63(11):943-950
[4] Rubtsov YP,Niec RE,Josefowicz S,et al. Stability of the regulatory T cell lineage in vivo[J]. Science,2010,329(5999):1667-1671
[5] Moschen AR,Geiger S,Krehan I,et al. Interferon-alpha controls IL-17 expression in vitro and in vivo[J]. Immunobiology,2008,213(9/10):779-787
[6] Noack M,Miossec P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J]. Autoimmun Rev,2014,13(6):668-677
[7] Li Q,Li Q,Chen J,et al. Prevalence of Th17 and Treg cells in gastric cancer patients and its correlation with clinical parameters[J]. Oncol Rep,2013,30(3):1215-1222
[8] HuJL,YangZ,TangJR,etal.Effectsof gastriccancercellsonthedifferentiationofTregcells[J].AsianPacJCancerPrev,2013,14(8):4607-4610
[9] Zhang Y,Ma D,Zhang Y,et al. The imbalance of Th17/Treg in patients with uterine cervical cancer[J]. Clin Chim Acta,2011,412(11/12):894-900
[10] 李丽玮,李志强. 恶性肿瘤患者围术期输血与术后肿瘤复发机制研究新进展[J]. 中国输血杂志,2011,24(9):758-759
[11] Leal-Noval SR,Arellano V,Vallejo A,et al. The influence of the preoperative immune response on blood transfusion requirements in patients undergoing cardiac surgery[J]. J Cardiothorac Vasc Anesth,2009,23(3):330-335
[12] Ratajczak P,Janin A,Peffault de Latour R,et al. Th17/Treg ratio in human graft-versus-host disease[J]. Blood,2010,116(7):1165-1171
[13] Cata JP,Wang H,Gottumukkala V,et al. Inflammatory response, immunosuppression,and cancer recurrence after perioperative blood transfusions[J]. Br J Anaesth,2013,110(5):690-701
[14] Duan MC,Han W,Jin PW,et al. Disturbed Th17/Treg balance in patients with non-small cell lung cancer[J]. Inflammation,2015,38(6):2156-2165
[15] Zhang W,Hou F,Zhang Y,et al. Changes of Th17/Tc17 and Th17/Treg cells in endometrial carcinoma[J]. Gynecol Oncol,2014,132(3):599-605
[16] Miller AM,Lundberg K,Ozenci V,et al. CD4+CD25high T cells are enriched in the tumor and peripheral blood of prostate cancer patients[J]. J Immunol,2006,177(10):7398-7405
[17] Maruyama T,Kono K,Mizukami Y,et al. Distribution of Th17 cells and FoxP3(+) regulatory T cells in tumor-infiltrating lymphocytes, tumor-draining lymph nodes and peripheral blood lymphocytes in patients with gastric cancer[J]. Cancer Sci,2010,101(9):1947-1954
[18] Wolf D,Wolf AM,Rumpold H,et al. The expression of the regulatory T cell-specific forkhead box transcription factor FoxP3 is associated with poor prognosis in ovarian cancer[J]. Clin Cancer Res,2005,11(23):8326-8331
[19] 赵学涛,李捷,杨从容. 异体成分血输注对肝癌患者体内CD4+CD25+T细胞的影响[J]. 中国输血杂志,2013,26(12):1173-1174
[20] 任晓亮,李明,巨红妹,等. 围术期异体输血对肺癌患者Th1/Th2、Th17/Treg细胞因子失衡的影响[J]. 现代中西医结合杂志,2017,26(15):1601-1603

