叶酸靶向的纳米金载体构建及其对HeLa细胞杀伤作用的研究
(青岛大学医学部公共卫生学院,山东 青岛 266021)
恶性肿瘤传统的三大治疗方式是放疗、化疗、手术治疗。阿霉素(DOX)是一种抗肿瘤谱广泛的化疗药物,可以抑制DNA的合成从而达到抗肿瘤效果[1]。但是DOX具有损伤骨髓造血功能、心脏毒性大等药物副作用[2],如何将DOX靶向运输到肿瘤部位并减少其在正常组织中的分布将成为研究的关键。随着纳米技术的发展,纳米医学受到了越来越广泛的关注并对疾病治疗提供了许多新的思路。其中,纳米金由于生物相容性好、性质稳定、合成简便、容易修饰以及无毒等优点一直是研究的热点之一[3],并广泛应用于生物成像、生物传感、载药等领域[4-5],所以这类金纳米材料可以作为载药平台,结合DOX用于抗肿瘤药物的运输。叶酸(FA)是机体生长发育所必需的营养物质,作为一种物质合成必须的维生素,FA在增生旺盛的细胞中需求量更大[6]。FA可以通过叶酸受体(FR)进入细胞,FR在正常细胞表面低表达,而在大多数肿瘤细胞的表面过度表达,以使生长旺盛的肿瘤细胞获得更多的FA[7]。因此,可利用FR的表达特性,将FR作为药物靶向的重要分子,结合抗肿瘤药物构建FA靶向的载药平台用于抗肿瘤研究[8]。有研究表明,人宫颈癌HeLa细胞表面FR是过量表达的[9],而人乳腺癌MCF-7细胞表面FR是低表达的[10]。本研究以牛血清白蛋白为模板合成纳米金(Au-BSA),并以Au-BSA作为载体,结合FA提供靶向功能,结合DOX作为化疗药物,建立FA靶向的Au-BSA载体并负载阿霉素(Au-BSA-DOX-FA),用于探讨其对FR高表达的HeLa细胞的杀伤作用。
1 材料与方法
1.1 材料来源
HeLa细胞、MCF-7细胞和HSF细胞由青岛大学医学部公共卫生学院提供。
1.2 主要试剂
牛血清白蛋白(BSA)购于上海实生西巴斯科技发展有限公司;氯金酸、抗坏血酸、叶酸、顺乌头酸酐、1,4-二氧六环、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)购于国药集团化学试剂有限公司;DOX购于美国Sigma公司。
1.3 构建Au-BSA-DOX-FA
1.3.1制备BSA修饰的Au-BSA 将10 mL质量浓度为5 g/L牛血清白蛋白溶液与1 mL浓度为10 mmol/L的氯金酸溶液混合,室温下置于磁力搅拌器上搅拌30 min,转速为10 00 r/min。然后加入20 mg抗坏血酸继续搅拌2 h。溶液由最初的浅蓝色首先先变为无色再变为蓝紫色,说明Au-BSA已经制备完成。在透射电子显微镜下观察所合成的Au-BSA,并利用紫外可见分光光度计测量其全波长吸收光谱。Au-BSA在室温下可以稳定存在3个月以上。
1.3.2将Au-BSA与DOX和FA结合 将7 mg DOX溶解于4 mL蒸馏水中,冰水浴。将5 mg顺乌头酸酐溶解于200 μL的1,4-二氧六环中,然后缓慢加入上述DOX溶液中,并搅拌。用0.5 mol/L NaOH迅速将上述反应物的pH调至9.0,在冰水浴中反应20 min,然后用1 mol/L的HCl将pH调至7.0,搅拌30 min。随后继续滴加HCl直至形成较大沉淀(沉淀为顺乌头酸酐与DOX的混合物),冰水浴15 min后,80 00 r/min离心10 min,去除上清液后,得到沉淀物。该沉淀物与7 mg EDC、3 mg NHS一起溶解于3 mL蒸馏水中,室温黑暗中搅拌4 h,上述混合溶液与30 g/L的Au-BSA溶液2 mL混合后继续黑暗中搅拌16 h。反应完成后,通过葡萄糖凝胶G-25分离去除多余的Au-BSA和DOX,即得到Au-BSA-DOX复合物。
将质量5 mg的FA溶解于体积1 mL DMSO中,将3 mg EDC和2 mg NHS在室温黑暗中搅拌4 h后与上述溶液进行混合。将Au-BSA-DOX溶液(3 mL,20 g/L)加入该混合溶液,室温黑暗中搅拌10 h,反应完成之后,通过葡萄糖凝胶G-25分离去除多余的FA,即得到Au-BSA-DOX-FA。利用紫外可见分光光度计测量其吸收光谱,从而确定该复合物是否成功合成。
1.4 Au-BSA-DOX-FA在不同pH值条件下DOX的释放
1.4.1绘制DOX标准曲线 以2倍的浓度梯度配置不同浓度的DOX标准溶液,标准溶液浓度分别为1.875、3.75、7.5、15、30、60 mg/L。用紫外可见分光光度计在495 nm波长下测定各标准溶液的吸光度(A)值,计算回归方程,绘制标准曲线。
1.4.2DOX的释放 通过调节不同的pH值(pH分别为3.5、5.0、6.5、7.4、9.0),绘制Au-BSA-DOX-FA中DOX在不同的pH值条件下的释放曲线。将1 mL Au-BSA-DOX-FA置于透析管中,然后将透析管置于盛有10 mL氢氧化钠和柠檬酸钠缓冲溶液的塑料管中,塑料管中缓冲溶液的pH分别调至3.5、5.0、6.5、7.4、9.0。该测试在摇床中进行,参数设置为37 ℃,50 r/min。每隔一定时间间隔(3、6、12、24、48 h),更换新的缓冲溶液,并用紫外可见分光光度计测定吸光度值,根据标准曲线计算缓冲溶液中DOX的含量,绘制DOX释放曲线。
1.5 细胞毒性实验
为了确定所合成的Au-BSA的细胞毒性,采用MTT法检测经Au-BSA培养的HeLa细胞、MCF-7细胞和HSF细胞的活力。取对数生长期的HeLa细胞、MCF-7细胞和HSF细胞接种于96孔板,每孔加入100 μL,接种密度为1×104/孔。不同浓度的Au-BSA溶液(0、1.6、3.2、6.25、12.5、25、50、100 mg/L)分别加到不同组别的孔中。置二氧化碳培养箱中培养48 h后,用pH为7.0的PBS清洗3次,向各孔中加入MTT继续培养4 h,去除上清液后加入DMSO溶液,震荡10 min以后采用酶标仪在570 nm波长下检测吸光度(A)值。
1.6 对肿瘤细胞的靶向杀伤作用比较
为了确定靶向杀伤作用,用MTT实验测定分别经Au-BSA-DOX-FA以及DOX干预的HeLa细胞、MCF-7细胞和HSF细胞活力。Au-BSA-DOX-FA干预组中,复合物中包含的DOX的浓度分别为0.045、0.09、0.185、0.375、0.75、1.5 mg/L。DOX干预组中,DOX的浓度与Au-BSA-DOX-FA干预组中包含的DOX的浓度一致。于37 ℃、含体积分数0.05二氧化碳培养箱中培养48 h后,用pH为7.0的PBS清洗3次,向各孔中加入MTT继续培养4 h,去除上清液然后加入DMSO溶液,震荡10 min后用酶标仪在570 nm波长下检测吸光度(A)值。
1.7 统计学处理
数据应用SPSS 17.0软件进行统计学分析,Au-BSA-DOX-FA与DOX对细胞杀伤效果比较用两组独立样本比较的秩和检验即曼-惠特尼秩和检验(Mann-Whitney Test),检验水准α=0.05。
2 结 果
2.1 Au-BSA-DOX-FA的合成与表征
透射电子显微镜(TEM)镜下,所制备的Au-BSA呈单分散的花状结构,粒径约50 nm(图1)。紫外可见分光光度计测量所合成Au-BSA-DOX-FA的吸收光谱如图2所示,FA以及DOX分别在360以及495 nm波长处有较强的吸收峰。Au-BSA在280 nm处有一个较强的吸收峰,这是牛血清白蛋白的特征峰,说明纳米材料中有牛血清白蛋白的存在,Au-BSA的特征吸收峰如小图所示,在580 nm波长处。BSA、FA以及DOX的特征吸收峰(280、360、495 nm波长处)在Au-BSA-DOX-FA的吸收曲线中均可见,说明已经成功地在Au-BSA上结合上了FA和DOX。
2.2 建立标准曲线
建立吸光度(A)值对DOX标准溶液(C)的一元线性回归方程。495 nm波长时不同浓度DOX的吸光度(A)值随着浓度的升高而增大,回归方程为:A=0.044C+0.04,决定系数R2=0.999,说明在吸光度(A)值的总变异中,浓度C可以解释吸光度(A)值变异的99.9%,即用浓度来预测吸光度的效果好,在0~60 mg/L范围内,DOX浓度与吸光度(A)值有良好的线性关系。见图3。

图1 Au-BSA的TEM照片
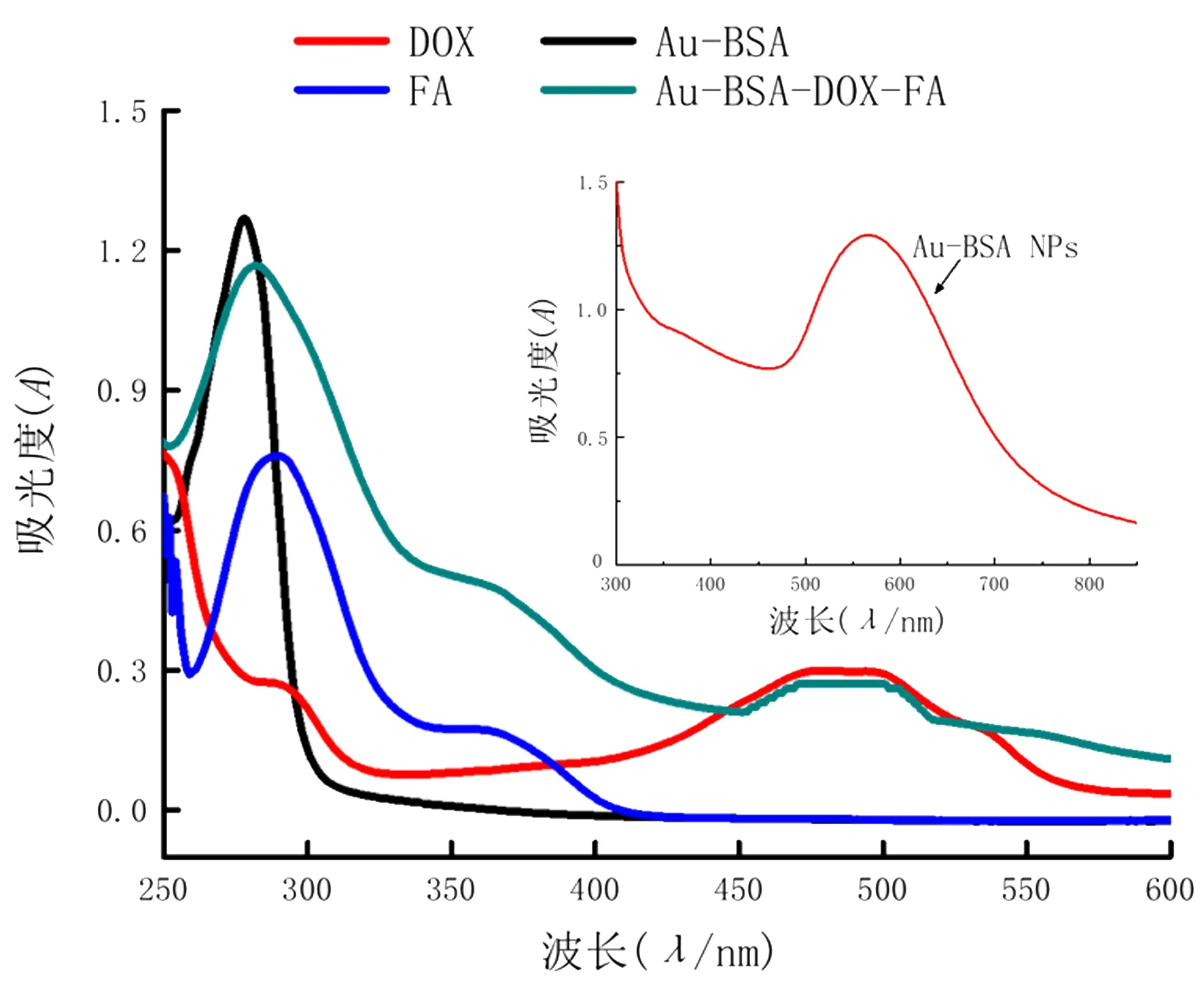
图2 DOX、FA、Au-BSA及Au-BSA-DOX-FA的紫外吸收光谱
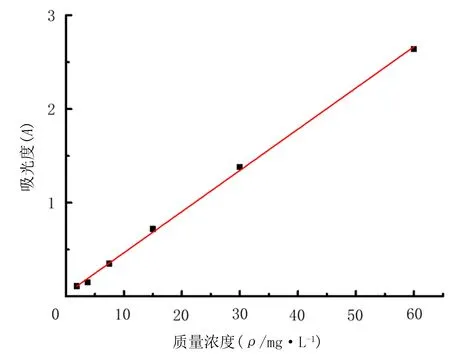
图3 DOX的标准曲线
2.3 pH敏感的药物释放
为达到pH敏感可控的药物释放效果,本研究使用顺乌头酸酐作为连接DOX与Au-BSA的药物。DOX从Au-BSA-FA-DOX复合物上释放的效果通过测量其在不同pH值下在缓冲溶液中的含量来反应。如图4所示,当pH为7.4和9.0时,DOX从Au-BSA-FA-DOX复合物释放出来的数量大约为20%。相比之下,当pH为6.5时,DOX的释放量约为60%,释放量是前者的3倍。当pH为3.5以及5.0时,DOX的释放量达到了约90%,释放量提高到4.5倍。
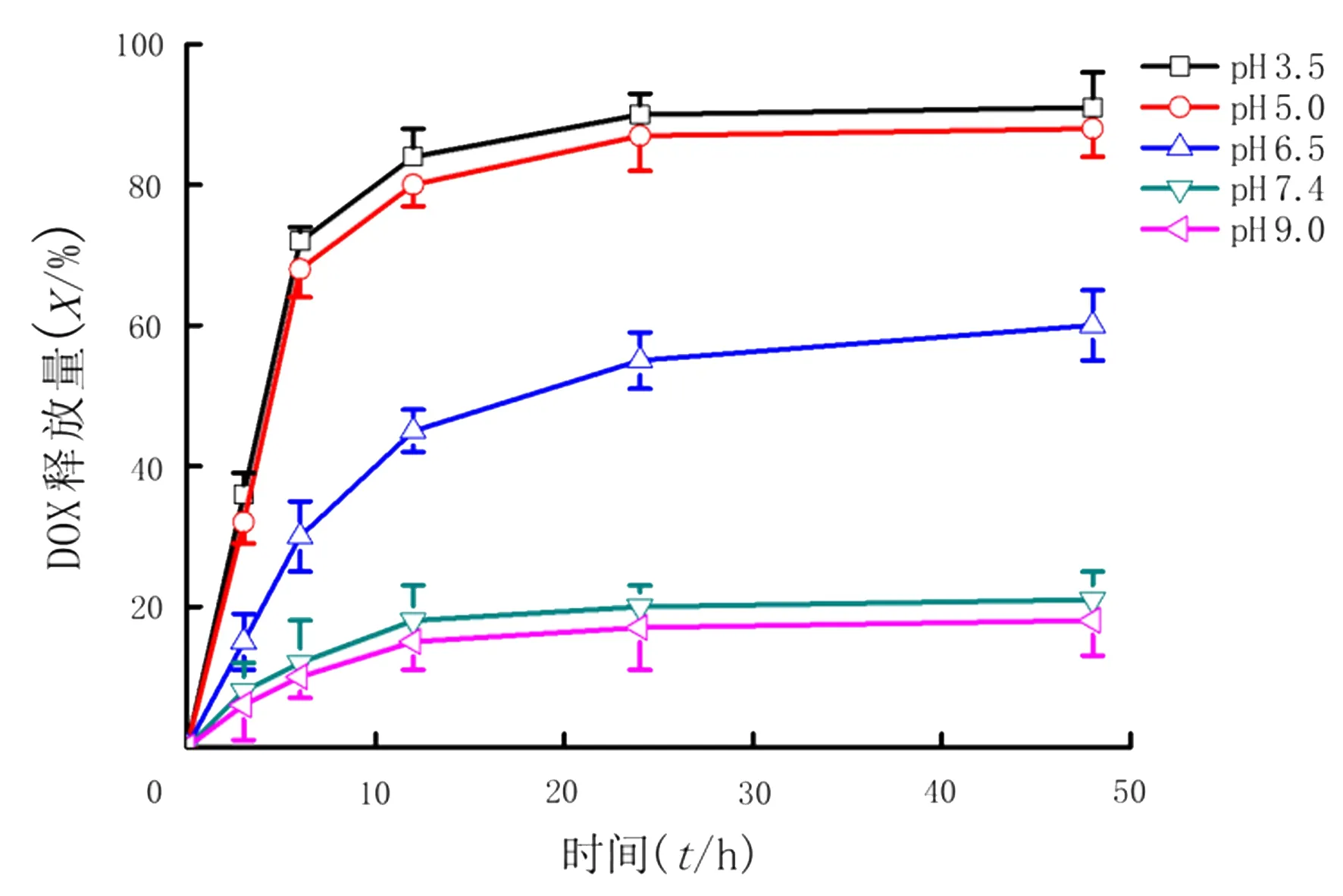
图4 不同pH值情况下DOX在Au-BSA-DOX-FA中的释放情况
2.4 Au-BSA的细胞毒性
MTT实验测定显示,随着Au-BSA浓度的提高,HaLa细胞、MCF-7细胞和HSF细胞的细胞活力未受到明显抑制(图5a~c),说明Au-BSA具有良好的生物相容性。
2.5 Au-BSA-DOX-FA对Hela细胞靶向杀伤作用
随着DOX浓度的升高,HeLa和MCF-7细胞活力呈下降趋势。从细胞活力的变化曲线可以看出,在对HeLa细胞的干预中,用Au-BSA-DOX-FA干预的HeLa细胞的活力低于DOX(t=26.0,P<0.05);而两者对MCF-7细胞的杀伤作用差异无显著性(P>0.05);采用Au-BSA-DOX-FA干预的HSF细胞活力高于DOX(t=26.5,P<0.05)。见图6a~c。
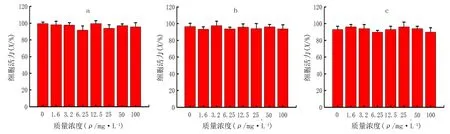
a、b、c分别为HaLa细胞、MCF-7细胞、HSF细胞。
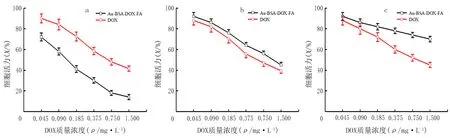
a、b、c分别为HaLa细胞、MCF-7细胞、HSF细胞。
3 讨 论
本研究所用Au-BSA是以BSA[11]为模板,用抗坏血酸还原氯金酸得到的[12],合成过程简洁快速,无有毒物质产生,从而保证所合成的Au-BSA具有良好的生物相容性,MTT实验结果也证明了这一点。有研究表明,粒径在10~200 nm间的纳米颗粒有利于在体内的长期循环和肿瘤靶向治疗[13]。本研究所制备粒径为50 nm的花状Au-BSA,与其研究结果相符合。
人体正常组织和血液的pH值为7.4,而肿瘤组织部位的pH值比正常组织低[14],这就为利用pH控制药物释放提供了条件[15]。顺乌头酸酐是一种酸性敏感键,在中性和碱性环境下稳定,在酸性环境下易断裂[16-17]。有研究将DOX利用顺乌头酸酐连接到一种树枝状大分子上形成聚合物,这种聚合物可以在酸性条件下缓慢释放DOX,而在中性条件下则能稳定存在[18]。缓释药物则能保证药物浓度稳定在较高浓度,从而提高药物的生物利用率。本研究中,DOX标准曲线说明,在0~60 mg/L范围内,DOX的浓度与吸光度(A)值有良好的线性关系[19],因此通过测定吸光度(A)来计算溶液中DOX的浓度。Au-BSA-DOX-FA在pH为3.5以及5.0时可以释放出90%的DOX,且释放过程在12 h内持续完成,在pH为6.5时约释放出60%的DOX,而在中性(pH 7.4)以及碱性(pH 9.0)环境中很少释放出DOX,总释放量仅为DOX总量的20%左右。DOX从复合物中的快速释放是由于顺乌头酸酐的作用,顺乌头酸酐作为DOX与Au-BSA的连接物,在pH小于6.0时极易断裂,从而使DOX从复合物中释放出来。有研究表明,pH敏感的DOX释放与酸性条件下的游离羧基有关[20]。所以,pH敏感的DOX释放效果表明,Au-BSA-FA-DOX复合物在循环系统中会稳定存在而在肿瘤部位的酸性环境中就会释放DOX[21]。
HeLa细胞表面FR过量表达,极易与FA靶向抗肿瘤药物结合,从而有利于药物发挥生物学效应[22]。Au-BSA-DOX-FA与DOX对癌细胞的杀伤效果比较显示,由于HeLa细胞表面大量FR的存在,Au-BSA-DOX-FA能够靶向地与HeLa细胞结合并在周围释放结合在复合物中的DOX,而单纯使用DOX干预则没有靶向聚集功能,所以Au-BSA-DOX-FA对HeLa细胞的杀伤效果优于单纯使用DOX的杀伤效果。MCF-7细胞表面FR低表达,Au-BSA-DOX-FA对其无靶向功能[23],所以其与DOX的杀伤效果无明显的差异。在Au-BSA-DOX-FA对MCF-7的杀伤效果中,Au-BSA-DOX-FA的效果略低于单纯使用DOX的杀伤效果,可能是因为复合物中释放的DOX的量低于直接加入DOX的量,在无靶向聚集的条件下,治疗效果与DOX浓度相对应。在Au-BSA-DOX-FA对HSF的杀伤效果中,HSF细胞为正常组织细胞,表面FR低表达且周围环境为弱碱性,Au-BSA-DOX-FA对其无靶向功能[24],且不会因为顺乌头酸酐键断裂而释放出DOX,因此Au-BSA-DOX-FA对HSF细胞杀伤作用显著弱于单纯使用DOX的杀伤作用。
综上所述,本研究以牛血清白蛋白为模板合成了一种生物相容性良好的Au-BSA,并将其作为FA靶向的药物载体负载DOX组成了Au-BSA-DOX-FA,用于对FR高表达的HeLa细胞的杀伤作用研究。该复合物对表面FR过量表达的HeLa细胞有较好的杀伤作用。本研究只是进行了细胞水平的研究,该复合物在个体水平对肿瘤的治疗效果如何,还需要进一步的动物实验加以验证。
[参考文献]
[1] 李宁,于力方,王珊,等. 阿霉素纳米粒在肿瘤治疗中的应用研究[J]. 现代生物医学进展, 2012, (30):5836-5837,5867.
[2] LIPSHULTZ S E, GRENIER M A, COLAN S D. Doxorubicin-induced cardiomyopathy[J]. N EnglJ Med. 1999,340(8):653-654.
[3] SHENG Z, HU D, ZHENG M, et al. Smart human serum albumin-indocyanine green nanoparticles generated by programmed assembly for dual-modal imaging-guided cancer sy-nergistic phototherapy[J]. ACS Nano, 2014,8(12):12310-12322.
[4] BAJAJ A, MIRANDA O R, KIM I B, et al. Detection and differentiation of normal, cancerous, and metastatic cells using nanoparticle-polymer sensor arrays[J]. Proc Natl Acad Sci U S A, 2009,106(27):10912-10916.
[5] XIAO Y, HONG H, MATSON V Z, et al. Gold nanorods conjugated with doxorubicin and cRGD for combined anticancer drug delivery and PET imaging[J]. Theranostics, 2012,2(8):757-768.
[6] 王冬,于旭红,沙杭. 叶酸的临床应用现状[J]. 中国临床药理学杂志, 2016(19):1813-1816,1820.
[7] LU Y, LOW P S. Folate-mediated delivery of macromolecular anticancer therapeutic agents[J]. Adv Drug Deliv Rev, 2012,64(5):675-693.
[8] ARONOV O, HOROWITZ A T, GABIZON A, et al. Folate-targeted PEG as a potential carrier for carboplatin analogs. Synthesis and in vitro studies[J]. Bioconjug Chem, 2003,14(3):563-574.
[9] MASTERS J R. HeLa cells 50 years on: The good, the bad and the ugly[J]. Nat Rev Cancer, 2002,2(4):315-319.
[10] CHUNG K N, SAIKAWA Y, PAIK T H, et al. Stable transfectants of human MCF-7 breast cancer cells with increased levels of the human folate receptor exhibit an increased sensitivity to antifolates[J]. J Clin Invest, 1993,91(4):1289-1294.
[11] ZHANG C, FU Y Y, ZHANG X, et al. BSA-directed synthesis of CuS nanoparticles as a biocompatible photothermal agent for tumor ablation in vivo[J]. Dalton Trans, 2015,44(29):13112-13118.
[12] GUÉVEL X L, HÖTZER B, JUNG G, et al. Formation of fluorescent metal (Au, Ag) nanoclusters capped in bovine se-rum albumin followed by fluorescence and spectroscopy[J]. J of Phys Chem C, 2011,115(22):10955-10963.
[13] NIIKURA K, IYO N, MATSUO Y, et al. Sub-100 nm gold nanoparticle vesicles as a drug delivery carrier enabling rapid drug release upon light irradiation[J]. ACS Appl Mater Interfaces, 2013,5(9):3900-3907.
[14] MANCHUN S, DASS C R, SRIAMORNSAK P. Targeted therapy for cancer using pH-responsive nanocarrier systems[J]. Life Sci, 2012,90(11-12):381-387.
[15] WEN S, LIU H, CAI H, et al. Targeted and pH-responsive delivery of doxorubicin to cancer cells using multifunctional dendrimer-modified multi-walled carbon nanotubes[J]. Adv Healthc Mater, 2013,2(9):1267-1276.
[16] XIA F, HOU W, ZHANG C, et al. pH-responsive gold nanoclusters-based nanoprobes for lung cancer targeted near-infrared fluorescence imaging and chemo-photodynamic therapy[J]. Acta Biomater, 2018,68:308-319.
[17] 魏伟,邓吉喆,李方实,等. pH响应型mPEG-PCL嵌段共聚物胶束用作药物运输[J]. 精细化工, 2013,30(3):253-258,280.
[18] ZHU S J, QIAN L L, HONG M H, et al. RGD-modified PEG-PAMAM-DOX conjugate: In vitro and in vivo targeting to both tumor neovascular endothelial cells and tumor cells[J]. Adv Mater, 2011,23(12): H84-89.
[19] 陈大中,高洁,解方园,等. 共载阿霉素和依克立达的PLGA纳米粒的制备及表征[J]. 药学实践杂志, 2017, (3):219-223,251.
[20] DU C, DENG D, SHAN L, et al. A pH-sensitive doxorubicin prodrug based on folate-conjugated BSA for tumor-targeted drug delivery[J]. Biomaterials, 2013,34(12):3087-3097.
[21] KOSHKARYEV A, SAWANT R, DESHPANDE M, et al. Immunoconjugates and long circulating systems: Origins, current state of the art and future directions[J]. Adv Drug Deliv Rev, 2013,65(1):24-35.
[22] 李东红,刁俊林,刘建仓,等. 光敏剂叶酸-卟啉对宫颈癌HeLa细胞的靶向性和光动力活性[J]. 中国激光医学杂志, 2010, (5):273-277,336.
[23] FENG D, SONG Y, SHI W, et al. Distinguishing folate-receptor-positive cells from folate-receptor-negative cells using a fluorescence off-on nanoprobe[J]. Anal Chem, 2013,85(13):6530-6535.
[24] 胡丰,唐宁宁,刘灿,等. 以叶酸耦联纳米Fe3O4颗粒的合成和标记肿瘤实验研究[J]. 激光生物学报, 2014, (3):211-217.

