小鼠骨髓间充质干细胞自噬与衰老的关系
孙志敏,张铮,文童,张丽娟,杨超,柳彦君,胡桃红
(1.锦州医科大学火箭军总医院研究生培养基地,辽宁 锦州 121000;2.中国人民解放军火箭军总医院 心血管内科,北京 100088;3.中国人民解放军火箭军总医院输血科,北京 100088)
近年来研究发现,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)具有自我更新和多向分化的潜能,也具有组织修复和抑制自身免疫的潜在可能性,是自身干细胞治疗理想的种子细胞[1-2]。而老年患者自身的BM-MSCs也处于衰老状态下,移植入组织后活力及增殖能力下降,严重限制了临床疗效。因此,明确BM-MSCs衰老损伤的机制,是提高自体干细胞疗效的关键问题。衰老是生物体内损伤的分子﹑细胞﹑组织不断积聚,导致生物体功能减退和细胞正常生理功能改变的过程[3]。前期研究证实,自噬通过清除细胞内受损的细胞器和错误折叠或聚集的蛋白质等,来维持细胞功能,并参与细胞衰老过程[4]。本实验探讨衰老细胞中自噬水平的变化及其相关机制。
1 材料与方法
1.1 主要试剂与仪器
C57/6健康小鼠(第四军医大学动物实验中心),胎牛血清﹑α-DMEM培养基购自美国Hyclone公司,淋巴细胞分离液(上海化学试剂二厂),胰蛋白酶﹑LC3抗体购自美国Sigma公司,鼠抗p62﹑Beclin-1抗体﹑β-actin抗体购自英国Abcam公司,p-Akt抗体(美国CST公司),血管内皮生长因子(vascular endothe growth factor, VEGF)ELISA试剂盒﹑碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)ELISA试剂盒﹑胰岛素样生长因子-1(insulin-like growth factor, IGF-1)ELISA试剂盒﹑肝细胞生长因子(hepatocyte growth factor, HGF)ELISA试剂盒购自美国R&D公司,GFP-LC3质粒(美国Invivogen公司),X-treme GENEHP DNA转染试剂﹑脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Terminal deoxynucleotidly transferase mediated dUTP nick end labeling, TUNEL)细胞凋亡检测试剂盒购自美国罗氏公司,Akt活性检测试剂盒(美国Bio Vision公司),酶联免疫检测仪(美国BIO-TEK公司),BX50型显微镜(日本Olympus公司),Nikon A1 激光共聚焦显微镜(日本尼康公司),流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 小鼠BM-MSCs的分离和培养 年轻小鼠(8周龄)和老年小鼠(18个月龄)麻醉脱颈椎处死后,在无菌状态下分离其股骨和胫骨。用磷酸盐缓冲液(phosphate buffered saline, PBS)冲出骨髓,比重1.077的淋巴细胞分离液作梯度离心(2 000 r/min离心30min),收集单个核细胞,PBS洗涤,将含10%胎牛血清的α-DMEM培养基放入培养皿,在5%二氧化碳CO2﹑37℃孵箱中培养。换液1次/3 d。待细胞融合接近80%,用0.25%胰蛋白酶(0.1 ml/cm2)消化2~3min,将细胞以1×104个/ml传代。采用第3代细胞进行实验。
1.2.2 流式细胞仪 取第3代小鼠BM-MSCs,胰酶消化3min,离心后PBS洗涤重悬2次,细胞以1.5×106个/ml接种于4个1.5 ml EP管中,分别加入抗小鼠CD31﹑CD45﹑CD90﹑CD29,置于4℃冰箱,避光孵育30min,PBS洗涤后用流式细胞仪检测﹑分析。
1.2.3 TUNEL细胞凋亡检测 在预置玻片的24孔板上按3×104个/ml培养两组BM-MSCs,PBS清洗。按分组情况,用含10%胎牛血清的α-DMEM培养基培养24 h,加终端转移酶和荧光素标记的dUTP,37℃孵育45min。PBS洗涤细胞3次后,加入DAPI染色识别细胞核,PBS洗涤细胞3次后,用Nikon A1激光共聚焦显微镜观察染色结果。TUNEL标记阳性(绿色荧光)的细胞为凋亡细胞。凋亡细胞的百分比作为凋亡指数。所有操作在暗室中完成。
1.2.4 ELISA 培养两组 BM-MSCs 6×106个 /ml,PBS清洗。按分组情况,用含10%胎牛血清的α-DMEM培养基培养24 h,提取细胞上清液,0.22μm滤器抽滤,按照VEGF﹑bFGF﹑IGF-1﹑HGF蛋白ELISA试剂盒说明书进行操作。
1.2.5 Western blot检测 按分组情况,培养BMMSCs 5×106个/ml。4℃条件下冰上裂解细胞5min。裂解液包含TBS﹑Triton-X100破膜(1 mm,美国Sigma公司)﹑4%丙三醇﹑二乙胺四乙酸(1 mm,美国Sigma公司)和蛋白酶抑制剂PMSF(1 mm,美国Roche Molecular Biochemicals公司),12 000 r/min离心10min后提取蛋白液。两组分别取50μg蛋白样品,12% SDS-PAGE凝胶电泳90min﹑120 V,转至硝酸纤维素薄膜300 mA﹑40min,蛋白膜在封闭液中封闭60min。分别添加兔抗鼠LC-3抗体(1∶500)﹑Akt抗体(1∶500),p-Akt抗体(1∶500)﹑β-actin抗体(1∶2000)抗体,4℃孵育过夜。PBS洗膜,用辣根过氧化物酶标记羊抗兔IgG(1∶200),室温孵育90min,洗膜,采用ECL试剂按步骤检测蛋白表达,Image-Pro Plus 6.0.1软件分析各条带吸光度值作定量分析。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠BM-MSCs表型比较
流式细胞术检测显示,年轻组和老年组BMMSCs均为CD31﹑CD45阴性,而CD90和CD29表达阳性,提示两组BM-MSCs细胞表型无明显差异。见图 1﹑2。
2.2 两组细胞凋亡率比较
年轻组和老年组BM-MSCs经TUNEL和DAPI染色的免疫荧光检测图见图3。年轻组BM-MSCs细胞凋 亡率为(12.583±1.212)%,老 年组为(37.831±3.432)%,经t检验,差异有统计学意义(t=9.128,P=0.000),老年组BM-MSCs细胞凋亡率高于年轻组(见图4)。
2.3 BM-MSCs分泌蛋白VEGF、bFGF、IGF-1、HGF水平
年 轻 组 BM-MSCs分 泌 VEGF﹑bFGF﹑IGF-1﹑HGF 分 别 为(424.545±88.735)﹑(14.587±4.413)﹑(36.334±2.952)和(15.335±5.915)pg/ml,老年组BM-MSCs分泌 VEGF﹑bFGF﹑IGF-1﹑HGF分别为(335.737±65.574)﹑(8.132±2.248)﹑(28.764±4.252)和(9.723±1.835)pg/ml,经t检验,差异有统计学意义(t=2.673﹑4.423﹑3.273和2.867,P=0.014﹑0.000﹑0.014和0.010),老年组分泌蛋白水平均低于年轻组。见图5。
2.4 BM-MSCs自噬相关蛋白LC3-Ⅰ/LC3-Ⅱ、Beclin 1、ATG12-5、p62的表达
年轻组小鼠BM-MSCs的LC3-Ⅰ/LC3-Ⅱ﹑Bclin 1﹑ATG12-5﹑p62蛋 白 相 对 表 达 量 分 别为(0.68±0.13)﹑(1.16±0.12)﹑(1.12±0.12) 和(1.01±0.11),老年组小鼠 BM-MSCs的 LC3-Ⅰ /LC3-Ⅱ﹑Bclin 1﹑ATG12-5﹑p62蛋白相对表达量分别 为(0.32±0.02)﹑(0.41±0.09)﹑(0.30±0.04) 和(2.67±0.31),经t检验,差异有统计学意义(t=4.985﹑9.315﹑11.38 和 8.794,P=0.007﹑0.007﹑0.003 和 0.001),老年组自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ﹑Bclin1﹑ATG12-5表达水平低于年轻组,p62表达水平高于年轻组。见图6﹑7。
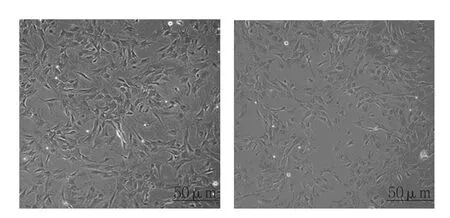
图1 第3周两组小鼠BM-MSCs细胞形态 (光镜)
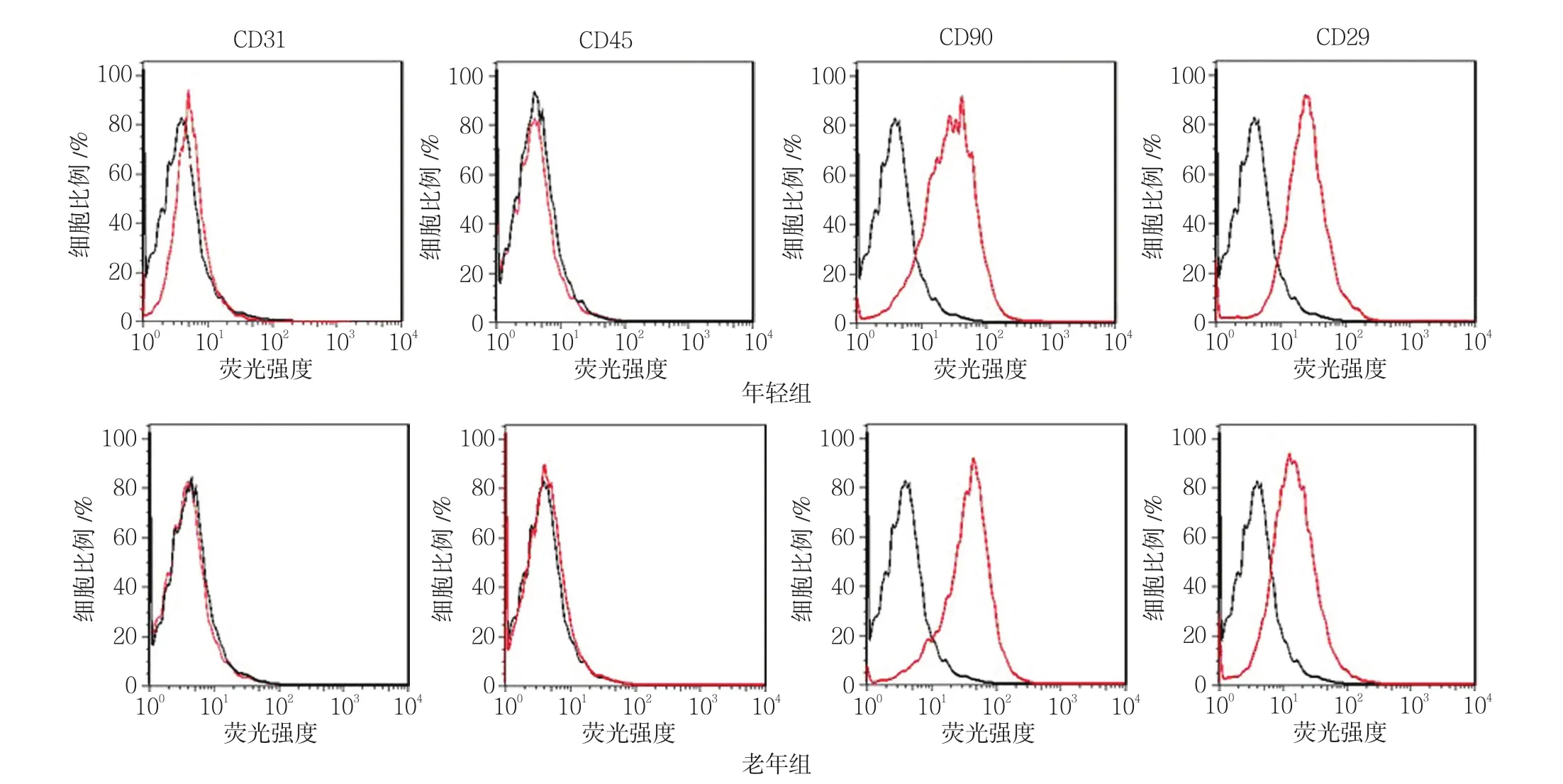
图2 两组小鼠BM-MSCs细胞表型
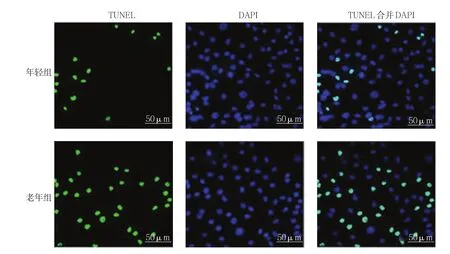
图3 BM-MSCs自噬相关免疫荧光
2.5 BM-MSCs自噬调节通路蛋白p-Akt、Akt、p-mTOR、mTOR的表达
Western blot检测结果表明,年轻组与老年组BM-MSCs中Akt和mTOR无差异,而老年组p-Akt和p-mTOR蛋白表达水平高于年轻组(见图8)。年轻组和老年组的p-Akt/Akt蛋白相对表达量分别(0.25±0.05)和(0.51±0.09),经t检验,差异有统计学意义(t=5.647,P=0.000),老年组高于年轻组。年轻组和老年组的p-mTOR/mTOR蛋白相对表达量分别(0.14±0.02)和(0.27±0.03),经t检验,差异有统计学意义(t=8.062,P=0.000),老年组高于年轻组(见图9)。
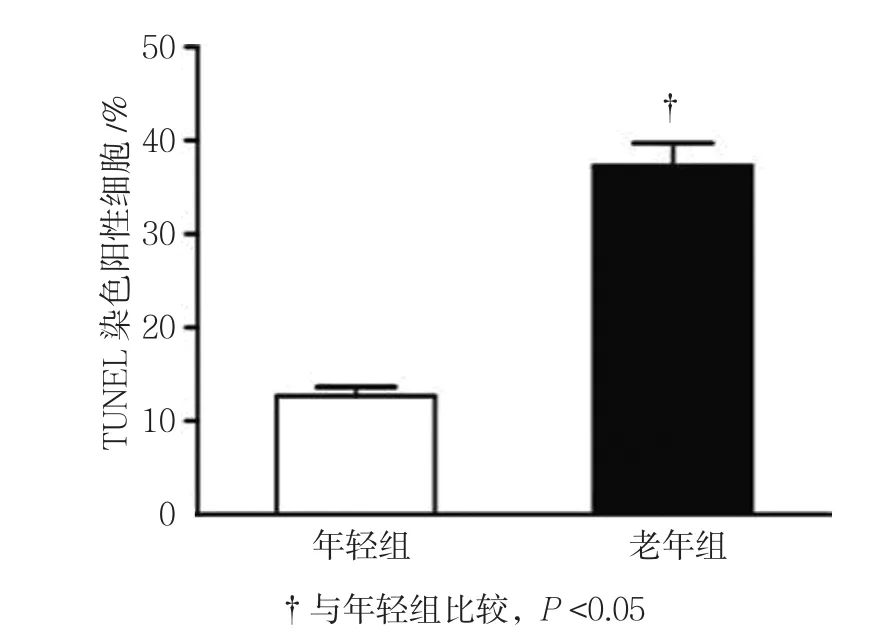
图4 两组小鼠BM-MSCs细胞凋亡率比较 (±s)
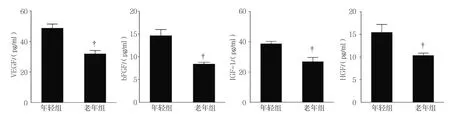
图5 两组小鼠BM-MSCs分泌蛋白VEGF、bFGF、IGF-1、HGF水平比较 (±s)
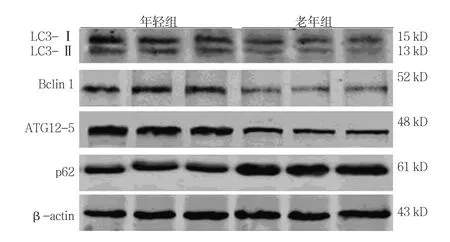
图6 BM-MSCs自噬相关蛋白的表达
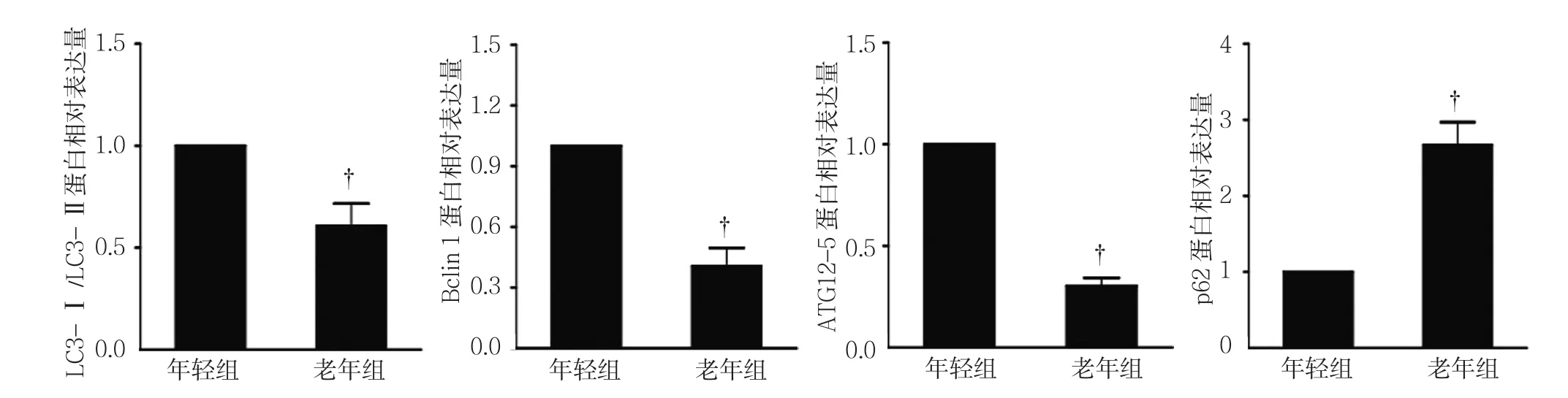
图7 两组小鼠BM-MSCs自噬相关蛋白表达水平比较 (±s)
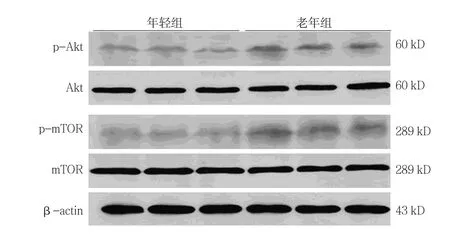
图8 BM-MSCs自噬调节通路蛋白的表达
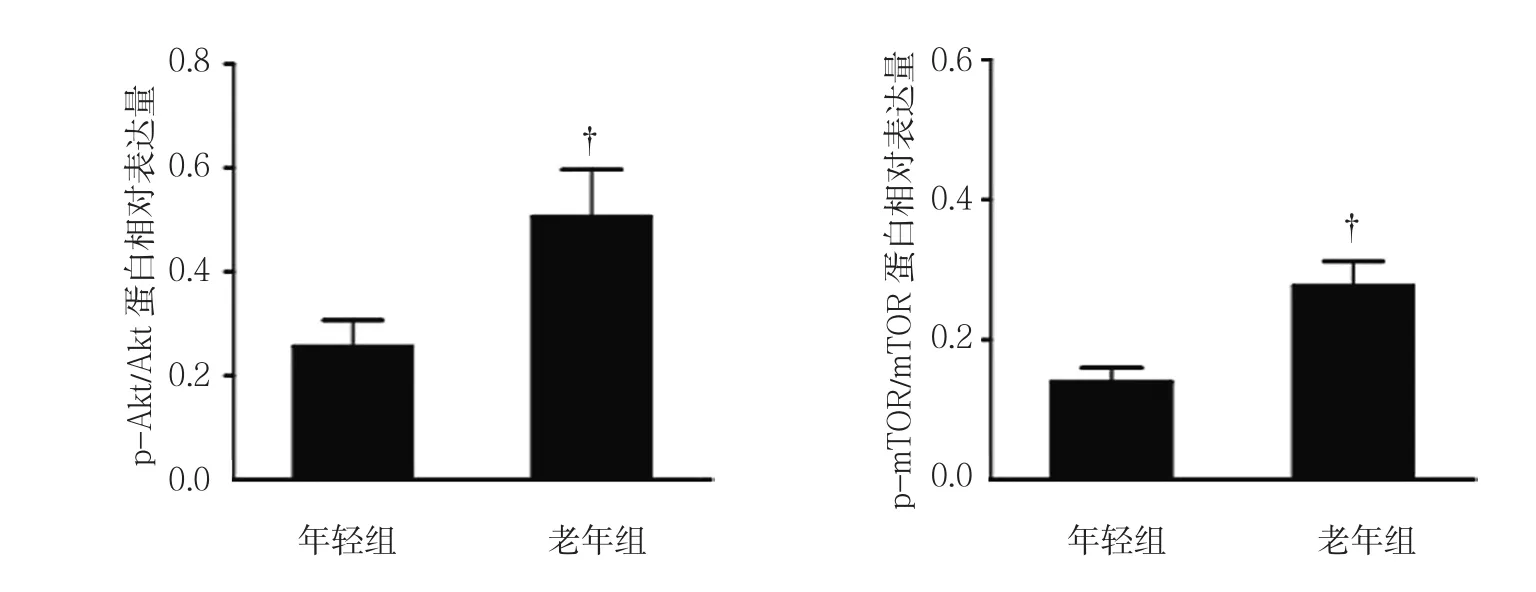
图9 两组小鼠自噬调节通路蛋白表达水平比较 (±s)
3 讨论
缺血性心脏病是临床上死亡率较高的一种疾病[5]。自体干细胞移植是一种新的治疗缺血性心脏病的方法[6],但是干细胞移植入组织后活力及增殖能力下降是治疗中遇到的最主要问题。BM-MSCs具有较强的多向分化和自我更新潜能[7],可以通过旁分泌作用改善梗死的心肌组织[8],是治疗缺血性心脏病的一种理想种子干细胞。缺血性心脏病多见于老年患者,用于自体移植治疗的BM-MSCs同样处于衰老状态。本实验前期研究证实,衰老的BM-MSCs移植入心肌组织后,活力及增殖能力明显下降,疗效不理想[9]。因此,探究BM-MSCs衰老过程中活力及增殖能力下降的机制,是提高其疗效的关键。
自噬是一种高度保守的生理过程,广泛存在于大部分真核细胞中[10]。自噬在细胞中具有双刃剑的作用[11]。在生理条件下,细胞自噬水平较低,通过清除细胞内功能受损的细胞器和错误折叠的蛋白质来维持细胞的正常生理功能。但是在应激条件下,如细胞能量缺失﹑缺血等,细胞自噬水平明显增高,过度降解细胞自身成分,从而导致细胞损伤[12]。在细胞衰老的过程中,自噬也发挥一定作用。自噬的过程复杂,可分为启动﹑形成和降解再利用3部分。启动阶段是由mTOR相关靶点诱导,在自噬相关基因(ATG)蛋白的协同下,形成弧形凹陷的双层膜结构,即自噬前体。然后自噬前体识别并包裹细胞内功能受损的细胞器和错误折叠的蛋白质,双层膜结构逐渐延伸直至融合,形成完全包裹细胞内物质的自噬体。自噬体形成后,与溶酶体融合,形成自噬溶酶体,自噬体内层膜及细胞内物质最终被降解,降解产物进入胞浆进行再利用[13-15]。LC-3和Beclin 1是自噬发生和形成过程中重要的自噬相关分子,Beclin 1能够聚集自噬体,并且在自噬的过程中起正调控作用[16]。在动物细胞自噬的过程中,p62是一种普遍表达的蛋白质,可与前自噬体膜LC-3相互作用,并在Atg12-5的参与下形成自噬体,自噬体在溶酶体的作用下降解,因此p62的水平与自噬呈负相关[17-19]。本研究中利用Western blot检测自噬相关的蛋白,结果提示衰老BM-MSCs中LC3-Ⅰ﹑LC3-Ⅱ﹑Beclin 1﹑ATG12-5表达减少,而p62表达增多。提示衰老BM-MSCs自噬水平下调,与前期研究结果一致。
衰老是生物体内受损和有缺陷的细胞不断进行积累,造成生物体功能的衰退和器官老化的过程[5]。本实验TUNEL结果提示,老年组细胞凋亡较年轻组增加,提示衰老可以增加BM-MSCs的细胞凋亡。前期研究结果表明,在整个衰老过程中,自噬相关蛋白及自噬活性均有所下降,提示自噬的水平可能与衰老损伤有关。BM-MSCs可以分泌多种细胞因子,如VEGF﹑bFGF﹑IGF-1﹑HGF[20],但是衰老对BMMSCs旁分泌作用的影响及机制仍不是很明确。本实验通过ELISA检测BM-MSCs分泌细胞因子的能力,结果发现老年组BM-MSCs中VEGF﹑bFGF﹑IGF-1﹑HFG的分泌量较年轻组下降,提示衰老BM-MSCs旁分泌功能受损。上述结果说明,在衰老过程中,BMMSCs凋亡增加,自噬水平及旁分泌功能下降。
许多研究指出,自噬过程调节的一条重要途径是Akt-mTOR途径[21]。其中Akt又称为蛋白激酶B,是一种丝氨酸/苏氨酸蛋白激酶。mTOR是一类大分子蛋白,也是调控细胞生长﹑增殖及自噬的重要信号通路。mTOR有mTORC1和mTORC2 2种复合物形式,其中调节细胞增殖﹑凋亡及自噬等的主要是mTORC1。在细胞因子的作用下,Akt活化后将信号下传至mTOR,活化后的mTOR激活其下游的相关因子,促进细胞蛋白质合成﹑增殖及生长,加速细胞代谢,抑制细胞的自噬作用[14-15]。在本实验中衰老组BMMSCs中p-Akt﹑Akt﹑p-mTOR﹑mTOR表达减少,细胞凋亡增加。
通过实验笔者对自噬和衰老的分子机制及相互作用有进一步的认识。实验结果表明,老年组BMMSCs细胞凋亡增加,分泌蛋白功能减弱,自噬及自噬相关蛋白水平下降,p-Akt﹑Akt﹑p-mTOR﹑mTOR蛋白表达增加。衰老是细胞自噬增加的一个影响因素,自噬增加又能够引起衰老。
参 考 文 献:
[1]ORLIC D, KAJSTURA J, CHIMENTI S, et al. Bone marrow cells regenerate infarcted myocardium[J]. Nature, 2001, 410(6829):701-705.
[2]WANG Y, CHEN X D, CAO W, et al. Plasticity of mesenchymal stem cells in immunomodulation:pathological and therapeutic implications[J]. Nat Immunol, 2014, 15(11): 1009-1016.
[3]SALMINEN A, KAARNIRANTA K. Regulation of aging process by autophagy[J]. Trends Mol Med, 2009, 15(5): 217-224.
[4]WU X, WON H, RUBINSZTEIN D C. Autophagy and mammalian development[J]. Biochem Soc Trans, 2013, 41(6): 1489-1494.
[5]ROGER V L, JACOBSEN S J, WESTON S A, et al. Trends in the incidence and survival of patients with hospitalized myocardial infarction[J]. Ann Intern Med, 136(5): 341-348.
[6]MOHAMED S A, HANKE T, ERASMI A W, et al. Mitochondrial DNA deletions and the aging heart[J]. Exp Gerontol, 2006, 41(5):508-517.
[7]PITTENGER M F, MACKAY A M, BECK S C, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science1999,284(5411): 143-147.
[8]AL-KHALDI A, AL-SABTI H, GALIPEAU J, et al. Therapeutic angiogenesis using autologous bone marrow stromal cells:improved blood fl ow in a chronic limb ischemia model[J]. Ann Thorac Surg,2003, 75(1): 204-209.
[9]CAO F, SUN D, LI C, et al. Long-term myocardial functional improvement after autologous bone marrow mononulclear cells transplantation in patients with ST-segment elevation myocardial infarction: 4 years follow-up[J]. Eur Heart, 2009, 30(16): 1986-1994.
[10]KLIONSKY D J, EMR S D. Autophagy as a regulated pathway of cellular degradation[J]. Sience, 2000, 290(5497): 1717-1721.
[11]YAMAMOTO S, KAZAMA J J, FUKAGAWA M. Autophagy: a two-edged sword in diabetes mellitus[J]. Biochem, 2013, 456(3):1-3.
[12]MAZURE N M, POUYSSEGUR J. Hypoxia-induced autophagy:cell death or cell survival[J]. Curr Opin Cell Biol, 2010, 22(2):177-180.
[13]SALMINEN A, KAARNIRANTA K. AMP-activated protein kinase (AMPK) controls the aging process via an integrated signaling network[J]. Ageing Res Rev, 2012, 11(2): 230-241.
[14]WEICHHART T. Mammalian target of rapamycin: a signaling kinase for every aspect of cellular life[J]. Methods Mol Biol,2012, 821: 1-14.
[15]INOKI K, KIM J, GUAN K L. AMPK and mTOR in cellular energy homeostasis and drug targets[J]. Annu Rev Pharmacol Toxicol, 2012, 52: 381-400.
[16]FURUYA T, KIM M, LIPINSKI M, et al. Negative regulation of Vps34 by Cdk mediated phosphorylation[J]. Mol Cell, 2010,38(4): 500-511
[17]JOHANSEN T, LAMARK T. Selective autophagy mediated by autophagic adapter proteins[J]. Autophagy, 2011, 7(3): 279-296.
[18]KOMATSU M, WAGURI S, KOIKE M, et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice[J]. Cell, 2007, 131(6): 1149-1163.
[19]MIZUSHIMA N, KUMA A, KOBAYASHI Y, et al. Mouse Apg16L, a novel WD-repeat protein, targets to the autophagic isolation membrane with the Apg12-Apg5 conjugate[J]. Cell Sci,2003, 116(Pt9): 1679-1688.
[20]HARE J M, TRAVERSE J H, HENRY T D, et al. A randomized,double-blind, placebo-controlled, dose-escalation study of intravenous adult human mesenchymal stem cells (prochymal)after acute myocardial infarction[J]. Am Coll Cardiol, 2009,54(24): 2277-2286.
[21]FRANK T F, HORNIK C P, SEGEV L, et al. PI3K/Akt and apoptosis: size matters[J]. Oncogene, 2003, 22(56): 8983-8998.

