分选卵巢癌腹水中癌细胞的实验研究*
邢宝玲,郭存存,唐正华,董一善,葛素梅
(南京医科大学附属常州市妇幼保健院1.病理科,2.妇科,江苏 常州 213003)
卵巢癌是死亡率最高的妇科肿瘤,>75%卵巢癌发现时已是进展期,腹腔液中是否有癌细胞对判断卵巢癌分期﹑制定治疗方案及监测复发有重要价值[1-2]。目前,检测腹水中恶性细胞主要依靠光镜下的细胞识别和免疫细胞化学技术,当细胞量少时,易出现漏诊或过诊断,而且不能分离癌细胞,以检测生物学特性[3]。本研究采用磁激活细胞分选法(magnetic activated cell sorting, MACS)富集腹水中的卵巢癌细胞,用免疫荧光细胞化学法(Immunocytochemistry, ICC)联合荧光原位杂交法(fluorescence in situ hybridization, FISH)识别癌细胞,旨在探讨新方法对精准分离恶性腹水中癌细胞的可行性。
1 材料与方法
1.1 材料与试剂
10%胎牛血清(fetal bovine serum, FBS)(美国Gibco公司),RPMI 1640(美国Hyclone公司),CD326磁珠分选试剂盒(德国美天旎公司),EpCAM荧光抗体(EBA-1)(美国BD公司),8号染色体探针(chromosome enumeration probe 8, CEP8)(美国雅培公司),线粒体绿色荧光探针(Mito-Tracker Green)(英国Shandon公司),卵巢癌SKOV3细胞(上海诺辰生物公司),7周龄雌性BALB/c裸鼠(常州卡文斯实验动物公司)。
1.2 仪器与设备
细胞培养箱(英国Thermo公司),光学显微镜XDS-1A(上海精美仪器公司),倒置显微镜IX71(日本Olympus公司),低速离心机TDZ4B-WS(上海卢湘仪离心机仪器公司),共聚焦显微镜(德国Leica公司)。
1.3 体外卵巢癌腹水模型的复制
1.3.1 细胞培养 SKOV3细胞在含有10% FBS的RPMI 1640培养基,37℃﹑5%二氧化碳CO2的饱和湿度恒温培养箱中培养。
1.3.2 Mito-Tracker Green标记SKOV3细胞 用细胞培养液稀释Mito-Tracker Green至终浓度为100 nmol/L,加入培养的细胞中,37℃条件下孵育45min,形成Mito-Tracker-Green-SKOV3细胞,去除Mito-Tracker Green染色工作液,加入37℃预温育的新鲜细胞培养液。
1.3.3 体外卵巢癌腹水模型 收集江苏省常州市妇幼保健院子宫平滑肌瘤患者的腹腔冲洗液,将Mito-Tracker-Green-SKOV3细胞浓度调整为1×104个/ml,取100μl细胞悬液加入96孔板,经反复稀释并计数后,加入腹腔冲洗液中,将阳性组按加入细胞数目的不同分为A﹑B﹑C﹑D组,同时设立阴性对照组(见表1),每组样本制备3份。
1.4 卵巢癌裸鼠原位移植模型的复制
1.4.1 分组 15只7周龄雌性BALB/c裸鼠在无特定病原体环境下饲养。阳性组和阴性对照组各6只,分别在卵巢注射SKOV3细胞悬液后4﹑6和8周各处死2只;空白对照组3只,不做处理,分别在4﹑6和8周各处死1只。
1.4.2 卵巢癌裸鼠原位移植模型的复制 乙醚麻醉裸鼠后,从背部开口,找到左侧卵巢。阳性组用微量注射器向卵巢内接种2μl SKOV3细胞悬液(浓度1×107个/ml);阴性对照组注射2μl RPMI 1640培养基,缝合背部伤口,正常饲养。
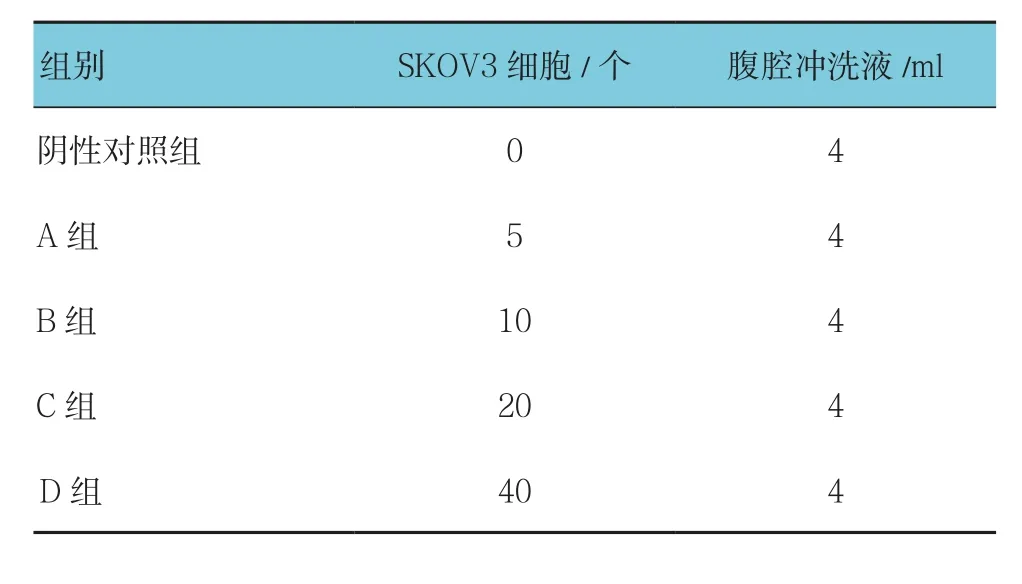
表1 体外卵巢癌腹水模型
1.4.3 腹水收集 水合氯醛麻醉裸鼠后,打开腹腔,收集腹水;无腹水者收集0.9%生理盐水的腹腔冲洗液2ml。
1.5 MACS技术富集腹腔液或腹水的SKOV3细胞
采用MACS技术富集腹腔液或腹水的SKOV3细胞。离心腹腔液或腹水,取细胞5×107个,加入100μl FcR封闭液后混匀,加入100μl CD326磁珠,混匀后4℃条件下放置30min,洗涤﹑离心后用500μl缓冲液重悬细胞。将细胞悬液加入磁力架的MS分选柱中,待细胞悬液流净后用缓冲液洗涤柱子,将MS分选柱从磁力架中取出,放置于收集管中,用适量的缓冲液将柱子上标记的CD326细胞洗涤下来,再次洗涤﹑离心后用50μl缓冲液重悬,涂片。
1.6 ICC-FISH
1.6.1 涂片固定 室温下丙酮固定细胞涂片10min,晾干。
1.6.2 ICC 涂片上加藻红蛋白(Phycoerythrin, PE)标记的EBA-1抗体,4℃过夜,4℃条件下磷酸盐缓冲溶液(phosphate buffer saline, PBS)洗涤3次,0.1%Triton室温作用5min,PBS室温洗涤3次,70%﹑85%和100%冰冷酒精梯度脱水,在甲醇﹑冰醋酸(比例3∶1)液中固定10min,蒸馏水冲洗。4℃条件下用1%多聚甲醛(2×SSC缓冲液,pH 7.6)固定10min,蒸馏水冲洗,70%﹑85%和100%冰冷酒精梯度脱水,晾干。
1.6.3 FISH 将橙色荧光标记的CEP8 1μl﹑双蒸水2μl及Buffer 7μl混匀,将10μl探针液加于涂片的待杂交区,盖上盖玻片封片,放于72℃水浴锅8min,然后置于37℃的湿盒16 h。
1.6.4 洗片 去除盖玻片,将涂片置于65℃的0.4×SSC缓冲液或0.3%吐温中洗涤2min,再置于室温2×SSC缓冲液或0.1%吐温中洗涤1min,风干。
1.6.5 复染 涂片上滴加10μl 4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)于杂交区,15min后在激光扫描共聚焦显微下观察。
2 结果
2.1 体外卵巢癌腹水模型的检测结果
阴性对照组和阳性组可见EBA-1阳性细胞,D组EBA-1阳性细胞数量最多。阴性对照组无Mito-Tracker Green阳性细胞,阳性组均见Mito-Tracker Green阳性细胞,随着各组癌细胞数量增多,Mito-Tracker Green阳性细胞数量呈增多趋势,共计73个。按公式:回收率=Mito-Tracker Green阳性细胞数/SKOV3细胞数,计算各样本SKOV3细胞的回收率为20%~50%。以CEP8>2个为FISH阳性标准,规定DAPI+/EBA-1+/Mito-Tracker Green+/CEP8+细胞为癌细胞,阴性对照组和1个A组(5个癌细胞)样本为FISH阴性,其他阳性组均见FISH阳性细胞,共69个,比Mito-Tracker Green阳性细胞少4个,4个未检测到的细胞中,1个细胞见2个着丝粒,1个细胞见1个着丝粒,2个细胞的荧光信号模糊不清,无法判读。按公式:检测率=FISH阳性细胞/Mito-Tracker Green阳性细胞,12个SKOV3细胞阳性样本中有9个样本的检测率为100%。见表2。
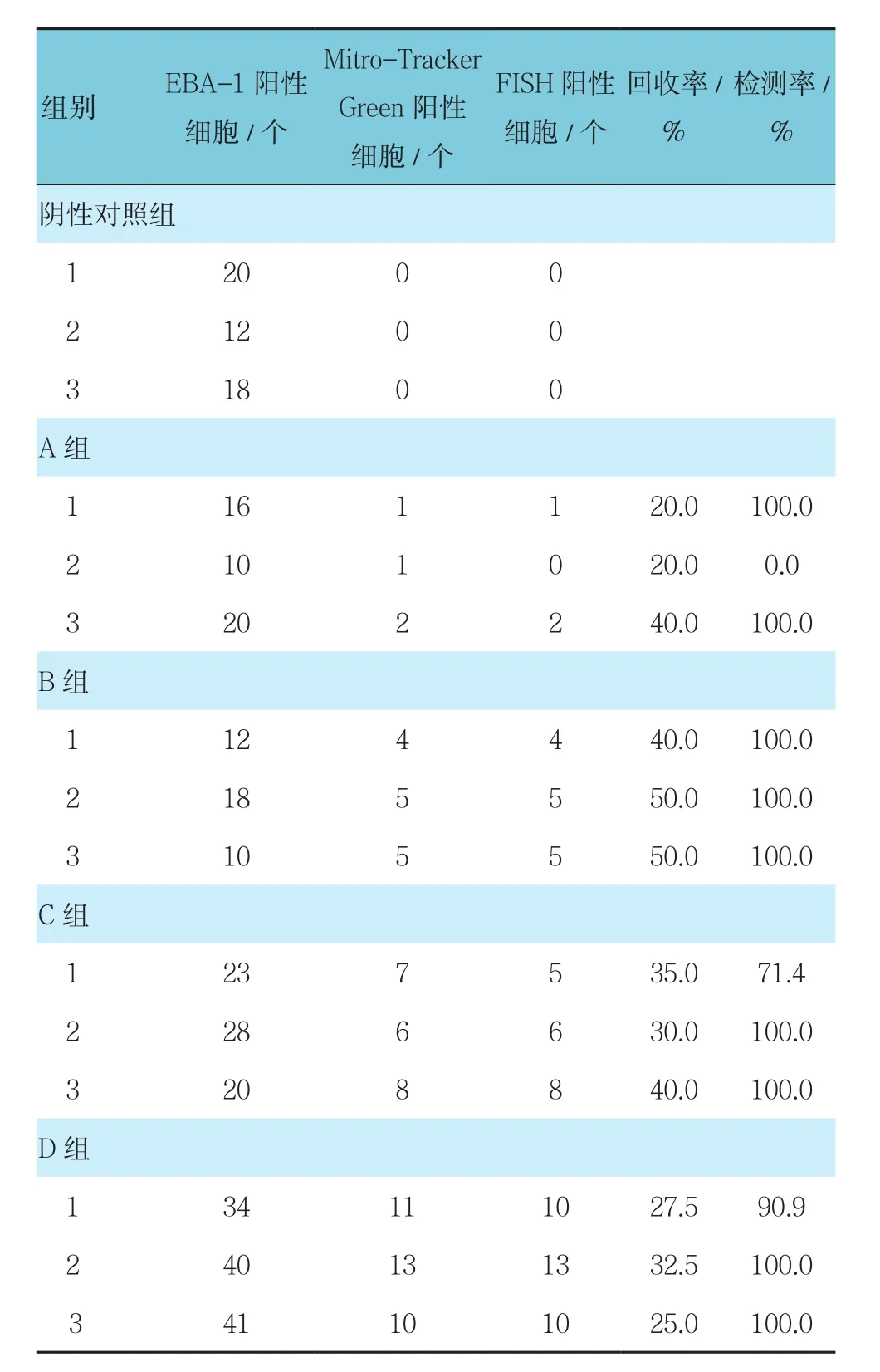
表2 卵巢癌腹水模型的检测结果
以D组为例,在涂片上可见单个和簇状排列的细胞,簇状细胞的荧光信号较弱,而单个细胞的荧光信号较强,Mito-Tracker Green阳性细胞为单个排列的细胞,即SKOV3细胞,其DAPI和EBA-1-PE染色均为阳性,且多数细胞有≥3个8号染色体着丝粒信号。Mito-Tracker green阴性细胞多数呈簇状排列,DAPI和EBA-1-PE染色为阳性,一般可见2个8号染色体着丝粒信号,被判读为良性上皮细胞。见图1。
大多数Mito-Tracker Green阳性的SKOV3细胞有≥3个8号染色体着丝粒信号,但有1个SKOV3细胞仅见1个信号,另1个细胞见2个信号。见图2。
2.2 卵巢癌裸鼠原位移植模型的检测结果
阳性组裸鼠注射SKOV3细胞4周后腹部增大,收集到2 ml血性浑浊腹水。随着饲养时间延长,阳性组裸鼠腹围不断增大,逐渐消瘦,6周收集的腹水量3.5~4.0 ml,8周收集的腹水量约5 ml左右。阴性对照组裸鼠与空白对照组裸鼠一样,生长良好,无腹水,以2 ml腹腔冲洗液替代腹水。
随着实验时间延长,阳性组裸鼠腹水中的细胞总数不断增多,分离出的SKOV3细胞数量也逐渐增多。在显微镜下,4﹑6和8周每个视野的SKOV3细胞数最多分别为3﹑8和15个。阴性对照组和空白对照组未分选出CD326和EBA-1阳性细胞。见图3。
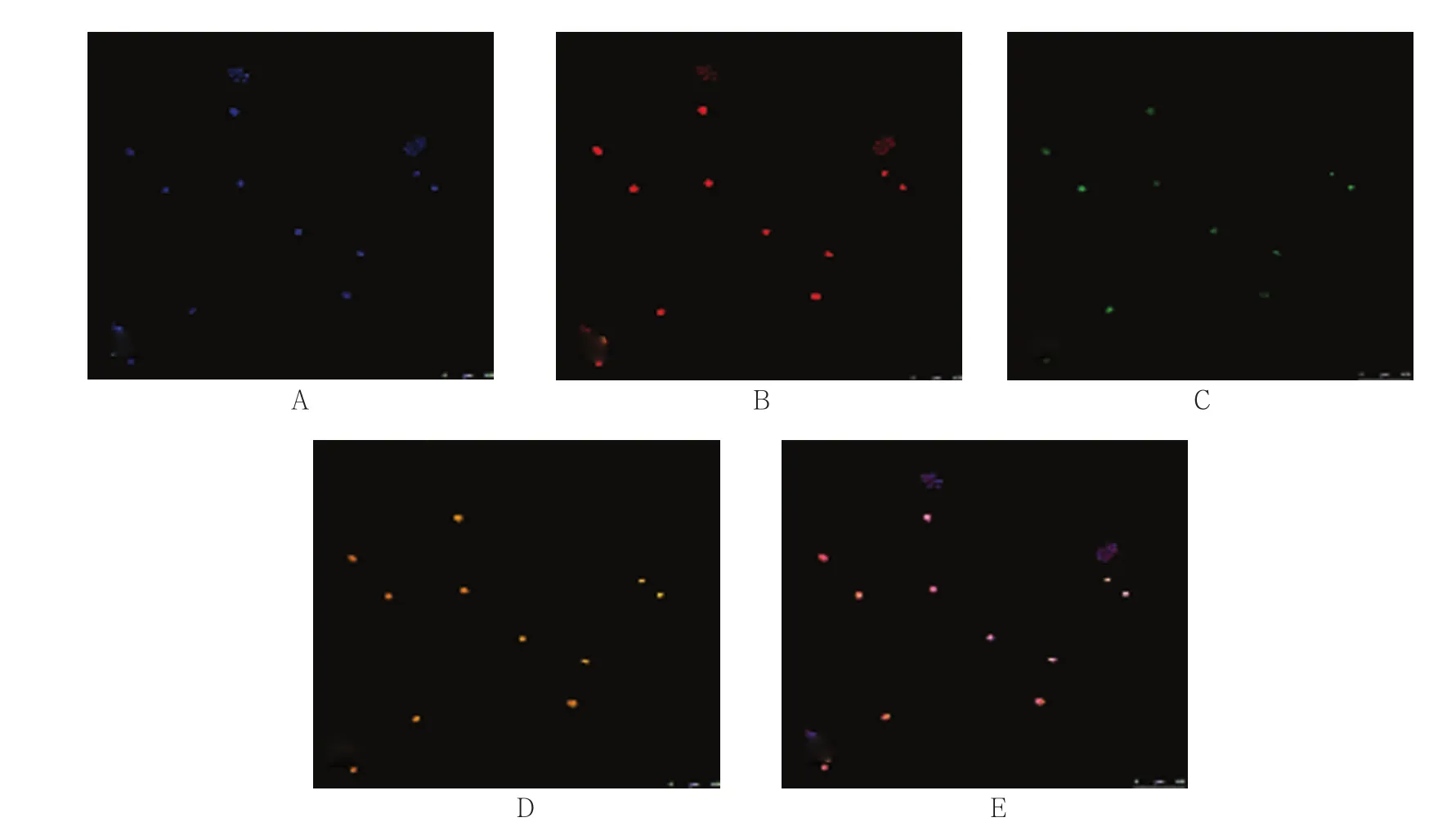
图1 D组的SKOV3细胞 (ICC-FISH×100)
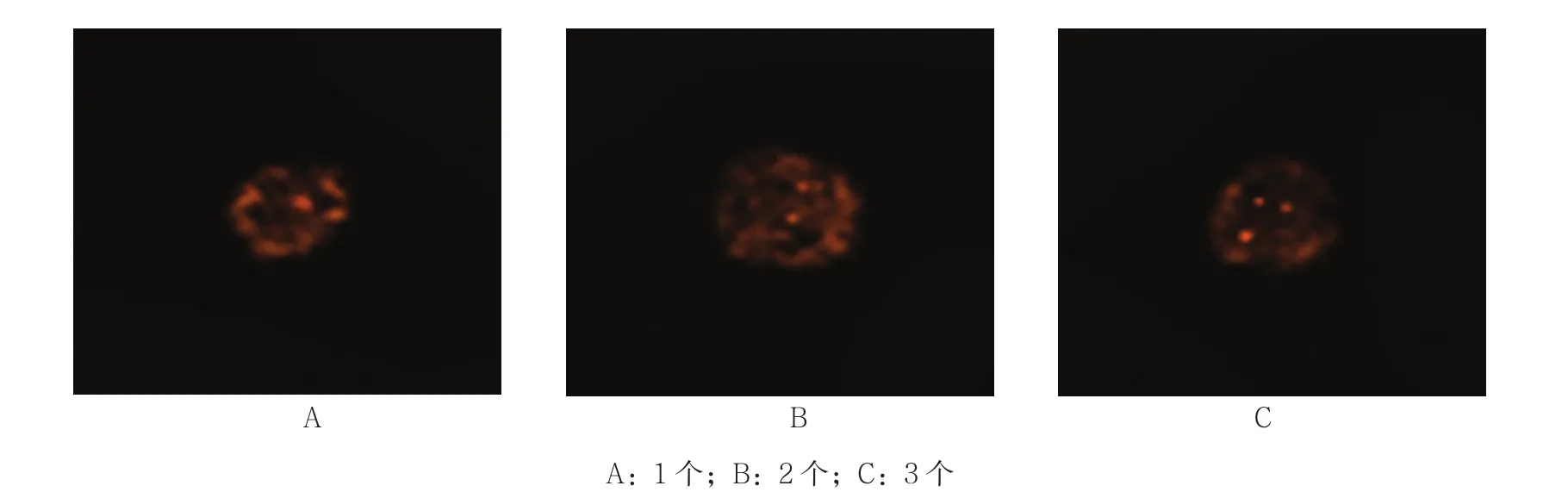
图2 SKOV3细胞8号染色体着丝粒信号 (ICC-FISH×400)

图3 卵巢癌裸鼠原位移植模型腹水中的SKOV3细胞 (ICC-FISH×200)
3 讨论
迄今为止,尚无行之有效方法可降低卵巢癌﹑输卵管癌﹑腹膜癌的致死率。卵巢癌被发现时,往往已形成较大肿块或处于进展期,盆腹腔内除肉眼可见的转移灶外,还会有广泛的微转移,这些病灶不可能被切除,致使2~3年后疾病复发,故需要更详尽地了解卵巢癌种植转移情况。卵巢癌的发生﹑发展具有复杂的遗传学及微环境因素。卵巢癌起源于输卵管伞端的脱落上皮细胞或癌细胞,与大多数其他实体瘤不同,卵巢癌较少血行转移,多数为腹腔种植转移。其腹腔种植的早期事件是在蛋白酶的介导下,单个癌细胞或细胞球脱离进入腹腔,黏附于间皮被覆的腹膜或器官,扎根于间皮下基质并形成继发性肿瘤。卵巢癌播散性转移与腹水的产生密切相关,腹水的微环境有利于单个或簇状癌细胞的种植转移[4],而种植转移直接影响患者的死亡率。所以,腹腔液是研究卵巢癌及其微环境的良好取材来源,可以提供癌细胞及其他细胞,以了解卵巢癌转移过程中的细胞分子改变[5]。
液体活检是一种新型的无创检测技术,是通过采集患者的体液对体内肿瘤进行检测的方法,在科研和临床上广泛用于检测外周循环血癌细胞的数量及其分子病理特征,其包括分离富集﹑分析检测2个步骤。分离富集通常基于癌细胞的物理性质(密度和大小)或免疫学特征(分子特征),包括梯度离心法﹑过滤法﹑免疫磁性分选法等;分析检测可分为细胞计数法和核酸检测法,如免疫细胞化学法﹑逆转录聚合酶链反应等[6]。已经有一些学者用免疫磁珠富集胸腹水中的癌细胞[7-8]。KIMURA等[7]用CD45+免疫磁珠负分选卵巢癌腹水后,用FACS鉴定分选后的癌细胞纯度,然后用纯化的癌细胞提取癌细胞溶解产物,以制备肿瘤特异性疫苗。HUANG等[8]用Immunomagnetic Flow系统检测外周血中游离叶酸受体和叶酸受体阳性的癌细胞,证明该系统可以用于检测卵巢癌腹水中的叶酸受体阳性细胞。伴随着组织学分析﹑重要生物学检测等发展,从体液中分选细胞的关键挑战不再是分选效率,而是目的细胞的高纯度[9]。纯度好的癌细胞被分离后,可精确了解癌细胞的生物学特性及治疗变化等。AHMED等[10]分离了未化疗卵巢癌和复发后化疗耐药患者的腹水癌细胞,用蛋白组学技术识别到癌细胞上的353种蛋白,发现这两组细胞在免疫监视﹑DNA修复机制﹑细胞骨架重排﹑细胞间黏附﹑细胞周期﹑细胞运输等的蛋白编码上有很大的不同;其路径分析显示,耐药癌细胞具有丰富的新陈代谢途径﹑DNA修复机制及能量代谢途径。
文献报道EpCAM在87%~100%的癌性腹水中表达,高表达EpCAM的癌细胞是化疗耐药细胞,这些细胞是化疗后复发的根源,与患者预后差相关[11]。CD326和EBA-1都是EpCAM的单克隆抗体。根据癌性腹水或腹腔冲洗液量多的特点,本实验采用MACS技术,用CD326免疫磁珠进行正分选,除去腹水中的炎症细胞﹑间皮细胞及纤维细胞等,使CD326阳性细胞富集,以适用于后继的纯化或鉴定过程。既往实验显示,恶性腹腔液正分选后的液体中既有良性的上皮细胞又有癌细胞[3]。因此识别肿瘤相关上皮性抗原的技术不能精确地鉴定分离腹腔液中的癌细胞,而文献报道卵巢癌频繁出现8号染色体多倍体[12],针对以上特点,本实验选择ICC-FISH来区分癌细胞与良性上皮细胞。实验结果显示,阴性组和阳性组均有EBA-1阳性而Mito-Tracker Green无着色的细胞,再次验证腹水中存在较多的良性上皮细胞,这些上皮细胞黏附性好,在涂片上主要呈簇状排列,Mito-Tracker Green着色的SKOV3细胞主要呈分散单个排列。以观察到的Mito-Tracker Green标记细胞为准,SKOV3细胞的回收率为20%~50%,为提高癌细胞的回收率,实验使SKOV3细胞与CD326免疫磁珠充分混匀孵育,并控制进入MS柱子的细胞的浓度,务必使连接了癌细胞的免疫磁珠与柱子充分结合,以提高正分选的效率。可能在磁珠富集和后续鉴定操作过程中的细胞损失太多,也可能是正常上皮细胞对少量癌细胞的干扰太大,所以本实验难以像分选外周血循环细胞一样回收到仅1个癌细胞[12-14]。FISH检测结果显示,大多数SKOV3细胞有3个CEP8信号,仅少数细胞可见1或2个CEP8信号,9/12个SKOV3细胞阳性样本的检测率为100%,说明用FISH检测多倍体细胞来识别卵巢癌细胞是可行的。但是,如果用既表达EpCAM抗原,且CEP8>2的标准来鉴定癌性腹水富集液,可能会导致癌细胞的遗漏。另外,EpCAM抗体不能捕获或检测到发生上皮间质转化的癌细胞,这种癌细胞最易从癌灶脱落进入腹腔或脉管,所以应设计对卵巢癌腹水更特异的免疫磁珠或荧光抗体,如选用CD45+免疫磁珠进行负分选,根据不同卵巢癌的特征搭配叶酸受体﹑P53﹑Pax8等抗体进行特异的癌细胞分选。
卵巢癌裸鼠原位模型复制了卵巢癌的发生﹑发展过程,其恶性腹水的产生也经历了从无到有,到量多的过程。由于卵巢癌患者早期无明显症状,本实验选择裸鼠腹围出现肉眼可见的增大时开始收集腹水。实验证明,ICC-FISH在腹水中癌细胞量少或量多时都能可靠地分离出癌细胞,与分离循环血癌细胞相似[12]。
与腹腔镜下活检相比,从腹水或腹腔冲洗液中分离并检测癌细胞,损伤小﹑可重复,腹水中的癌细胞有上皮样表型,也有发生上皮间质转化的表型,这些细胞高表达肿瘤干细胞标志物,具有强大的自我更新﹑转移和肿瘤形成能力[15],分离腹水中的癌细胞可以实时了解肿瘤的生物学特性,从而更有机会辨识和确定药物治疗靶点及预后标志物[16]。本实验结果证明,将恶性腹水磁富集后,ICC-FISH可以稳定﹑敏感地分离其中的少量癌细胞,该方法为卵巢癌的早期发现﹑监测复发及指导治疗提供新思路。
参 考 文 献:
[1]ZEPPERNICK F, MEINHOLD-HEERLEIN I. The new FIGO staging system for ovarian, fallopian tube, and primary peritoneal cancer[J]. Arch Gynecol Obstet, 2014, 290(5): 839-842.
[2]HOHN A K, EINENKEL J, WITTEKIND C, et al. New FIGO classification of ovarian, fallopian tube, and primary peritoneal cancer[J]. Pathologe, 2014, 35(4): 322-326.
[3]邢宝玲, 葛素梅, 焦练, 等. 细胞量少的卵巢癌腹腔液漏诊和过度诊断的实验分析[J]. 临床与实验病理学杂志, 2016, 32(11):1199-1203.
[4]MO L, BACHELDER R E, KENNEDY M, et al. Syngeneic murine ovarian cancer model reveals that ascites enriches for ovarian cancer stem-like cells expressing membrane GRP78[J]. 2015,14(3): 747-756.
[5]LENGYEL E, BURDETTE J E, KENNY H A, et al. Epithelial ovarian cancer experimental models[J]. Oncogene, 2014, 33(28):3619-3633.
[6]PAOLETTI C, HAYES D F. Circulating tumor cells[J]. Adv Exp Med Biol, 2016, 882: 235-258.
[7]KIMURA Y, HARADA Y, YASUDA N, et al. Effective recovery of highly purified CD326 (+) tumor cells from lavage fl uid of patients treated with a novel cell-free and concentrated ascites reinfusion therapy (KM-CART)[J]. Springerplus, 2015, 17, 4: 780.
[8]HUANG W, CHANG C L, CHAN B D, et al. Concurrent detection of cellular and molecular cancer markers using an immunomagnetic fl ow system[J]. Anal Chem, 2015, 87(20): 10205-10212.
[9]PLOUFFE B D, MURTHY S K. Perspective on microf l uidic cell separation: a solved problem[J]. Anal Chem, 2014, 86(23): 11481-11488.
[10]AHMED N, GREENING D, SAMARDZIJA C, et al. Unique proteome signature of post-chemotherapy ovarian cancer ascitesderived tumor cells[J]. Sci Rep, 2016, 6: 30061.
[11]TAYAMA S, MOTOHARA T, NARANTUYA D, et al. The impact of EpCAM expression on response to chemotherapy and clinical outcomes in patients with epithelial ovarian cancer[J]. Oncotarget,2017, 8(27): 44312-44325.
[12]张玉娟, 崔巍. 循环肿瘤细胞检测的方法学建立和改良及在实体瘤中的监测应用研究[D]. 北京: 北京协和医学院, 2014.
[13]MASARRU W, MASAKUNI S, TAKESHI S, et al. A novel fl ow cytometry-based cell capture platform for the detection, capture and molecular characterization of rare tumor cells in blood[J].Translational medicine, 2014, 12: 143-154.
[14]LEE M, KIM E J, CHO Y, et al. Predictive value of circulating tumor cells (CTCs) captured by microfluidic device in patients with epithelial ovarian cancer[J]. Gynecol Oncol, 2017, 145(2):361-365.
[15]KIM S, KIM B, SONG Y S, et al. Ascites modulates cancer cell behavior, contributing to tumor heterogeneity in ovarian cancer[J]. Cancer Sci, 2016, 107(9): 1173-1178.
[16]KIPPS E, TAN D S, KAYE S B. Meeting the challenge of ascites in ovarian cancer: new avenues for therapy and research[J]. Nat Rev Cancer, 2013, 13(4): 273-282.

