MicroRNA-153对脑膜瘤细胞放疗敏感性的影响*
刘义锋,张保朝,温昌明,闻公灵,周国平,张敬伟,贺海发,汪宁,李巍
(1.郑州大学附属南阳中心医院 神经内科,河南 南阳 473003;2.郑州大学附属南阳中心医院 神经外科,河南 南阳 473003;3.郑州大学附属南阳中心医院 肿瘤内科,河南南阳 473003;4.郑州大学附属南阳中心医院 病理科,河南 南阳 473003;5.沈阳军区总医院 神经内科,辽宁 沈阳 110016)
脑膜瘤是常见的颅内肿瘤之一,其发病率占颅内肿瘤的13%~26%,仅次于神经胶质瘤[1]。部分早期文献报道,放射治疗对脑膜瘤的敏感性较低[2]。但是放射治疗已成为一种重要的治疗脑膜瘤的方法。
目前,microRNA(miRNA)在脑膜瘤中的研究较少,可能与其为良性肿瘤有关。有研究报道,miR-200a可以通过调控E-cadherin和Wnt/β-catenin信号通路,促进脑膜瘤肿瘤细胞的生长[3]。本文主要研究miR-153在脑膜瘤细胞放疗敏感性中的作用及其机制,为研究脑膜瘤的放射治疗提供理论基础。
1 材料与方法
1.1 实验材料
人类恶性脑膜瘤细胞系SF3061为本实验室保存细胞株,DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),miR-153mimics﹑miR-control购自广州锐博生物科技有限公司,双荧光素酶报告基因检测试剂盒(美国Promega公司),视网膜母细胞瘤蛋白结合锌指1(retinoblastoma protein-interacting zinc finger 1, RIZ1)抗体﹑β-actin抗体及酶标二抗购自美国Cell Signaling Technology公司,si-RIZ1及sicontrol﹑Lipofectamine 2000转染试剂盒﹑逆转录试剂盒﹑SYBR®Premix Ex TaqTMⅡ购自美国Introvigen公司,医用直线加速器(德国Siemens公司),流式细胞仪(美国BD公司),其他常用试剂购自上海生工生物工程有限公司。
1.2 方法
1.2.1 细胞培养 将液氮中冻存的SF3061细胞复苏,在5%二氧化碳CO2﹑37℃及饱和湿度条件下的DMEM培养液(含10%胎牛血清﹑2μmol/L L-谷氨酰胺﹑50 IU/ml青霉素)中培养。
1.2.2 细胞转染 取对数生长期的细胞,以2×105个/孔的密度接种于6孔板,所用培养液不含抗生素,在5% CO2﹑37℃恒温细胞培养箱中进行培养。待细胞融合达70%~80%时,按照Lipofectamine 2000转染试剂盒说明书进行转染,分别将miR-153mimics﹑miR-control﹑si-RIZ1及si-control转染到细胞中。转染48 h后,收集细胞用于后续实验。
1.2.3 细胞辐射 在细胞转染或药物处理48后,使用直线加速器6 MeV-X射线垂直照射细胞,实验过程中使用射线防护铅屏风保护工作人员避免辐射损伤,辐射剂量分别为0﹑2﹑4﹑6和8 Gy,检测凋亡的细胞辐射量为4 Gy,照射后细胞继续培养48 h,用于后续实验。
1.2.4 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR) 将照射处理后的细胞常规培养,当融合率达70%~80%时,收集细胞,用miRNA抽提试剂盒提取细胞中的miRNA。用逆转录试剂盒将miRNA转化成cDNA,加入SYBR®Premix Ex TaqTMⅡ,以U6为内参进行qRT-PCR扩增,miRNA的相对表达量用2-△△Ct分析。
1.2.5 Western blot检测 将照射处理后的细胞消化并离心收集,加入RIPA使细胞裂解,超声破碎后离心收集蛋白,用BCA试剂盒测定总蛋白浓度。每个样本取50μg进行8%或12% SDS-PAGE电泳,将分离后的蛋白进行转膜,5%脱脂奶粉室温封闭1h后,加入RIZ1一抗,4℃孵育过夜,TBST洗膜3次,加入辣根过氧化酶标记的二抗,37℃孵育1 h。ECL显影检测蛋白表达。
1.2.6 MTT法 将照射处理后的细胞进行消化,以2×105个/孔的密度接种于96孔板中,37℃﹑5%CO2﹑完全湿度条件下培养48 h,加入10μl MTT溶液,孵育4 h后,弃掉培养液,加入150μl/孔MTT溶液,震荡摇匀后,酶标仪检测490 nm处的光密度(optical density, OD)值,细胞的增殖抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%。
1.2.7 流式细胞仪 将待测细胞使用4 Gy的放射线剂量进行照射,照射后48 h收集细胞,放射处理后将细胞消化计数并接种到6孔板中,PBS清洗3次,使用500μl Binding buffer重悬细胞,调整细胞浓度为1×105个/孔,各孔加入5 μl Annexin V-FITC和5μl PI混匀,室温避光孵育15min,上流式细胞仪检测细胞凋亡率。
1.2.8 克隆形成实验 分别以0﹑2﹑4﹑6﹑8和10 Gy剂量照射细胞后,将各组单细胞悬液接种到6孔板中,于37℃﹑5%CO2培养箱中继续培养10~14 d。PBS清洗3次,甲醇固定后,用吉姆萨染色,于显微镜下进行集落计数(<50个细胞的集落为有效集落),计算克隆形成率,并根据单击多靶模型拟合细胞存活曲线。
1.2.9 双荧光素酶报告实验 将含有miR-153结合位点的PRDM2 3’-UTR序列及其突变体插入pMIRREPORT载体荧光素酶报告基因下游,分别得到含野生型RIZ1 3’-UTR的载体,命名为WT-3’-UTR;含突变型RIZ1 3’-UTR的载体,命名为MUT-3’-UTR。将构建好的质粒分别与miR-153 mimics﹑miR-control共转染SF3061细胞,继续培养48 h后,使用双荧光素酶报告基因检测试剂盒检测细胞荧光素酶活性。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 放疗对脑膜瘤细胞内miR-153表达的影响
本实验以4 Gy的放射量对脑膜瘤细胞进行放疗,利用qRT-PCR检测放疗前后细胞内miR-153表达水平的变化。mRNA定量检测结果表明,与对照组相比,放疗组miR-153相对表达水平为(0.45±0.05),经t检验,差异有统计学意义(t=8.590,P=0.007),放疗组miR-153的表达水平低于对照组。见图1。
2.2 高表达miR-153对脑膜瘤细胞放疗敏感性的影响
本实验将miR-153mimics及其对照miR-control转染到脑膜瘤细胞中,观察高表达miR-153在脑膜瘤细胞放疗敏感性中的作用。对照组﹑miR-control组﹑miR-153mimics组在2﹑4﹑6﹑8和10 Gy放射剂量下细胞的增殖抑制率比较,经单因素方差分析,差异有统计学意义(F=35.325﹑91.020﹑85.868﹑136.220和73.608,P=0.001﹑0.000﹑0.000﹑0.000和 0.000),放疗后高表达miR-153可以增加脑膜瘤细胞的增殖抑制率。见表1和图2。
流式细胞仪检测结果表明,放疗后对照组﹑miR-control组﹑miR-153mimics组脑膜瘤细胞的凋亡率 分 别 为(16.79±2.16)%﹑(19.85±2.36)% 和(35.75±4.45)%,经单因素方差分析,差异有统计学意义(F=5.956,P=0.0.006),高表达miR-153脑膜瘤细胞的凋亡率高于对照组和miR-control组。见表1和图3。
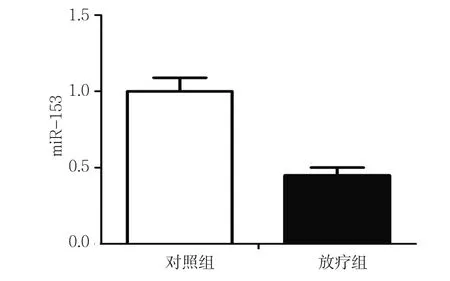
图1 放疗前后脑膜瘤细胞中miR-153的表达水平比较(±s)

表1 高表达miR-153克隆形成实验单击多靶模型的参数

图2 高表达miR-153对脑膜瘤细胞增殖的影响
对照组与miR-153mimics组在2﹑4﹑6﹑8和10 Gy放射剂量下的细胞克隆形成率比较,经t检验,差异有统计学意义(t=8.004﹑12.713﹑ 12.068﹑14.751和10.063,均P=0.000),高表达miR-153细胞放疗后克隆形成率较对照组降低。对克隆形成实验数据进行曲线拟合,发现高表达miR-153细胞具有较高的放疗增敏性。见表1和图4。
2.3 miR-153靶向RIZ1
本实验利用TargetScan预测miR-153的靶基因,结果发现RIZ1的基因PRDM2 3’-UTR与miR-153可能有相互作用。见图5。
Western blot检测结果表明,miR-control组﹑miR-153mimics组RIZ1蛋白相对表达量分别为(2.71± 0.23)和(0.41±0.03),经t检验,差异有统计学意义(t=17.175,P=0.000),在高表达miR-153细胞中,RIZ1的表达降低。见图6。
双荧光素酶报告基因实验结果显示,共转染miR-153mimics的RIZ1野生型﹑RIZ1突变型细胞相对荧光素酶活性分别为(0.43±0.05)和(1.12±0.09),经t检验,差异有统计学意义(t=11.608,P=0.000),共转染RIZ1野生型细胞的荧光素酶活性低于共转染RIZ1突变型细胞,证实RIZ1为miR-153的靶标,其在脑膜瘤放疗敏感性中发挥重要作用。见图7。
2.4 基因敲除RIZ1对脑膜瘤细胞放疗敏感性的影响
通过TargetScan预测及双荧光素酶报告基因证实miR-153能够直接靶向RIZ1。本实验进一步探索miR-153是否通过靶向RIZ1而增加脑膜瘤细胞的放疗敏感性。首先利用基因敲除技术将RIZ1基因沉默,再检测RIZ1沉默后细胞的增殖﹑凋亡及克隆形成情况。对照组﹑si-control组﹑si-RIZ1组在2﹑4﹑6﹑8和10 Gy放射剂量下细胞的增殖抑制率比较,经单因素方差分析,差异有统计学意义(F=156.500﹑60.875 ﹑78.868 ﹑ 82.581和 52.625,均P=0.000),表明 RIZ1沉默后细胞的放疗敏感性增加,细胞的生长抑制率升高。见表2和图8。
si-control组与si-RIZ1组在2﹑4﹑6﹑8和10 Gy放射剂量下的细胞克隆形成率比较,经t检验,差异有统计学意义(t=16.455﹑9.959﹑11.356﹑11.590和9.093,均P=0.000),表明RIZ1沉默后细胞的克隆形成数减少。见表2和图9。
凋亡实验结果显示,对照组﹑si-control组﹑si-RIZ1组脑膜瘤细胞的凋亡率分别为(15.6±1.68)%﹑(17.6±2.13)%和(36.8±4.12)%,经单因素方差分析,差异有统计学意义(F=6.363,P=0.007),si-RIZ1组脑膜瘤细胞的凋亡率高于对照组和si-control组。对细胞克隆形成数据进行存活曲线拟合,结果显示RIZ1沉默后放疗敏感性增加,表明miR-153可以通过靶向RIZ1,增加脑膜瘤细胞放射敏感性。见表2和图10。

图4 细胞的克隆形成率

图5 miR-153与RIZ1的结合位点

图6 转染miR-153后RIZ1蛋白的表达
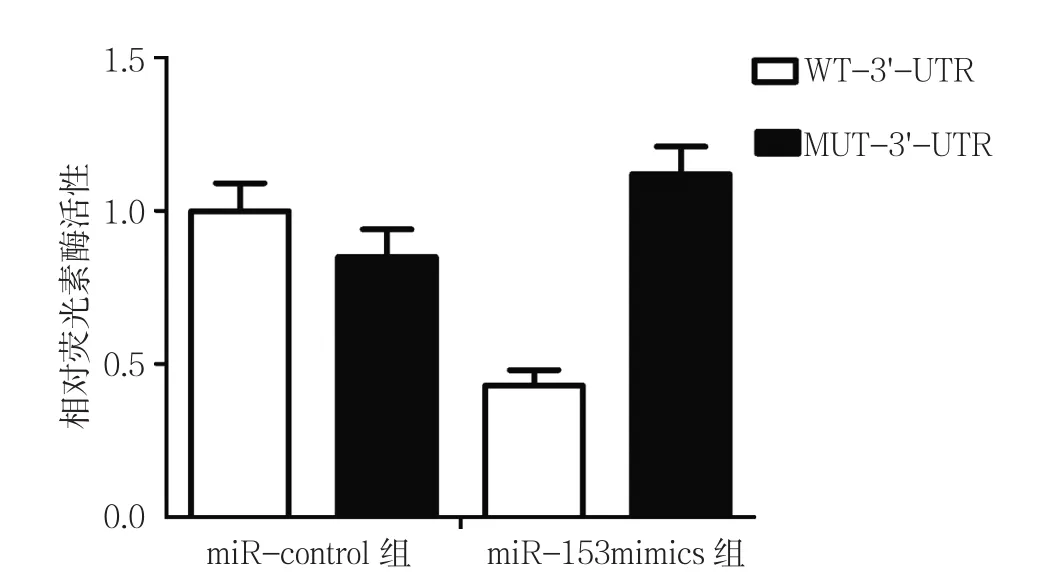
图7 双荧光素酶活性比较 (±s)

表2 基因敲除RIZ1克隆形成实验单击多靶模型的参数

图8 敲除RIZ1对脑膜瘤细胞增殖的影响
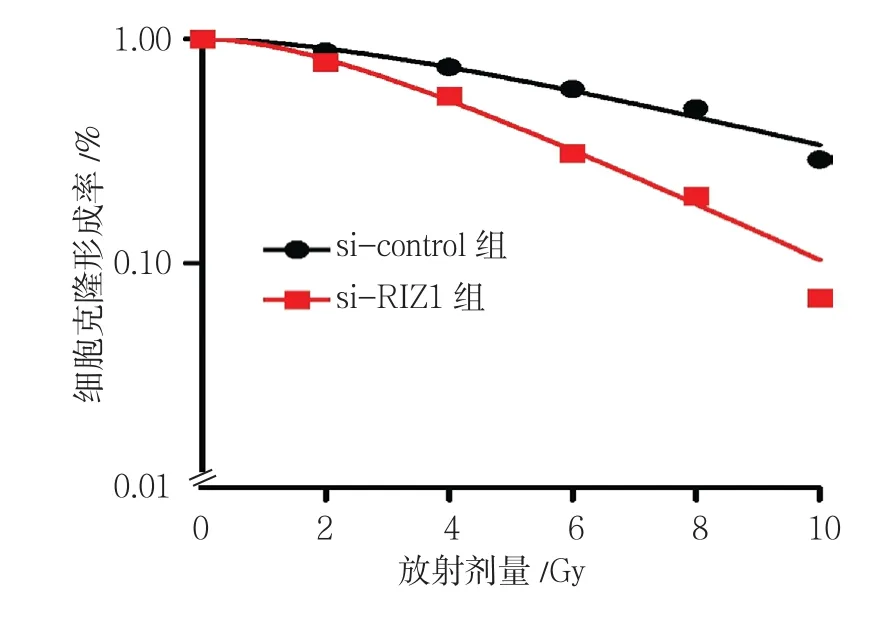
图9 两组细胞克隆形成率比较

图10 基因敲除RIZ1对脑膜瘤细胞凋亡的影响 (±s)
3 讨论
脑膜瘤是常见的颅内肿瘤之一,其首选的治疗方法是手术切除,术后的辅助治疗取决于肿瘤的切除程度和脑膜瘤的病例类型。脑膜瘤的术后辅助放疗可以用于良性脑膜瘤次全切除术后﹑恶性脑膜瘤的术后放疗及不典型增生型脑膜瘤切除术后[4]。另外,部分患者有手术禁忌证,手术实施困难或存在术后高风险,可以首选放疗。因此,了解脑膜瘤的放疗机制有助于其在脑膜瘤临床中的应用。
miRNA广泛存在于真核生物中,是一类由19~25个核苷酸组成的内源性非编码单链RNA,可以通过与靶基因相互作用而降解靶mRNA或抑制靶基因的翻译,还可以调控靶基因的转录和翻译而对靶基因进行转录后调控[5]。miRNA与肿瘤的发生﹑发展及抗肿瘤的放化疗敏感性密切相关。陈华林等[6]报道,miR-125a高表达后可以增加肺癌A549细胞的放疗敏感性,增加放疗后细胞的凋亡率。将miR-18a模拟物转染到A549肺癌细胞中,检测不同剂量照射后细胞的克隆形成能力及存活能力,结果发现高表达miR-18a可以增强肺癌A549细胞的放疗敏感性,miR-18a可能是通过下调共济失调-毛细血管扩张症突变基因的表达,介导细胞的放疗敏感性[7]。
在本研究中,经过4 Gy剂量的放疗,细胞中miR-153的表达降低,笔者推测miR-153可能与脑膜瘤的放疗敏感性相关。本实验进一步使用脂质体转染技术将miR-153模拟物转入脑膜瘤细胞中,观察高表达miRNA-153对脑膜瘤细胞放疗敏感性的影响,结果表明经过放疗,高表达miR-153可以提高脑膜瘤细胞的增殖抑制率和凋亡率,抑制细胞的克隆形成率,证实miR-153可以在脑膜瘤中增加放疗敏感性。miR-153的异常表达与多种肿瘤的发生﹑发展相关,如前列腺癌中,高表达miR-153可以促进细胞周期转换,促进细胞增殖,而抑制miR-153的表达起到相反的作用[8]。在上皮癌中,下调miR-153可以促进细胞的上皮间质转化及转移[9]。miR-153在非小细胞肺癌中发挥抑癌基因的作用,其可以通过靶向整合素和金属蛋白酶19,抑制癌细胞的侵袭和迁移[10]。KIM等[11]在少突神经胶质瘤中筛选了与放疗敏感性相关的miRNA,共65个,miR-153在少突神经胶质瘤患者术后放疗中表达上调。大量文献证明,miR-153与肿瘤细胞放疗敏感性关系密切。
RIZ是新发现的一种肿瘤抑制基因,是用Rb探针对可与Rb结合的蛋白质进行功能性筛选时分离出来的[12]。该基因在人类染色体的位置为1p36。RIZ1基因基于转录位点的不同可表达2种蛋白:RIZ1和RIZ2。RIZ1蛋白属于壳蛋白甲基转移酶超家族,该家族成员在人体生长发育及肿瘤形成过程中发着重要作用[13]。RIZ1可以通过其PR-domain,介导蛋白质-蛋白质相互作用及锌指结构来调控染色质的表达[14]。
随着对RIZ研究的不断深入,发现其与多种肿瘤的发生﹑发展密切相关。有研究发现,80%肝癌细胞中未检测到RIZ1的转录,而在肝癌组织中RIZ1也呈低表达,高表达的RIZ1在肝癌细胞系中可以导致细胞周期阻滞并促进细胞凋亡[15]。在乳腺癌的研究中同样发现,RIZ1在乳腺癌组织或细胞系中表达降低,高表达RIZ1可以阻滞细胞周期,诱导细胞凋亡[16]。在卵巢癌中,卵巢癌组织和卵巢癌细胞系中RIZ1基因和蛋白表达均低于正常的卵巢组织[17]。RIZ1的表达还能够诱导AML193和K562髓性白血病细胞株的凋亡[18]。在脑膜瘤中,高表达的RIZ1可以抑制细胞增殖,阻滞细胞周期并诱导细胞凋亡[19]。本研究首先通过TargetScan预测RIZ1可能是miR-153的靶基因,RIZ1的基因PRDM2 3’-UTR可能与miR-153有相互作用,进一步的双荧光素酶报告基因实验证实RIZ1为miR-153的靶标。本实验又用基因敲除技术将RIZ1基因沉默,发现RIZ1沉默后能够增加脑膜瘤细胞的放疗敏感性,结果提示RIZ1可能与肿瘤细胞的放疗敏感性有关。
本实验证明,miR-153通过靶向干扰RIZ1,增加脑膜瘤细胞的放疗敏感性。这对防止脑膜瘤术后复发及增加脑膜瘤的放疗效果具有重要意义,也为治疗脑膜瘤提供了新的靶标。
参 考 文 献:
[1]PARDO O E. Meningioma dissemination and growth: a role for microRNAs[J]. Oncogene, 2015, 34(14): 1743-1744.
[2]GALLAGHER M J, JENKINSON M D, BRODBELT A R, et al.WHO grade 1 meningioma recurrence: are location and simpson grade still relevant[J]. Clinical Neurology and Neurosurgery, 2016,141: 117-121.
[3]SAYDAM O, SHEN Y, WÜRDINGER T, et al. Downregulated microRNA-200a in meningiomas promotes tumor growth by reducing E-cadherin and activating the Wnt/β-catenin signaling pathway[J]. Molecular and Cellular Biology, 2009, 29(21): 5923-5940.
[4]张新良, 王晓萍. 脑膜瘤的诊治现状与进展[J]. 临床肿瘤学杂志, 2011, 16(7): 658-661.
[5]GRIMSON A. Noncoding RNA: linking microRNAs to their targets[J]. Nature Chemical Biology, 2015, 11(2): 100-101.
[6]陈华林, 杨东红, 王永存, 等. miR-125a对肺癌A549细胞放疗敏感性影响机制的初步研究[J]. 实用肿瘤杂志, 2015, 30(4):335-339.
[7]吴磊, 孙建国, 徐睿, 等. miR-18a对A549细胞的放射增敏作用及其机制[J]. 第三军医大学学报, 2013, 35(9): 870-873.
[8]WU Z, HE B, HE J, et al. Upregulation of miR‐153 promotes cell proliferation via downregulation of the PTEN tumor suppressor gene in human prostate cancer[J]. The Prostate, 2013, 73(6): 596-604.
[9]XU Q, SUN Q, ZHANG J, et al. Downregulation of miR-153 contributes to epithelial-mesenchymal transition and tumor metastasis in human epithelial cancer[J]. Carcinogenesis, 2013:34 (3): 539-549.
[10]SHAN N, SHEN L, WANG J, et al. miR-153 inhibits migration and invasion of human non-small-cell lung cancer by targeting ADAM19[J]. Biochemical and Biophysical Research Communications, 2015, 456(1): 385-391.
[11]KIM G, PARK E C, CHUNG H R, et al. MicroRNA expression profiling in recurrent anaplastic oligodendroglioma treated with postoperative radiotherapy[J]. JAST, 2011, 2(2): 97-104.
[12]NOMAN A S M, KOIDE N, IFTAKHAR-E-KHUDA I, et al. Retinoblastoma protein-interacting zinc finger 1 (RIZ1)participates in RANKL-induced osteoclast formation via regulation of NFATc1 expression[J]. Immunology letters, 2010,131(2): 166-169.
[13]MORI N, YOSHINAGA K, TOMITA K, et al. Aberrant methylation of the RIZ1 gene in myelodysplastic syndrome and acute myeloid leukemia[J]. Leukemia Research, 2011, 35(4):516-521.
[14]CHENG H Y, GAO Y, LOU G. DNA methylation of the RIZ1 tumor suppressor gene plays an important role in the tumorigenesis of cervical cancer[J]. European Journal of Medical Research, 2010, 15(1): 20.
[15]LIU Z Y, WANG J Y, LIU H H, et al. Retinoblastoma proteininteracting zinc-finger gene 1 (RIZ1) dysregulation in human malignant meningiomas[J]. Oncogene, 2013, 32(10): 1216-1222.
[16]HE L, YU J X, LIU L, et al. RIZ1, but not the alternative RIZ2 product of the same gene, is underexpressed in breast cancer,and forced RIZ1 expression causes G2-M cell cycle arrest and/or apoptosis[J]. Cancer Res, 1998, 58: 4238-4244.
[17]蔡惠兰, 钱颖, 贺晓琪, 等. 卵巢上皮性癌中RIZ1基因表达缺陷的意义及其与甲基化的关系[J]. 武汉大学学报(医学版),2008, (4): 430-434.
[18]余卫平, 方娟娟, DONG W F, 等. RIZ1表达对髓性白血病细胞株凋亡的影响[J]. 中国癌症杂志, 2007, (1): 65-67.
[19]LIU Z Y, WANG J Y, LIU H H, et al. Retinoblastoma proteininteracting zinc-finger gene 1 (RIZ1) dysregulation in human malignant meningiomas[J]. Oncogene, 2013, 32: 1216-1222.

