miR-143靶向调控ER-α36影响胃癌细胞系SGC7901的侵袭
邹 丰, 罗媛媛,刘丽江*
(江汉大学 医学院 1.病理学与病理生理学教研室; 2.医疗系, 湖北 武汉 430056)
雌激素受体ER-α36(estrogen receptor-α36)作为近几年鉴定并克隆出的一种新型的雌激素受体,发挥着与经典的雌激素受体ER-α66完全不同的生物学功能[1]。ER-α36启动雌激素样信号传导主要通过细胞膜来完成,不仅能够调控乳腺癌等性激素依赖性肿瘤的生长[2],也能介导胃癌等非性激素依赖性肿瘤的发生[3]。
microRNA是一类长度约为20~25 nt的小分子
单链RNA,具有高度保守的内源性非蛋白编码,其主要功能是通过对靶基因转录体的切割或翻译抑制来调控基因的表达[4]。前期研究证实,雌激素受体ER-α36不仅能在胃癌组织和胃癌细胞系中表达,也能促进胃癌细胞的侵袭,其机制可能与microRNA- 143(miR-143)有关[5]。本项研究将进一步用体外实验阐明miR-143通过靶向ER-α36调控胃癌细胞的侵袭。
1 材料与方法
1.1 材料
1.1.1 细胞:人胃癌细胞系SGC7901(华中科技大学同济医学院免疫学系惠赠,为本实验室保存)。
1.1.2 试剂:ER-α36沉默质粒、ER-α36过表达质粒和ER-α36单克隆抗体(美国Creighton大学医学院肿瘤中心王兆一教授馈赠);β-Actin抗体(Santa Cruz公司);Transwell侵袭试剂盒(Millipore公司);miR-143、内参U6的Taqman引物和探针(Applied Biosystems公司);质粒抽提试剂盒和Dual-GloTMLuciferase Assay System(Promega公司);Opti-MEM培养基(Invitrogen公司)。
1.2 方法
1.2.1 细胞培养及分组处理:将人胃癌SGC7901细胞接种在含10%小牛血清的RPMI1640培养基中,于37 ℃、5% CO2培养箱中培养。每2~3 d待细胞增殖至70%~80%汇合时胰蛋白酶消化传代。
1.2.2 质粒构建:通过使用miRNA 抑制剂克隆导入细胞后表达miRNA抑制剂(miArrest) 和插入pre-miR143序列的方法构建miR-143沉默和miR-143表达的质粒,经转化大肠杆菌并测序验证。其目的载体选用GV159和GV272。慢病毒载体(lentiviral vectors,LV)系统由 GV 慢病毒载体系列、pHelper 1.0 载体和 pHelper 2.0 载体3质粒组成并包装生成上调/下调miR-143的慢病毒LV-miR-143和LV-anti-miR-143。用慢病毒的方法感染人胃癌SGC7901细胞系,荧光显微镜下观察EGFP荧光蛋白的变化。
1.2.3 Western blot检测ER-α36蛋白的表达:提取细胞胞质总蛋白。按BCA蛋白含量测定试剂盒说明进行蛋白定量,经SDS-PAGE分离后蛋白半干转印于PVDF膜,封闭后I抗分开孵育:分别加入ER-α36抗体和β-actin抗体,4 ℃过夜;洗膜后孵育II抗,室温1 h,洗膜后于暗室中行ECL显色检测蛋白的表达,采用数码凝胶图像处理系统扫描测定ER-α36和内参β-actin的表达(用平均吸光度值表示)。
1.2.4 Transwell小室实验检测SGC7901细胞的侵袭:采用Millpore试剂盒,按说明书操作。
1.2.5 生物信息学配对:利用microRNA的靶基因数据库(http://microrna.sanger.ac.uk/sequences/)进行ER-α36基因的3′UTR区与miR-143的Seed Region(种子区)的配对分析。
1.2.6 荧光素酶检测ER-α36和miR-143的相关性:培养增殖状态良好的293T细胞,质粒转染前1 d,将细胞分入24-well培养板培养,转染当天按实验设计的组别进行质粒转染实验。转染24 h后荧光显微镜下观察细胞内荧光标记基因(如GFP)的表达情况,然后使用试剂盒处理细胞,进行luciferase表达检测。
1.3 统计学分析
2 结果
2.1 荧光显微镜下观察绿色荧光蛋白EGFP的表达
转染后miR-143 down组细胞和miR-143 up组细胞均能发出大量绿色荧光,且细胞情况良好,轮廓边缘清晰。对照组无荧光信号的产生(图1)。
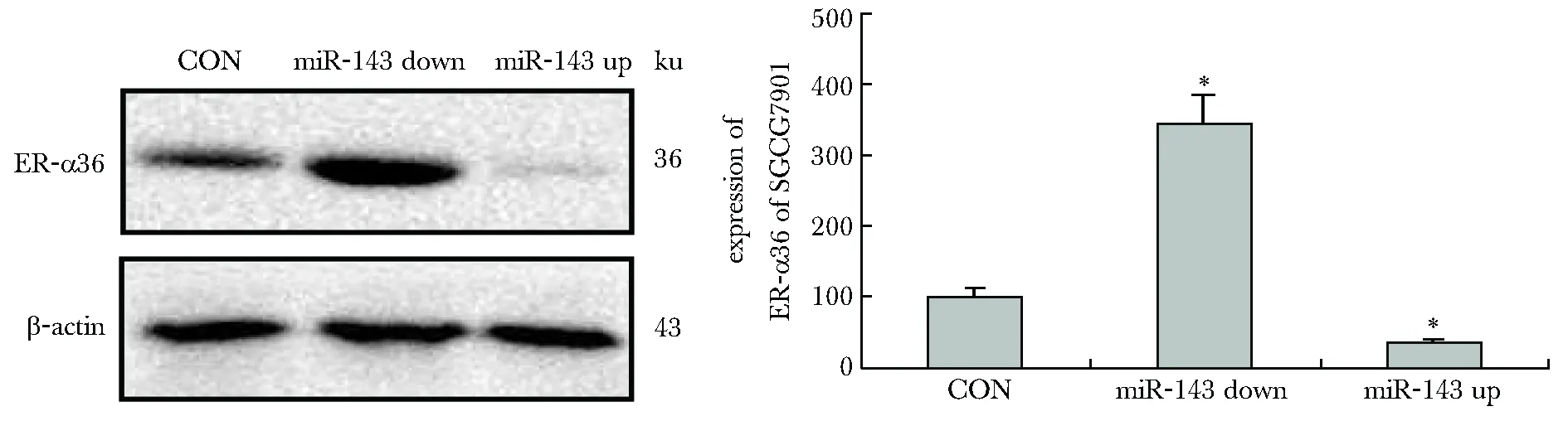
2.2 沉默或过表达miR-143对SGC7901细胞ER-α36表达的影响
miR-143沉默组(miR-143 down)其ER-α36蛋白表达要明显高于对照组(P<0.05);miR-143表达组(miR-143 up)其ER-α36蛋白表达要明显低于对照组和miR-143表达组(miR-143 up)(P<0.05)(图2)。
2.3 沉默或过表达miR-143对SGC7901细胞侵袭性的影响
与对照组细胞相比,miR-143沉默(miR-143 down)的侵袭性明显增强,而miR-143表达的质粒(miR-143 up)的侵袭性明显减弱(图3)。
2.4 miR-143与ER-α36的配对
ER-α36基因的3′UTR区与miR-143的Seed Region(种子区)有超过14对的碱基互补,可能成为miR-143的重要靶基因之一(图4)。

图1 慢病毒感染24 h细胞感染率Fig 1 Cell infection rate (24 hours after transfection, ×200)
*P<0.05 compared with CON group

图3 过表达miR-143抑制SGC7901细胞的侵袭,反之增加
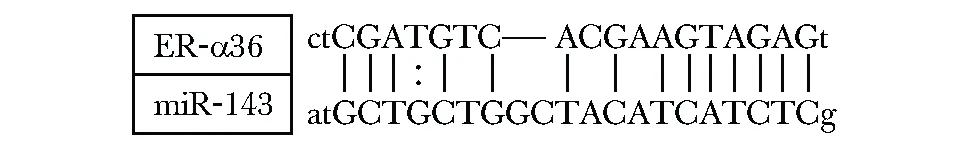
图4 miR-143的种子区与ER-α36的3′端非编码区有14对碱基互补配对Fig 4 14 direct recognitions of the 3′-UTR of the mRNA of ER-α36 by miR-143
2.5 荧光素酶报告基因实验验证ER-α36和miR-143的关系
在野生型(WT cell)中,转染miR-143 表达组(miR-143 up)的荧光素酶表达量比转染对照类似物组明显下降(P<0.05),而转染miR-143沉默组(miR-143 down)的荧光素酶表达量明显上升(P<0.05);对ER-α36 3′UTR区的相应位点进行突变后的miR-143(MUT cell)不再影响荧光素酶的表达量。即证实miR-143可以直接与ER-α36 3′UTR区的特定位点以碱基互补配对方式结合,其序列在种属间高度保守,且其相互作用的亲和力较高(图5)。

*P<0.05 compared with miR-143 up NC group; #P<0.05 compared with miR-143 down NC group图5 荧光素酶报告基因实验证实miR-143负向调控ER-α36的表达Fig 5 Luciferase reporter assay confirmed the direct recognition of the 3′-UTR of ER-α36 by
3 讨论
探讨胃癌防治的分子机制具有重要的临床意义。MicroRNA是一类具有高度保守的内源性非蛋白编码的小分子单链RNA,其与肿瘤的发生和发展密不可分。前期研究工作发现:低浓度的雌激素促进胃癌细胞的侵袭,高浓度的雌激素抑制胃癌细胞的侵袭。胃癌的侵袭能力和雌激素受体ER-α36的表达呈正相关,其机制可能与miR-143的调控有关。
miR-143位于人类基因组5号染色体上,在多种生物中均有表达。miR-143最早被报道存在于小鼠胚胎的多能心脏祖细胞中,其功能是促进平滑肌细胞的分化并抑制其增生[6]。最近已有大量的证据显示miR-143与肿瘤的发生密切相关。miR-143表达的下调可以促进食管鳞状细胞癌的发生[7]。miR-143还能通过调控其靶基因DNA甲基转移酶3A蛋白来介导结直肠癌的发生[8]。miR-143与胃癌的发生也联系紧密。应用miRNAs芯片技术筛选了47例配对的胃癌和正常胃组织,对比差异发现有42个miRNA高表达,20个miRNA低表达。其中差异最显著的是miR-143[9]。通过胃癌组织和癌旁正常组织与SGC7901胃癌细胞的对比发现,miR-143可通过抑制鸟成红细胞增多癌基因- 3(ERBB3)的表达抑制胃癌细胞的增殖与迁移[10]。虽然不同的研究者针对的靶向调控基因不同,但与本研究结果一致的是,miR-143都参与了抑制胃癌的发生,提示miR-143有一定的分子靶向治疗前景。
miR-143的水平也会随着胃癌的发展过程发生显著的改变。82例晚期接受含紫杉醇联合铂类或氟尿嘧啶类药物的胃癌患者的血清标本中miR-143的水平与同期76名健康体检者的miR-143水平相比后显著降低,提示晚期胃癌血清miR-143水平明显低于正常值,且与含紫杉醇方案化疗敏感性及预后均有关[11]。推测出miR-143的水平改变对于肿瘤的评估已有一定的临床意义。此外,另一种非编码RNA的lncRNA在胃癌中的研究愈来愈热[12]。LncRNA还能与miRNA相互调节来促进或抑制肿瘤的发生[13]。因此,下一阶段还会对在胃癌中表达差异的lncRNA进行相关研究,并探讨与miRNA尤其是miR-143之间的关联。
综上所述,本研究结果显示:miR-143通过靶向雌激素受体ER-α36负向调控胃癌细胞SGC7901的侵袭。
参考文献:
[1] Wang ZY, Zhang XT, Shen P,etal. Identification, cloning, and expression of human estrogen receptor-α36, a novel variant of human estrogen receptor-α66[J]. Bio Chem Biophy Res Commun, 2005, 336:1023- 1027.
[2] Shi L, Dong B, Li Z,etal. Expression of ER-{alpha}36, a novel variant of estrogen receptor {alpha}, and resistance to tamoxifen treatment in breast cancer[J]. J Clin Oncol, 2009, 27:3423- 3429.
[3] Deng H, Huang X, Fan J,etal. A variant of estrogen receptor, ER-α36 is expressed in human gastric cancer and is highly correlated with lymph node metastasis[J]. Oncol Rep, 2010, 24: 171- 176.
[4] Lee Y, Kim M, Han J,etal. MicroRNA genes are transcribed by RNA polymerase II[J]. EMBO J, 2004, 23: 4051- 4060.
[5] 邹丰, 王绪明, 刘丽江. ER-α36和miR-143介导胃癌细胞的侵袭[J]. 中国病理生理杂志, 2012, 28: 2167- 2171.
[6] Cordes KR, Sheehy NT, White MP,etal.miR- 145 and miR-143 regulate smooth muscle cell fate and plasticity[J]. Nature, 2009,460:705- 710.
[7] Wu BL, Xu LY, Du ZP,etal. MiRNA profile in esophageal squamous cell carcinoma: downregulation of miR-143 and miR- 145[J].World J Gastroenterol, 2011,17:79- 88.
[8] Ng EK, Tsang WP, Ng SS,etal. MicroRNA- 143 targets DNA methyltransferases 3A in colorectal cancer[J].Br J Cancer, 2009, 101:699- 706.
[9] 王欣怡,张海洋,李爽,等. miR-143抑制胃癌细胞SGC7901增殖与迁移的机制研究[J]. 中国肿瘤临床, 2016, 43:702- 706.
[10] 邓铃,罗霞,杨旸,等. miR-143和miR- 520d- 5p在胃癌组织中的异常表达[J]. 广东药学院学报, 2013, 29: 660- 664.
[11] 李金凤,成伟丽,任旭升,等. 血清miR-143水平与晚期胃癌含紫杉醇化疗方案敏感性的关系分析[J].临床肿瘤学杂志, 2017, 22:137- 142.
[12] Gu Y, Chen T, Li G,etal. LncRNAs: emerging biomarkers in gastric cancer[J].Future Oncol, 2015, 11:2427- 2441.
[13] Li PF,Chen SC,Xia T,etal.Non- coding RNAs and gastric cancer[J].World J Gastroenterol, 2014, 20: 5411- 5419.
新闻点击
乳房哺乳结束后会启动自毁程序
据英国《BBC新闻》(BBCNEWS)2016年10月15日报道,当母乳哺喂停止时,这个“乳汁工厂”会在几天内停工。但是乳房如何在短时间内迅速的从人奶制造机回复到原先的自然状态,新近科学家确定了一个控制泌乳细胞转变成为垂死细胞吞噬者的分子开关,终于揭开了其中的秘密。
在怀孕期间,女性体内的激素变化会引起乳房上皮细胞衬里的腺管增殖,形成名为乳腺泡(alveolus)的球状结构,制造并储存奶水。然而,一旦妇女停止母乳喂养,这些结构以牵涉到大规模细胞自杀并除去碎屑的方式自毁。
有趣与神秘之处在于:已知人体的免疫细胞会进行吞噬作用(phagocytosis)清除死亡和垂死细胞,过程中由于消耗的物质数量庞大,因此会产生炎性反应-明显的肿胀、疼痛和组织损伤;但这些现象在女性停止哺乳时通常不会发生。澳洲悉尼大学的癌生物学家Matthew Naylor指出,这是当今科学家对于女性停止哺乳后的乳房转变过程特别无法理解的部分;在停止哺乳后,剩余的乳汁与大量的死亡细胞如何不经历上述免疫系统运作时会发生的实质反应而被从乳腺中移除?由于已知一种名为Rac1的蛋白质对于正常制造奶水,以及免疫细胞行吞噬作用两者来说都至关重要,因此,英国Sheffield大学的学者Nasreen Akhtar与其同事认为Rac1可能也在哺乳停止后的乳房重塑过程扮演重要角色。为此,他们使用雌性小鼠进行实验。
监督此研究的学者Charles Streuli指出,在停止哺乳后,必须被迅速从乳腺清除的物质量非常巨大,如果光仰赖免疫细胞吞噬死亡细胞,仍然会获得慢性炎性反应和组织损伤;而根据Akhtar的研究结果,首次显示了Rac1是吞噬细胞活性的关键,且停止哺乳后,细胞尸体与剩余乳汁的净空对组织功能的长期发展至关重要。
除了触发吞噬功能,Rac1似乎也让濒死细胞在乳腺泡里停留更长的时间,目的可能是鼓励它们的邻居吞没它们,而不是把它们留给在乳腺导管中的免疫细胞。Streuli认为:由此,乳腺管内的上皮细胞得以进行清理自己的工作,进而牵制住会引起炎性反应的吞噬细胞。

