难治性肺炎支原体肺炎患儿支气管肺泡灌洗液中肺表面活性物质相关蛋白的表达及其临床意义
原瑞芳,王少青
(鹤壁市人民医院儿科,河南 鹤壁 458030)
肺炎支原体肺炎(Mycoplasmapneumoniaepneumonia,MPP)是小儿常见的呼吸道疾病,约10%~40%的儿童社区获得性肺炎是由肺炎支原体(Mycoplasmapneumoniae,MP)感染引起[1]。通常认为,MPP是一种自限性疾病,但部分MPP患儿在应用大环内酯类抗生素治疗后高热持续不退(超过7 d),咳嗽症状无明显好转,肺部影像学提示大片高密度均匀实变,支气管镜下可见黏液栓和(或)黏膜坏死,发展为难治性肺炎支原体肺炎(refractoryMycoplasmapneumoniaepneumonia,RMPP)[2-3]。肺表面活性物质相关蛋白(surfactant associated protein,SP)是肺泡表面活性物质的主要成分之一,与肺部感染密切相关[4],目前共发现4种SP,即SP-A、SP-B、SP-C和SP-D。SP具有广泛的生物学活性,如免疫调节、气管保护、调节肺表面活性物质代谢等。有研究表明,SP水平变化可反映肺损伤程度[5]。本课题对RMPP患儿急性期与恢复期支气管肺泡灌洗液(bronchoalveolar lavage fluid,BLAF)中SP水平进行比较,以期为RMPP患儿病情评估及治疗提供指导。
1 资料与方法
1.1一般资料选择2015年1月至2016年12月鹤壁市人民医院儿科收治的RMPP患儿30例,男18例,女12例,年龄7~12(7.5±2.4)岁。纳入病例均无免疫缺陷或自身免疫性疾病、肺纤维化、肺结核、哮喘、肺部真菌感染、支气管扩张及其他肺部疾病。本研究通过医院医学伦理委员会批准,患儿监护人均签署知情同意书。
1.2RMPP诊断标准RMPP诊断标准[6]:腋窝体温>38.3 ℃,正规应用大环内酯类抗生素1周以上,患儿病情仍未见好转。急性期:RMPP患儿入院第1~3 d,腋窝体温高于38.3 ℃,咳嗽,影像学检查提示肺部大片高密度均匀实变,支气管镜检可见黏液栓或黏膜坏死。恢复期:RMPP患儿治疗2~3周后,发热得到控制,咳嗽明显减轻,影像学检查提示肺部炎症明显减轻,支气管镜检查有轻度或无黏液栓[7]。
1.3主要试剂与仪器人SP-A、SP-B、SP-C和SP-D酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海丰寿生物科技有限公司),DG5031酶联免疫检测仪(上海巴玖实业有限公司),RSGF1000小儿肺功能检测仪(德国耶格公司),BF-Q170电子纤维支气管镜(日本奥林巴斯公司),CR-21G高速冷冻离心机(日本Hitachi有限公司)。
1.4方法
1.4.1标本采集及处理患儿分别于急性期和恢复期在镇静及局部麻醉下行纤维支气管镜检查。患儿禁食4~6 h,检查前30 min肌肉注射阿托品(重庆西南药业股份有限公司,国药准字H50020044)0.01~0.03 mg·kg-1,苯巴比妥注射液(天津金耀药业有限公司,国药准字H12020381)5 mg·kg-1,二者总剂量不超过100 mg。患儿以20 g·L-1利多卡因(河北天成药业股份有限公司,国药准字H13022314)鼻腔及咽喉部喷雾麻醉10~15 min,根据患儿年龄、体质量选取合适型号的纤维支气管镜进行检查,于X线片提示的肺部严重炎症或肺不张部位进行支气管肺泡灌洗,取BALF[8],4 ℃下3 000 r·min-1离心10 min,取上清液,-70 ℃保存待测。
1.4.2BALF中SP-A、SP-B、SP-C和SP-D水平检测按照ELISA试剂盒说明书步骤进行操作,绘制标准曲线,计算BALF中SP-A、SP-B、SP-C和SP-D水平。
1.4.3肺功能检测患儿分别于急性期和恢复期进行肺功能检测,检测前让患儿及家属熟悉操作流程及测试动作,使用肺功能检测仪检测患儿肺功能,记录第1秒用力呼气量(forced expiratory volume in one second,FEV1)和用力肺活量(forced vital capacity,FVC)。

2 结果
2.1RMPP患儿急性期与恢复期肺功能比较结果见表1。RMPP患儿恢复期FEV1、FVC和FEV1/FVC显著高于急性期,差异均有统计学意义(P<0.05)。
表1RMPP患儿急性期与恢复期FEV1、FVC及FEV1/FVC比较
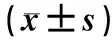

组别nFEV1/LFVC/LFEV1/FVC/%急性期301.34±0.231.75±0.2868.25±6.21恢复期301.71±0.351.98±0.3688.57±8.16t4.8393.07014.859P0.0160.0250.000
2.2RMPP患儿急性期与恢复期BALF中SP-A、SP-B、SP-C及SP-D水平比较结果见表2。RMPP患儿恢复期BALF中SP-A、SP-B、SP-C和SP-D水平显著高于急性期,差异均有统计学意义(P<0.05)。
表2RMPP患儿急性期与恢复期BALF中SP-A、SP-B、SP-C及SP-D水平比较
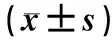

组别nSP-A/(μg·L-1)SP-B/(μg·L-1)SP-C/(μg·L-1)SP-D/(μg·L-1)急性期3050.19±10.0642.95±12.4236.81±8.1421.57±5.46恢复期30135.20±18.13108.42±20.33142.63±21.8772.69±8.54t22.45715.05224.83727.623P0.0000.0000.0000.000
3 讨论
RMPP患儿多有顽固性高热、咳嗽、呼吸困难及肺外器官并发症,病情严重,进展迅速,早期评估患儿病情并及时进行合理治疗可以有效改善患儿预后,降低病死率[9]。X线检查只有在肺部出现严重水肿、渗出时才能显示出来,其滞后性降低了其早期诊断RMPP的价值;另外,RMPP患儿的胸部X线影像表现与临床症状并不完全吻合[10]。RMPP患儿急性期往往会出现呼吸困难,因此,测评患儿肺功能对于诊断和治疗RMPP有重要指导作用,但是,单纯检查肺功能不足以评估RMPP患儿病情。纤维支气管镜下行支气管肺泡灌洗并对BALF成分进行分析是评估RMPP病情的有效手段。
SP-A、SP-B、SP-C和SP-D由Ⅱ型肺泡上皮细胞(alveolar epithelial cell type Ⅱ,AEC-Ⅱ)和呼吸道Clara细胞合成并分泌,这些表面蛋白在肺表面活性物质(pulmonary surfactant,PS)的结构、功能和代谢方面发挥重要作用[11]。4种肺表面活性蛋白中,以SP-A水平最高,其可以与细菌和病毒结合,增强肺泡巨噬细胞的趋化作用,提高肺的防御功能[12]。SP-B可以降低肺泡气-液界面张力,防止肺泡萎陷,且具有抗炎作用[13]。另外,SP-B可以加速磷脂的吸附和扩展,SP-C与SP-B相互作用可以促进AEC-Ⅱ对磷脂的摄取[14-15];而SP-D则与呼吸系统特异性免疫有关[15]。
本研究结果显示,RMPP患儿恢复期FEV1、FVC、FEV1/FVC显著高于急性期,而恢复期BALF中SP-A、SP-B、SP-C和SP-D水平显著高于急性期;提示SP-A、SP-B、SP-C和SP-D水平与RMPP患儿病情具有一定相关性,即RMPP患儿病情越严重,SP-A、SP-B、SP-C和SP-D水平越低,肺功能越差;随着RMPP患儿病情好转,SP-A、SP-B、SP-C和SP-D水平升高,肺功能逐渐改善。RMPP急性期患儿BALF中SP-A、SP-B、SP-C和SP-D水平降低可能与AEC-Ⅱ受损后分泌功能减弱有关;RMPP急性期患儿BALF中富含的弹性蛋白酶也可降解各种表面活性蛋白,使其水平进一步降低;另外,肺局部炎症反应过程中SP-A、SP-B、SP-C和SP-D被大量消耗,也导致SP水平迅速下降。
综上所述,检测BALF中SP-A、SP-B、SP-C和SP-D水平对RMPP的诊断、病情评估、治疗及预后判断具有一定的指导意义。
参考文献:
[1] YANG H J,SONG D J,SHIM J Y.Mechanism of resistance acquisition and treatment of macrolide-resistantMycoplasmapneumoniaepneumonia in children[J].KoreanJPediatr,2017,60(6):167-174.
[2] 代继宏,涂金伟,符州.儿童呼吸系统疾病的热点和难点问题及研究进展[J].中华实用儿科临床杂志,2017,32(16):1205-1209.
[3] ZHANG Y Y,ZHOU Y L,LI S X,etal.The clinical characteristics and predictors of refractoryMycoplasmapneumoniaepneumonia in Children[J].PLoSOne,2016,11(5):e0156465.
[4] HAN S,MALLAMPALLI R K.The role of surfactant in lung disease and host defense against pulmonary infections[J].AnnAmThoracSoc,2015,12(5):765-774.
[5] GAUNSBAEK M Q,RASMUSSEN K J,BEERS M F,etal.Lung surfactant protein D(SP-D) response and regulation during acute and chronic lung injury[J].Lung,2013,191(3):295-303.
[6] SHIN J E,CHEON B R,SHIM J W,etal.Increased risk of refractoryMycoplasmapneumoniaepneumonia in children with atopic sensitization and asthma[J].KoreanJPediatr,2014,57(6):271-277.
[7] 中华医学会儿科学分会呼吸学组,《中华实用儿科临床杂志》编辑委员会.儿童肺炎支原体肺炎诊治专家共识(2015年版)[J].中华实用儿科临床杂志,2015,30(17):1304-1308.
[8] 张华.不同病原体感染肺炎患儿支气管肺泡灌洗液中肺表面活性物质相关蛋白的表达[J].新乡医学院学报,2017,34(6):510-512.
[9] SHIN J E,CHEON B R,SHIM J W,etal.Increased risk of refractoryMycoplasmapneumoniaepneumonia in children with atopic sensitization and asthma[J].KoreanJPediatr,2014,57(6):271-277.
[10] 温顺航,张海邻,李昌崇.儿童肺炎支原体肺炎的影像学表现[J].中华实用儿科临床杂志,2016,31(16):1272-1274.
[11] BAE C W,CHUNG S H,CHOI Y S.Development of a synthetic surfactant using a surfactant protein-c peptide analog:invitrostudies of surface physical properties[J].YonseiMedJ,2016,57(1):203-208.
[12] SARKER M,JACKMAN D,BOOTH V.Lung surfactant protein a(SP-a) interactions with model lung surfactant lipids and an SP-B fragment[J].Biochemistry,2011,50(22):4867-4876.
[13] 高阳,刘冬云,孔祥斌,等.环氧合酶2抑制剂对高氧环境下新生大鼠肺组织肺表面活性物质相关蛋白B、转化生长因子-β1表达的影响[J].中华实用儿科临床杂志,2016,31(14):1081-1085.
[14] MALCHAREK S,HINZ A,HILTERHAUS L,etal.Multilayer structures in lipid monolayer films containing surfactant protein C:effects of cholesterol and POPE[J].BiophysJ,2005,88(4):2638-2649.
[15] 王晶,梅花.肺表面活性蛋白B、C与新生儿肺疾病关系的研究进展[J].中国新生儿科杂志,2015,30(5):387-389.
[16] 刘娇,陈德昌.肺表面活性蛋白的研究进展[J].中华实用儿科临床杂志,2014,22(12):878-882.

