广西产拳卷地钱DNA的SCoT-PCR引物筛选及反应体系优化Δ
谢凤凤,李鹏,黎理,朱华#,尚小红,李平凤(.广西中医药大学科学实验中心,南宁53000;.广西作物遗传改良生物技术重点开放实验室,南宁 530007)
随着现代遗传分子标记技术的发展,其在种质遗传多样性评价与亲缘关系分析、种质资源鉴定、指纹图谱与分子连锁图谱构建、基因表达差异、分子标记辅助育种以及功能基因克隆等方面的应用[1]逐渐成为热点。分子标记技术有数十种之多,随着研究目的不同,需要选择相适应的标记方法。基因间隔区2-限制性DNA片段长度多态性(IGS2-RFLP)、简单重复序列(ISSR)与目标起始密码子多态性(SCoT)标记是常见的3种分子标记技术。其中,SCoT分子标记作为一种新型的目的基因分子标记技术,其引物设计简单、通用性好,其产物可使用琼脂糖凝胶电泳检测,操作更加简便,且条带多态性高、有丰富的遗传信息[2]。近5年关于SCoT分子标记的文献已逾300篇,主要是将其应用于遗传多样性及亲缘关系分析[3]、反应体系优化[4]、指纹图谱分析[5]等方面的报道,表明SCoT分子标记的手段日趋成熟,可广泛应用于多种植物的种质资源鉴定、遗传信息分析等研究。
广西产拳卷地钱来源于地钱科地钱属植物拳卷地钱(Marchantia convolutaGao et Chang),始载于《西藏苔藓植物志》,是苔藓植物中常用的中草药之一[6]。其常用于外治烫伤骨折、体癣、疮病不敛,内治黄疸性肝炎,获得了较好的疗效[7-8]。广西壮族自治区地处热带及亚热带地区,且地形以山地为主、海拔较高,因此地钱属(MarchantiaL.)植物品种资源在这一地区分布颇多。资源调查情况和生药学鉴定结果显示,广西境内地钱属植物主要有地钱(M.polymorpha)、拳卷地钱(M.convolutaGao et Chang)和粗裂地钱(M.paleacea)3种[9],尤以拳卷地钱的资源最为丰富。目前关于拳卷地钱的分子遗传学研究极少,为了更好地开发利用广西这一特色优势药材资源,确保其基源的准确性,本课题组提取了拳卷地钱的DNA,以其为模板筛选SCoT-聚合酶链式反应(PCR)体系的引物,并优化反应体系条件,为拳卷地钱的品种鉴定及资源开发提供技术基础。
1 材料
1.1 仪器
DYY-6C型核酸电泳仪(北京市六一仪器厂);JS-1075型凝胶成像分析系统(上海培清科技有限公司);ABI-2720型PCR仪[赛默飞世尔科技(中国)有限公司];Lambda265型紫外分光光度计(美国珀金埃尔默仪器有限公司);BP211D型电子分析天平(德国赛多利斯公司);H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);HH-S4型恒温水浴箱(上海一恒科技有限公司)。
1.2 试剂与引物
十六烷基三甲基溴化铵(CTAB)抽提液(北京雷根生物技术有限公司,批号:NE0012-500mL);kb DNA Ladder(批号:M1400-100T)、GoldView核酸染色剂(批号:G8140)均购自北京索莱宝科技有限公司;EX Taq酶套装(含Taq DNA聚合酶、Buffer、dNTP)及DL Marker 2000、GelRed试剂均购自宝生物工程(大连)有限公司。
引物参照文献[10]中的36条SCoT引物序列(见表1),均由生工生物工程(上海)股份有限公司合成。

表1 36条SCoT引物序列Tab 1 Sequences of 36 SCoT primers
1.3 药材
拳卷地钱幼嫩叶状体于2017年5月22日采自广西来宾金秀镇六拉冲村,经广西中医药大学药用植物教研室韦松基教授鉴定为拳卷地钱(M.convolutaGao et Chang)原植物。将药材洗净后于-20℃保存,备用。
2 方法与结果
2.1 拳卷地钱药材样品DNA提取及浓度测定
采用文献[11]中的改良CTAB法提取拳卷地钱药材样品的DNA。采用1.5%琼脂糖凝胶电泳法检测DNA纯度,设定电压为110 V、运行时间为30 min(以下凝胶电泳试验均设置相同条件);然后经GoldView核酸染色剂染色,在凝胶成像分析系统上成像。采用紫外分光光度法,于260、280 nm处分别测定吸光度(A),用吸光度比值(A260/A280)表示DNA浓度。
凝胶电泳结果显示,样品DNA条带整齐,无RNA污染、无降解、无弥散荧光,加样孔清晰,表明所提取的样品DNA纯度较高;紫外分光光度法测定结果显示,样品DNA的A260/A280值为2.053(在1.8~2.0范围内),表明所提取的样品DNA浓度较高[11]。将样品DNA稀释至适当浓度,以备后续试验使用。
2.2 SCoT引物筛选
以样品DNA为模板,参考文献[12]的条件对36条SCoT引物进行PCR扩增反应,参照“2.1”项下方法对PCR产物进行1.0%琼脂糖凝胶电泳、染色、成像,结果见图1。
由图1可见,编号为4、6、7、12、20、23、24、25、31、33、34、35的12条引物所得产物条带整齐、明亮,无弥散荧光;编号为2、5、8、9的4条引物所得产物的条带清晰、整齐、数量多,无弥散荧光;其余20条引物所得产物条带清晰度欠佳、不成条带,有明显的弥散荧光,表明产物降解明显。本课题组选择产物亮度最高的4号引物进行PCR扩增反应体系的优化试验。
2.3 SCoT-PCR扩增体系优化
2.3.1 正交试验 相关研究发现,DNA浓度、Mg2+浓度、dNTP浓度、引物浓度、Taq DNA聚合酶浓度(酶浓度以其活力单位U/mL表示)5个因素对SCoT-PCR反应体系有显著影响[2],因此本课题组对上述影响扩增反应的5个主要因素(分别以因素A、B、C、D、E表示)进行5因素4水平的正交设计,按L16(45)正交表筛选最佳扩增反应体系。以“2.1”项下获得的样品DNA为模板,采用“2.2”项下筛选的4号引物进行PCR反应,总反应体积为20µL。扩增条件:94℃预变性4 min;94℃变性30 s,50℃退火1 min,72℃延伸90 s,35个循环;72℃再延伸5

图1 36条引物扩增电泳图Fig 1 Amplification electrophoresis figure of 36 primers
min。参照“2.1”项下方法对PCR产物进行1.0%琼脂糖凝胶电泳、染色、成像。采用直观分析法[13]对成像后的产物扩增条带的清晰度、数目、亮度及背景干净程度进行评分[评分范围为1~16分,成像效果最好者(条带数目多、亮度强、背景清晰、无拖带杂带)得16分,效果最差者得1分,其余按照成像效果依次排序评分],并对评分结果进行统计分析。正交试验因素与水平见表2,正交试验设计和结果见表3,扩增产物的凝胶电泳图见图2。
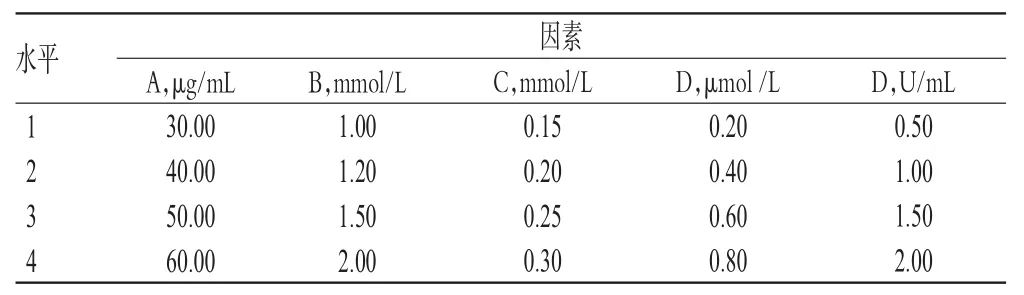
表2 因素与水平Tab 2 Factors and levels
由图2可知,不同因素和水平组合的扩增反应体系所得产物在条带数、清晰度和亮度方面均有差异;由表3可知,1~16号试验的扩增反应产物评分值分别为9、14、7、10、2、6、11、16、3、8、4、15、5、1、12、13。
2.3.2 正交试验结果分析 根据表3中的R值可知,各因素对扩增反应影响程度排序为Mg2+浓度(B)>Taq DNA聚合酶浓度(E)>dNTP浓度(C)>DNA浓度(A)>引物浓度(D)。根据表3中评分结果平均值可知,当DNA浓度为30 μg/mL时,所得产物评分的平均值10.00为最高;当Mg2+浓度为2.00 mmol/L时,所得产物评分的平均值13.50为最高;当dNTP浓度为0.20 mmol/L时,所得产物评分的平均值10.75为最高;当引物浓度为0.40 μmol/L时,所得产物评分的平均值9.75为最高;当TaqDNA聚合酶浓度为0.50 U/mL时,所得产物评分的平均值11.25为最高。综上,最优SCoT-PCR扩增反应体系确定为A1B4C2D2E1,即30.00 μg/mL DNA、2.00 mmol/L Mg2+、0.20 mmol/L dNTP、0.40 μmol/L引物、0.50 U/mL Taq DNA聚合酶(总反应体积20 μL)。
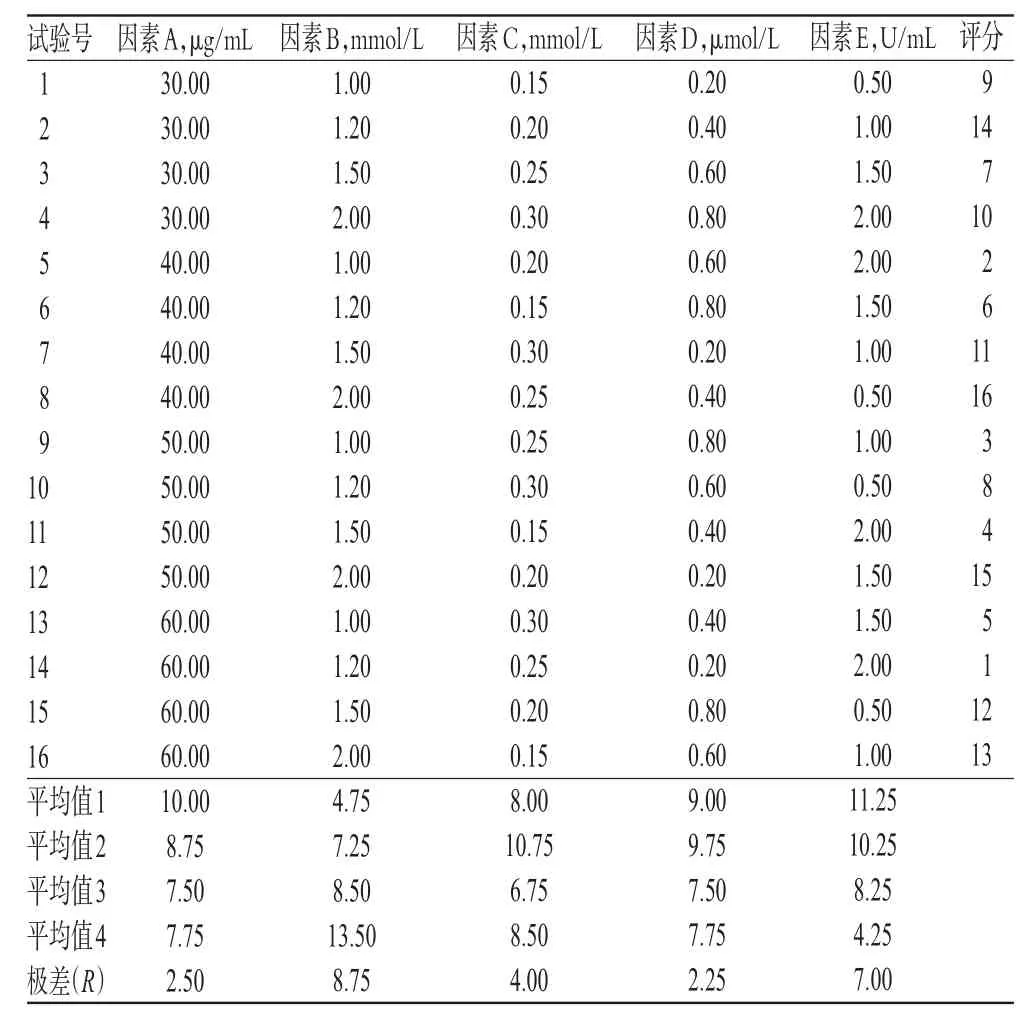
表3 正交试验设计与结果Tab 3 Orthogonal design and result
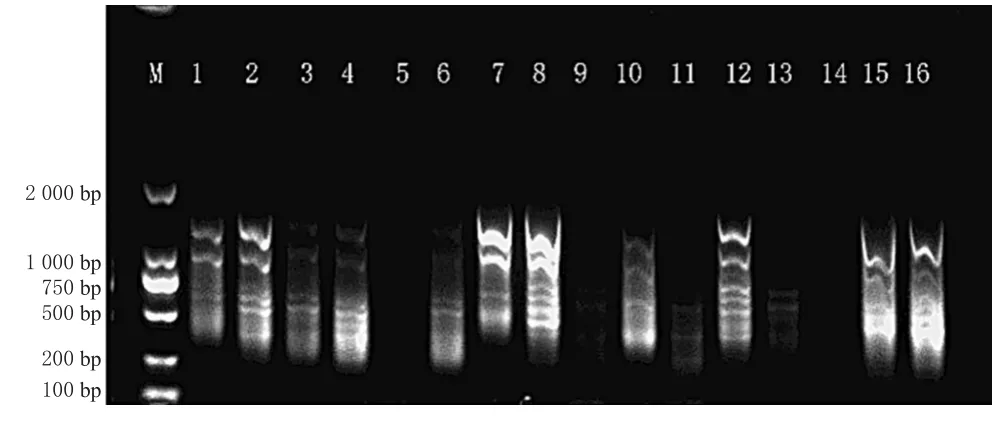
图2 SCoT-PCR扩增产物凝胶电泳图Fig 2 Electrophoretic diagram of SCoT-PCR amplifi cation products
3 讨论
IGS2-RFLP、ISSR、SCoT这3种分子标记技术均可用于亲缘关系分析、基因表达差异、分子标记辅助育种等方面的研究,但三者的区别主要在于:IGS2-RFLP构建指纹图谱优势更为明显,准确性和可重复性大大优于ISSR,但其多态性检测效率略低于ISSR;而对育种材料进行遗传多样性分析时,SCoT和ISSR所得产物多态性高、信息量大,能均匀地覆盖整个基因组,但SCoT由于本身可能是目的基因的一部分或与目的基因紧密连锁,在育种时筛选可利用性状的效用会高于ISSR[14]。
关于拳卷地钱的分子标记分析仅见于ISSR-PCR反应体系的研究[15]。本课题组以SCoT法对拳卷地钱DNA进行标记,并采用正交试验对SCoT-PCR反应体系进行优化,对各影响因素进行综合分析。不同因素同一水平试验结果的平均值反映了影响因素各水平对反应体系的影响程度,平均值越高,表明采用该水平的反应体系效果越好;R值则反映了各影响因素对反应体系的影响程度,R值越大,表明该因素影响越明显。本研究结果显示,各因素对SCoT-PCR扩增反应的影响程度排序为Mg2+浓度>Taq DNA聚合酶浓度>dNTP浓度>DNA浓度>引物浓度;其中Mg2+浓度和Taq DNA聚合酶浓度结果的R值分别为8.75和7.00,在5个因素中排前2位,表明这2个因素对试验结果的影响最为显著,故试验过程中应特别注意对这2个因素的设置。
综上所述,本研究所优化的DNA的SCoT-PCR反应体系,可为广西产拳卷地钱品种鉴定、遗传多样性评价及亲缘关系分析提供技术支持,进而为该药材的资源开发利用提供实验基础。
[1] 龙治坚,范理璋,徐刚,等.SCoT分子标记在植物研究中的应用进展[J].植物遗传资源学报,2015,16(2):336-343.
[2] 熊发前,唐荣华,陈忠良,等.目标起始密码子多态性(SCoT):一种基于翻译起始位点的目的基因标记新技术[J].分子植物育种,2009,7(3):635-638.
[3] 陈大霞,王钰,张雪,等.黄连属部分药用植物遗传多样性与亲缘关系的SCoT分析[J].中国中药杂志,2017,42(3):473-477.
[4] 崔健,胡福初,陈哲,等.榴莲蜜基因组DNA提取方法比较及SCoT反应体系的优化[J].分子植物育种,2017,15(4):1338-1346.
[5] 张安世,张中海,齐秀娟,等.猕猴桃SCoT遗传多样性分析及指纹图谱的构建[J].植物研究,2017,37(2):259-265.
[6] 中国科学院青藏高原综合科学考察队.西藏苔藓植物志[M].北京:科学出版社,1985:553.
[7] 朱华.广西地钱属药用植物资源调查和形态构造研究[C]//中国中医药学会.第7届全国中药标本馆专业学术讨论会论文集.成都:成都中医药大学,2002:161.
[8] Zinsmeister HD,王洁.苔藓植物是生物活性物质的一个资源吗?[J].国外医药植物药分册,1994,9(5):203-209.
[9] 国家中医药管理局《中华本草》编写组.中华本草[M].上海:上海科技出版社,1998:324-325.
[10] COLLARD BCY,MACKILL DJ.Start codon targeted(SCoT)polymorphism:a simple,novel DNAmarker technique for generating gene-targeted markers in plants[J].Pl Mol Biol Rep,2009,27(1):86-93.
[11] 张安世,邢智峰,刘永英.苔藓植物DNA不同提取方法的比较分析[J].河南科学,2009,27(5):559-562.
[12] 尚小红,严华兵,曹升,等.葛根SCoT-PCR反应体系优化及引物筛选[J].南方农业学报,2018,49(1):1-7.
[13] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[14] 赵梦然,陈强,张金霞,等.IGS2-RFLP、SCoT和ISSR在白灵侧耳遗传多样性分析中的比较研究[J].菌物学报,2013,32(4):682-689.
[15] 周雨晴,杜沛霖,王跃峰,等.拳卷地钱基因组DNA提取及ISSR-PCR扩增体系优化[J].时珍国医国药,2014,25(6):1498-1500.

