舒芬太尼后处理对大鼠心肌缺血再灌注损伤时Nrf2-ARE信号通路的影响
郭冲,岳霄,贾大林
(1.山东省肥城矿业中心医院 心内科,山东 肥城 271600;2.山东省肥城矿业中心医院内分泌科,山东 肥城 271600;3.中国医科大学附属第四医院,辽宁 沈阳 110033)
近年来,我国心肌梗死发病率及病死率居高不下,且呈逐年上升趋势,已成为威胁人们健康的重要因素[1]。再灌注作为减少心肌损伤、挽救患者生命的重要手段,已被广泛应用于临床,但某些情况下,再灌注治疗过程中也可能会导致心肌发生再灌注损伤而加剧心肌坏死[2]。研究表明[3],缺血后处理可减少缺血再灌注损伤,保护心肌,减小梗死面积。舒芬太尼作为高选择性阿片类激动剂,具有较强的镇痛作用,且对血流动力学影响较小,是心血管系统手术麻醉常用药物[4]。研究表明[5],舒芬太尼后处理能够减轻心肌缺血再灌注损伤,具有心肌保护作用。但其具体作用机制尚未完全清楚。有研究指出[6],氧化应激是心肌缺血再灌注损伤的重要病理基础。核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)作为一种重要的转录因子,与细胞自我保护作用密切相关,是调控氧化应激反应的关键性因子,与抗氧化物反应元件(antioxidant response elements,ARE)结合形成体内重要的抗氧化应激Nrf2/ARE通路而启动的抗氧化应激反应[7]。本研究通过复制大鼠心肌缺血再灌注损伤模型,探讨舒芬太尼后处理对再灌注时Nrf2-ARE信号通路的影响,以期为心肌缺血再灌注损伤机制研究提供基础资料。
1 材料与方法
1.1 主要试剂和设备
舒芬太尼购自宜昌人福药业有限责任公司(批号:1140712,批准文号:国药准字 H20054172),2、3、5-三苯基氯化四氮唑(2,3,5-triphenylchloride tetrazole,TTC)购自美国Sigma公司,TUNEL细胞凋亡检测试剂盒购自美国Roche公司,Trizol总RNA提取试剂盒购自上海吉玛制药技术有限公司,逆转录试剂盒和PCR试剂盒均购自日本TaKaRa公司,Nrf2、血红素加氧酶1(heme oxygenase 1,HO-1)、醌氧化还原酶1(quinone oxidoreductase 1,NQO1)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、谷胱甘肽-S-转移酶μ2(glutathione-S-transferase μ2,GSTμ2)及内参引物均由上海生工生物工程有限公司设计合成,兔抗Nrf2多克隆抗体购自美国Abcam公司,兔抗鼠HO-1多克隆抗体和小鼠GSTμ2单克隆抗体均购自美国Cell Signaling公司,NQO1和SOD1多克隆抗体均购自美国Santa Crutz公司,Notocord多道生理记录仪购自北京拜安吉科技有限公司,动物呼吸机购自上海欣曼科教设备有限公司,实时荧光定量聚合酶链反应(qRT-PCR)仪购自美国ABI公司,凝胶电泳系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 实验动物及分组 30只健康雄性SD大鼠购自河南实验动物中心[合格证号:SCXK(豫)2010-0002],4~5月龄,体重(250±20)g,自由饮水、进食,饲养于标准环境中。采用随机数字表法将大鼠分为假手术组、缺血再灌注组和舒芬太尼后处理组,每组10只。
1.2.2 复制大鼠心肌缺血再灌注损伤模型 所有大鼠利用5%戊巴比妥钠腹腔注射麻醉,剂量40 mg/kg,固定,右颈内静脉置管进行给药、补液,行颈动脉穿刺置管,连接Notocord多道生理记录仪对心电图、心率、血压、血流动力学指标进行检测,行气管切开并置入导管,连接动物呼吸机,进行机械通气,频率70~80次/min,氧流量3 L/min,浓度21%,维持动脉血二氧化碳分压(PaCO2)在35~45 mmHg,pH在7.35~7.45。消毒后,于左侧第3和第4肋间行开胸术,逐层钝性分离肌肉,将胸膜和心包膜剥离,使心脏充分暴露后,将6-0无损伤缝合线从左冠状动脉前降支下穿过,平衡30 min,将缝合线拉紧,使冠状动脉血流阻断30 min,成功标志是冠状动脉结扎处以下心外膜呈发绀苍白,出现一过性心律失常,心电图ST段抬高明显;将缝合线松开,使心肌恢复再灌注4 h,成功标志是心外膜重新充血,呈红润状,心电图ST段明显下降。假手术组大鼠仅将6-0无损伤缝合线从左冠状动脉前降支下穿过而不拉紧,其余步骤同缺血再灌注组和舒芬太尼后处理组大鼠。舒芬太尼后处理组大鼠于再灌注前5 min按1μg/kg的剂量经股静脉注入舒芬太尼,假手术组和缺血再灌注组则注入等量的生理盐水。3组大鼠均成功复制心肌缺血再灌注损伤模型,未出现死亡。
1.2.3 3组大鼠心肌梗死面积检测 3组大鼠于心肌恢复再灌注4 h时,每组随机取5只大鼠,经颈静脉将2%伊文思蓝2 ml快速推注,迅速将心脏摘除,将左心室沿垂直于心脏纵轴方向从心底向心尖部切片,厚度约2 mm。置于TTC液中,于37℃避光恒温孵育15 min,取出后,磷酸盐缓冲溶液(phosphate buffered saline solution,PBS)冲洗3次,用10%甲酸固定60 min,自然光下拍照,染色结果:缺血组织呈砖红色,梗死组织呈灰白色。利用Image J图像分析软件对心肌梗死范围进行分析,心肌梗死面积=心肌梗死区面积/缺血区面积×100%。
1.2.4 3组大鼠心脏组织病理学检查 3组大鼠于心肌恢复再灌注4 h时,每组随机取5只大鼠,处死后,取各组大鼠心尖部心脏组织,甲醛固定24 h,脱水、透明、石蜡包埋、切片,HE染色后,于高倍镜下对各组大鼠心肌组织进行观察。
1.2.5 3组大鼠心肌细胞凋亡检测 3组大鼠于心肌恢复再灌注4 h时,每组随机取5只大鼠,处死后,取各组大鼠左心室前壁心肌组织,按照1.2.4中的方法制备石蜡标本,按照TUNEL细胞凋亡检测试剂盒说明书完成操作,于高倍镜下进行观察:正常心肌细胞核呈深蓝色,凋亡细胞核中出现棕黄色或棕褐色颗粒且有凋亡细胞形态学改变。于高倍镜下各取10个视野,计数凋亡细胞数,凋亡指数(apoptosis index,AI)=凋亡细胞数/总细胞数×100%。
1.2.6 qRT-PCR技术检测3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因表达 3组大鼠于心肌恢复再灌注4 h时,每组随机取5只大鼠,处死后,取各组大鼠左心室心肌组织,研磨后,加入细胞裂解液,用Trizol总RNA提取试剂盒对总RNA进行提取并检测浓度。用逆转录试剂盒逆转录为模板单链cDNA,以cDNA为模板进行PCR。引物序列见表1,PCR反应条件:95℃ 1 min,92℃ 30 s,60℃ 30 s,75℃ 30 s,连续进行40次循环,每个样品均设3个平行反应复孔。用2-△△Ct法对心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因相对表达量进行计算。
1.2.7 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白表达 3组大鼠于心肌恢复再灌注4 h时,每组随机取5只大鼠,处死后,取各组大鼠左心室心肌组织,研磨后,加入细胞裂解液,用总蛋白提取试剂盒对总蛋白进行提取,利用BCA蛋白检测试剂盒检测蛋白纯度。取30μg总蛋白,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电转移至聚偏氟乙烯膜上,用5%脱脂牛奶封闭60 min,TBST洗膜3次,分别将一抗兔抗Nrf2多克隆抗体、兔抗鼠 HO-1多克隆抗体、NQO1多克隆抗体、SOD1多克隆抗体和小鼠GSTM2单克隆抗体(稀释比例为:1︰600、1︰800、1︰1 200、1︰1 500和1︰2 000)加入,4℃过夜孵育,TBST洗膜3次,加入二抗,37℃恒温孵育120 min,TBST洗膜3次,加入ECL暗室下反应20 min,拍照,利用Image J图像分析软件对条带进行分析,获得大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白相对表达量。
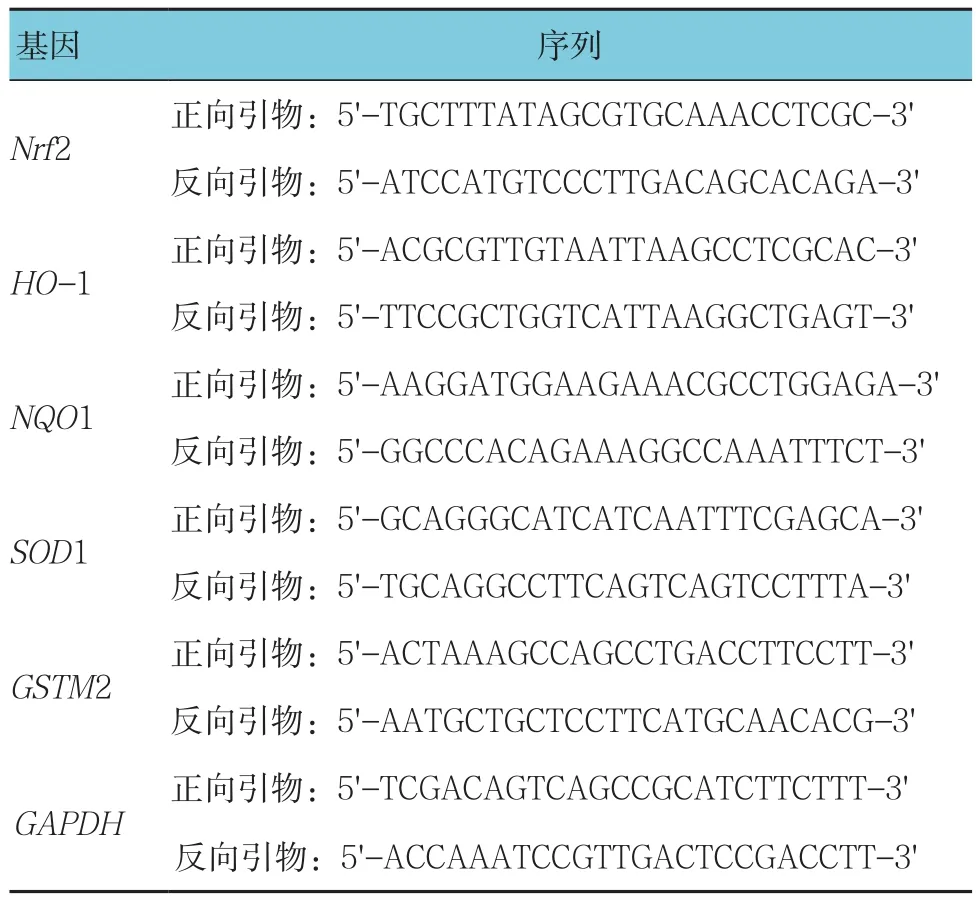
表1 基因序列
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料采用均数±标准差(±s)表示,经正态性检验,资料符合正态分布,方差齐,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠心脏组织病理学比较
免疫组织化学结果显示,假手术组大鼠心肌细胞排列整齐、规则;缺血再灌注组大鼠心肌细胞出现肿胀、破裂,出现大量炎症细胞浸润;相比于缺血再灌注组,舒芬太尼后处理组大鼠心肌细胞排列较好,炎症细胞减少。见图1。
2.2 3组大鼠心肌梗死面积和心肌细胞凋亡比较
与假手术组比较,缺血再灌注组和舒芬太尼后处理组大鼠心肌细胞凋亡指数和梗死面积均增加,与缺血再灌注组比较,舒芬太尼后处理组大鼠心肌细胞凋亡指数和梗死面积均降低,差异均有统计学意义(P<0.05)。见表2和图 2。
2.3 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因表达比较
与假手术组比较,缺血再灌注组和舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2 mRNA相对表达量降低,差异均有统计学意义(P<0.05);与缺血再灌注组比较,舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2 mRNA相对表达量升高,差异均有统计学意义(P<0.05)。见表3。
2.4 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白表达比较
与假手术组比较,缺血再灌注组和舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白相对表达量均降低,差异均有统计学意义(P<0.05);与缺血再灌注组比较,舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白相对表达量升高,差异均有统计学意义(P<0.05)。见表4和图 3。

图1 3组大鼠心脏组织病理检查结果 (×400)
表2 3组大鼠心肌梗死面积和心肌细胞凋亡比较(n=5,%,±s)
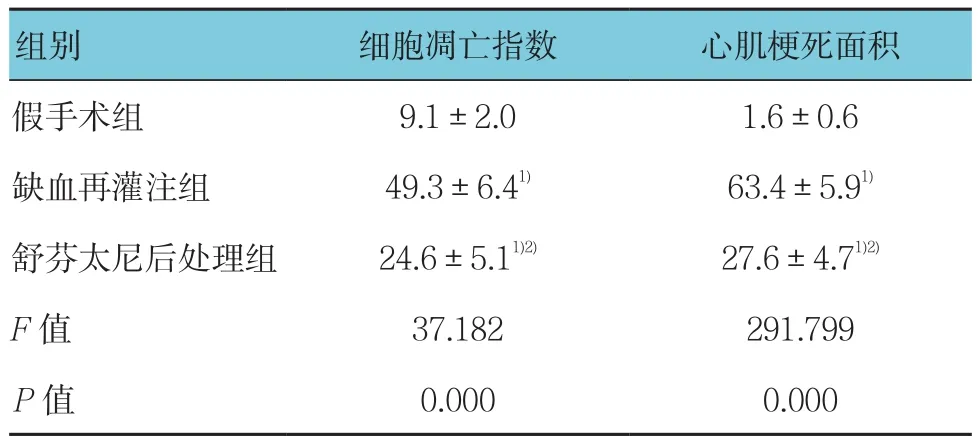
表2 3组大鼠心肌梗死面积和心肌细胞凋亡比较(n=5,%,±s)
注:1)与假手术组比较,P<0.05;2)与缺血再灌注组比较,P<0.05
组别 细胞凋亡指数 心肌梗死面积假手术组 9.1±2.0 1.6±0.6缺血再灌注组 49.3±6.41) 63.4±5.91)舒芬太尼后处理组 24.6±5.11)2) 27.6±4.71)2)F值 37.182 291.799 P值 0.000 0.000
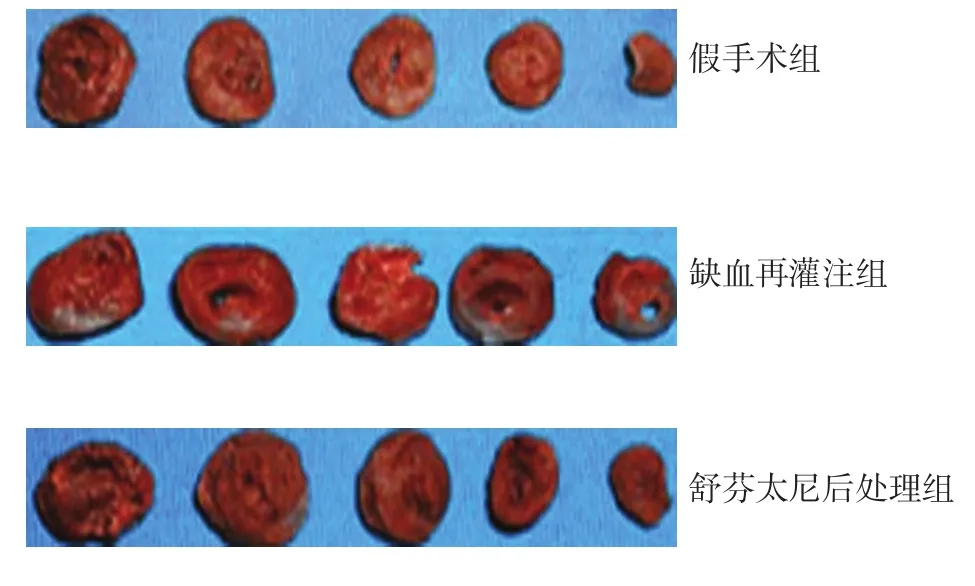
图2 3组大鼠心肌梗死面积
表3 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因表达比较 (n=5,±s)
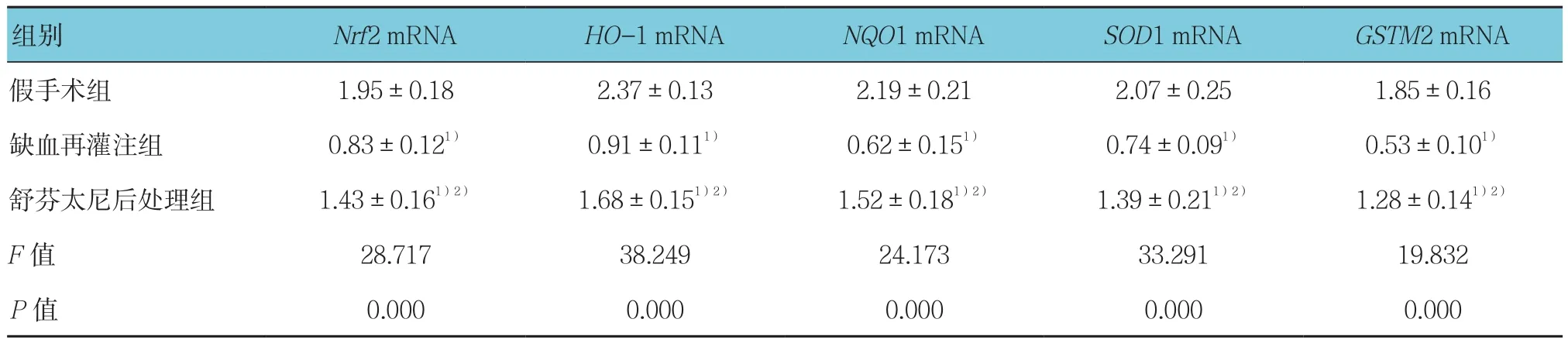
表3 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因表达比较 (n=5,±s)
注:1)与假手术组比较,P<0.05;2)与缺血再灌注组比较,P<0.05
组别 Nrf2 mRNA HO-1 mRNA NQO1 mRNA SOD1 mRNA GSTM2 mRNA假手术组 1.95±0.18 2.37±0.13 2.19±0.21 2.07±0.25 1.85±0.16缺血再灌注组 0.83±0.121) 0.91±0.111) 0.62±0.151) 0.74±0.091) 0.53±0.101)舒芬太尼后处理组 1.43±0.161)2) 1.68±0.151)2) 1.52±0.181)2) 1.39±0.211)2) 1.28±0.141)2)F值 28.717 38.249 24.173 33.291 19.832 P值 0.000 0.000 0.000 0.000 0.000
表4 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白表达比较 (n=5,±s)
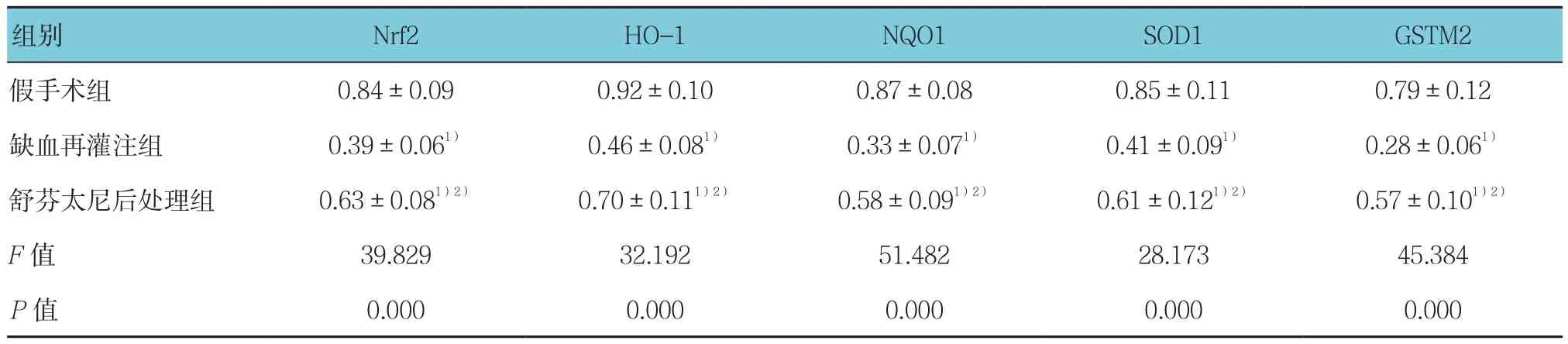
表4 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白表达比较 (n=5,±s)
注:1)与假手术组比较,P<0.05;2)与缺血再灌注组比较,P<0.05
组别 Nrf2 HO-1 NQO1 SOD1 GSTM2假手术组 0.84±0.09 0.92±0.10 0.87±0.08 0.85±0.11 0.79±0.12缺血再灌注组 0.39±0.061) 0.46±0.081) 0.33±0.071) 0.41±0.091) 0.28±0.061)舒芬太尼后处理组 0.63±0.081)2) 0.70±0.111)2) 0.58±0.091)2) 0.61±0.121)2) 0.57±0.101)2)F值 39.829 32.192 51.482 28.173 45.384 P值 0.000 0.000 0.000 0.000 0.000
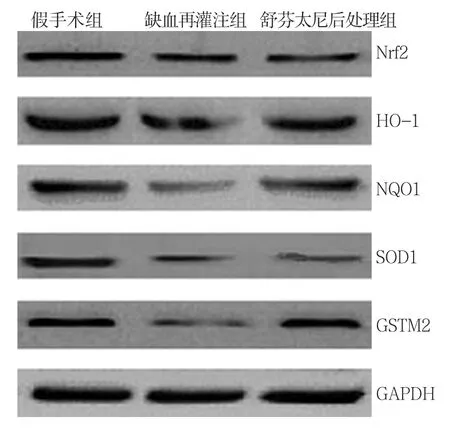
图3 3组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2蛋白表达
3 讨论
心肌缺血再灌注损伤作为心肌梗死重要的致死原因,目前越来越受到临床的重视。研究表明[8],某些药物后处理可通过激发或模拟自身内源性保护物质或激活某些信号通路而保护心肌。舒芬太尼作为心血管手术常用的麻醉药物,具有良好的镇痛效果,且对血流动力学影响较小,动物实验表明[9],舒芬太尼可有效减轻心肌缺血再灌注损伤大鼠心肌损伤。本研究复制了大鼠心肌缺血再灌注损伤模型,结果显示,与假手术组比较,缺血再灌注组大鼠心肌细胞出现肿胀、破裂,出现大量炎症细胞浸润,心肌细胞凋亡指数和梗死面积均显著增加,提示大鼠缺血再灌注模型复制成功。本研究参考有关文献[10],于心肌再灌注前5 min按1μg/kg的剂量将舒芬太尼经股静脉注入,结果显示,相比于缺血再灌注组,舒芬太尼后处理组大鼠心肌细胞排列较好,炎症细胞减少,心肌细胞凋亡指数和梗死面积均降低,说明舒芬太尼后处理可有效保护大鼠心肌细胞,减轻缺血再灌注损伤。
Nrf2作为一种转录相关因子,在细胞自我保护中发挥重要的作用,是机体氧化应激反应中关键性调控因子[11]。研究表明[12],当细胞受外界不良刺激时,胞外的Nrf2可转移至胞核,与ARE形成Nrf2/ARE通路而启动下游一系列蛋白表达,包括Ⅱ相解毒酶及抗氧化酶的表达。HO-1、NQO1和GSTM2是受Nrf2/ARE通路调控的重要的Ⅱ相解毒酶,是重要的内源性抗氧化物质[13],SOD1作为重要的抗氧化酶,在清除细胞毒性的超氧化物自由基、抗氧化应激反应中发挥关键性作用[14]。本研究显示,与假手术组比较,缺血再灌注组和舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因和蛋白相对表达量均降低,说明Nrf2/ARE信号通路异常,导致其下游抗氧化应激反应基因表达异常可能是发生缺血再灌注损伤的重要原因。本研究显示,与缺血再灌注组比较,舒芬太尼后处理组大鼠心肌组织中Nrf2、HO-1、NQO1、SOD1和GSTM2基因和蛋白相对表达量均升高,说明舒芬太尼后处理可促使Nrf2以及其下游Ⅱ相解毒酶及抗氧化酶的表达,从而发挥内源性的抗氧化应激作用。
综上所述,舒芬太尼后处理可有效减轻缺血再灌注损伤大鼠心肌梗死面积及细胞凋亡,其机制可能通过激活Nrf2/ARE信号通路促使其下游Ⅱ相解毒酶及抗氧化酶的表达,从而有效对抗氧化应激损伤。
[1]司向,翟屹,施小明.中国慢性非传染性疾病预防控制能力评估[J].中华流行病学杂志,2014,35(6): 675-679.
[2]MESSNER F,GRAHAMMER J,HAUTZ T,et al.Ischemia/reperfusion injury in vascularized tissue allotransplantation: tissue damage and clinical relevance[J].Curr Opin Organ Transplant,2016,21(5): 503-509.
[3]KHAN A R,BINABDULHAK A A,ALASTAL Y,et al.Cardioprotective role of ischemic postconditioning in acute myocardial infarction: a systematic review and meta-analysis[J].Am Heart J,2014,168(4): 512-521.
[4]MINKOWITZ H S.A review of sufentanil and the sufentanil sublingual tablet system for acute moderate to severe pain[J].Pain Manag,2015,5(4): 237-250.
[5]赵仙雅,顾尔伟,鲁显福,等.舒芬太尼后处理对大鼠心肌缺血再灌注时Ac-H3表达的影响[J].中华麻醉学杂志,2016,36(2):246-249.
[6]SUN N,WANG H,WANG L.Protective effects of ghrelin against oxidative stress,inducible nitric oxide synthase and inf l ammation in a mouse model of myocardial ischemia/reperfusion injury via the HMGB1 and TLR4/NF-κB pathway[J].Mol Med Rep,2016,14(3): 2764-2770.
[7]KUMAR H,KIM I S,MORE S V,et al.Natural product-derived pharmacological modulators of Nrf2/ARE pathway for chronic diseases[J].Nat Prod Rep,2014,31(1): 109-139.
[8]丁福祥,阿佳宜,刘同库.缺血后处理-心肌缺血再灌注损伤的另一种保护策略[J].中国老年学杂志,2013,33(18): 4649-4652.
[9]WANG X H,ZENG J F,LIN C,et al.Effects of morphine and sufentanil preconditioning against myocardial ischemic-reperfusion injury in rabbits[J].Int J Clin Exp Med,2015,8(9): 15692-15699.
[10]CHEN Q L,GU E W,ZHANG L,et al.Diabetes mellitus abrogates the cardioprotection of sufentanil against ischaemia/reperfusion injury by altering glycogen synthase kinase-3β[J].Acta Anaesthesiol Scand,2013,57(2): 236-242.
[11]OWUSU-ANSAH A,CHOI S H,PETROSIUTE A,et al.Triterpenoid inducers of Nrf2 signaling as potential therapeutic agents in sickle cell disease: a review[J].Front Med,2015,9(1):46-56.
[12]AHMED S M,LUO L,NAMANI A,et al.Nrf2 signaling pathway: Pivotal roles in inf l ammation[J].Biochim Biophys Acta,2016,1863(2): 585-597.
[13]SAW C L,CINTRÓN M,WU T Y,et al.Pharmacodynamics of dietary phytochemical indoles I3C and DIM: Induction of Nrf2-mediated phase II drug metabolizing and antioxidant genes and synergism with isothiocyanates[J].Biopharm Drug Dispos,2011,32(5): 289-300.
[14]BAE J R,KIM S H.Impairment of SOD1-G93A motility is linked to mitochondrial movement in axons of hippocampal neurons[J].Arch Pharm Res,2016,39(8): 1144-1150.

