转GmDREB3基因小麦对大鼠免疫系统的影响
李 岩,韩 超,毛宏梅,石丽丽,陈 晨,赵金鹏,卓 勤
(中国疾病预防控制中心营养与健康所,北京 100050)
随着基因工程技术的发展,通过向小麦中转入抗逆基因,为减少干旱对作物造成的影响开创了新的途径。导入在植物干旱胁迫中起重要作用的转录因子脱水应答元件结合(DREB)基因,是近几年植物耐旱基因工程研究的重要方向[1]。到目前为止,通过基因工程技术转入DREB基因,已明显提高了拟南芥A、大麦、水稻、烟草、大豆等多种作物的耐旱性[2-3]。本课题的研究对象为转GmDREB3基因抗旱小麦,该小麦由中国农科院作物研究所从有持久耐盐性的大豆品种铁丰8号中克隆了DREB类转录因子基因GmDREB3,通过基因枪转化导入我国小麦主产区推广小麦品种—济麦22而获得。
在按照NY/T1102-2006“转基因植物及其产品食用安全检测大鼠90d喂养试验”进行常规毒性评价的基础上[4-5],本课题组对转基因小麦和亲本小麦谷剂量组大鼠及AIN93对照组大鼠的外周血全血淋巴细胞分型及血清细胞因子表达及肝肾组织免疫复合物沉积情况进行了检测,以了解转GmDREB3基因小麦对大鼠免疫系统相关指标的影响,为转GmDREB3基因抗旱小麦的安全性评价提供依据。
1 材料和方法
1.1 样品
转GmDREB3基因抗旱小麦MG11-1(16联鉴10)及亲本小麦(济麦-22)由中国农业科学院提供。
1.2 实验动物
SD大鼠(SPF级),140只,雌雄各半,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2016—0002。饲养地点:中国医学科学院实验动物所动物房,级别:屏障环境,许可证号:SYXK(京)2013-0019。
1.3 主要仪器
电子天平、全自动血细胞分析仪(XT-1800i)、日立7600全自动生化分析仪、流式细胞仪(apogee universal 50)(美国Luminex公司)、MAGPIX型多功能液态悬浮芯片系统。
1.4 主要试剂
大鼠流式抗体:Rat CD3 APC(557030)、Ms IgM Kpa ItCl APC(550883)、Rat CD4 FITC(561833)、Ms IgG2a Kpa ItCl FITC(554647)、Rat CD8a PerCP(558824)、Hu IL-4 PE-Cy7(560672)、Rat CD45RA APC-Cy7(561624)、Ms IgG1 Kpa ItCl APC-Cy7(557873)、Rat CD161a NKP-P1A PE(555009)、Ms IgG1 Kpa ItCl PE(550617),BD公司;免疫组化试剂:兔抗大鼠IgG H&L、Abcam山羊抗大鼠IgM- Mu chain,Abcam 公司;Milliplex大鼠细胞因子/趋化因子液相芯片磁珠试剂盒,美国Merk Millipore公司。
1.5 样品配制
根据转基因小麦和亲本小麦营养成分检测结果,以AIN93繁殖饲料配方为基础,在营养平衡的基础上,以饲料中最大掺入量作为高剂量组(76.6%),依次向下设立中剂量组(38.3%)、低剂量组(19.2%)。
1.6 分组
选取实验动物140只,随机分为7组,每组20只,雌、雄各半,试验开始时各动物体重之间的差异不超过平均体重的±20%。各组具体如下:CN组(AIN93对照组)、GL组(转基因小麦低剂量组)、GM组(转基因小麦中剂量组)、GH组(转基因小麦高剂量组)、nGL组(亲本小麦低剂量组)、nGM组(亲本小麦中剂量组)、nGH组(亲本小麦高剂量组)。
1.7 试验方法及指标检测
试验期间,动物自由进食、饮水。试验末期(第90d),动物空腹过夜,称解剖前体重,腹主动脉采集自凝血和抗凝血进行指标检测。
1.7.1 全血淋巴细胞分型 抗凝血用流式细胞仪检测T淋巴细胞(CD3+CD45RA-)、T淋巴细胞亚群(CD4+、CD8+)、B淋巴细胞(CD3-CD45RA+)、NK细胞(CD3-CD161a+)指标,按照抗体说明书操作:100 μL抗凝全血中同时加入5μL CD45RA-APC/Cy7、2μL CD4-FITC、5μL CD3-APC、5μL CD161a-PE、5μL CD8-PerCP 5种抗体,同时设置阴性空白、同型对照、单标记对照。轻轻混匀,室温避光保存30min。每管加入细胞裂解液1mL,轻轻混匀,避光约15min。待管内液体透亮,1 000 r/min离心5min,弃上清。每管加入1mL pH 7.2 PBS,轻轻混匀,1 000 r/min离心5min,弃去上清液。重新洗涤1次,用400μL PBS混匀后进行流式分析。
1.7.2 免疫球蛋白和补体检测 自凝血分离血清,按试剂盒说明,用全自动生化分析仪检测免疫球蛋白G、免疫球蛋白M、补体C3、补体C4。
1.7.3 血清细胞因子检测 用Magpix多功能液相芯片检测系统对8种细胞因子MIP-1a、IL-4、IL-1b、IL-2、IL-6、IL-10、IL-18、MCP-1进行检测。按照Milliplex大鼠细胞因子/趋化因子磁珠法检测试剂盒说明书操作:样品使用前10 000g 4 ℃离心10min,取上清进行检测。96 孔板每孔加200μL Assay Buffer,室温条件下密封、振荡10 min;去除Assay Buffer,加25μL标准品或对照品;背景孔和样品孔中加25μL Assay Buffer;加25μL血清基质到背景、标准品和对照孔中;每样品孔加25μL1∶2稀释的样品;振荡混匀,每孔加25μL微球后密封,室温避光震荡孵育2h;洗板2 次;加25μL 检测抗体,震荡孵育1h;加25μL链霉素标记的藻红蛋白,震荡孵育30min;洗板2 次;加125μL 鞘液,振荡重悬5min,采用多功能液态悬浮芯片系统检测;用Milliplex Analyte软件对数据进行分析。
1.7.4 免疫器官脏器重量和脏器系数 取动物的脾脏、胸腺组织并称重,计算脏体比=器官重量/动物体重×100%。
1.7.5 肝肾组织免疫复合物 对转基因小麦高剂量组、亲本小麦高剂量组和对照组肝、肾组织进行免疫复合物检查。二甲苯脱蜡、酒精梯度复水后,将玻片放入枸橼酸钠缓冲液(pH 6),微波炉修复;PBS清洗3次;用5% BSA封闭30min,甩干液体,滴加稀释的抗体IgM或IgG,37℃孵育2h。;取出,室温30min后PBS清洗3次;DAB显色;苏木素复染3~5min,自来水冲洗,盐酸酒精分化6~7s,自来水冲洗;分化、脱水、透明后封片。
1.8 统计分析
数据采用 SPSS软件进行统计分析,采用单因素方差分析法进行总体比较,以α=0.05作为显著性水平,发现差异采用Dunnett法对各剂量组与对照组比较,如发现差异则进一步对转基因组与相应亲本组进行比较。
2 结果与分析
2.1 免疫球蛋白和补体指标
由表1可见,雌雄大鼠IgG、IgM、C3、C4 指标7组之间比较均无显著性差异(P>0.05)。
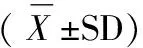
表1 转基因小麦对雌性大鼠免疫球蛋白和补体的影响
注:与CN组比较,P> 0.05
2.2 细胞表型指标
由表2可见,雌性大鼠:nGM组CD4细胞百分比与CN组和GM组相比明显减少(P<0.01),其他各剂量组与CN组相比均无显著性差异(P>0.05)。雄性大鼠:GM组和nGM组T淋巴细胞与CN组相比明显降低(P<0.05或P<0.01);GH、nGL、nGM、nGH组B淋巴细胞与CN组相比明显降低(P<0.05或P<0.01);nGL组NK细胞与CN组相比明显升高(P<0.05),但上述差异指标在转基因小麦与亲本小麦相应剂量组之间无显著性差异(P>0.05)。
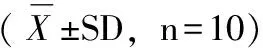
表2 转基因小麦对大鼠血液细胞表型的影响
注:与对照组比较,*P<0.05、**P<0.01;相应亲本组比较,△△P<0.01
2.3 细胞因子指标
对转基因小麦高剂量组、亲本小麦高剂量组及对照组大鼠血清的MIP-1a、IL-4、IL-1b、IL-2、IL-6、IL-10、IL-18、MCP-1细胞因子进行检测(表3)。其中IL-4、IL-2、IL-6 检测结果明显低于试剂盒相应细胞因子的最低检测浓度,IL-1β、IL-10的检测结果大部分在检出限附近,因此对上述细胞因子的检测结果不进行统计分析。对MIP-1a、IL-18、MCP-1的检测结果可见,MIP-1a、IL-18、MCP-1等3个指标各组之间无显著性差别(表4)。
表3各细胞因子的最低检测浓度汇总表单位单位:pg/mL
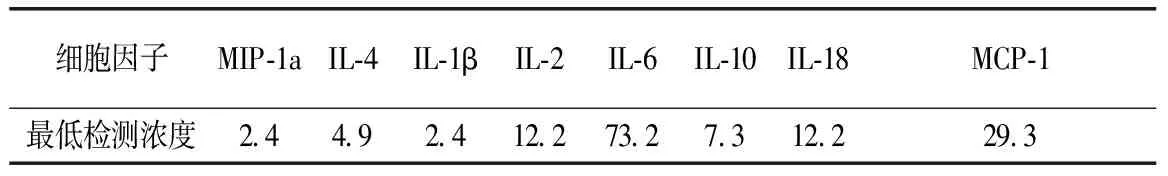
细胞因子MIP-1aIL-4IL-1βIL-2IL-6IL-10IL-18MCP-1最低检测浓度2.44.92.412.273.27.312.229.3
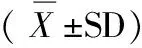
表4 转基因小麦对大鼠细胞因子MIP-1a、IL-18、MCP-1含量的影响
注:与对照组比较,P>0.05
2.4 鼠脏器重量及脏体比
由表5可见,以不同掺入量的转基因小麦和亲本小麦掺料给予大鼠90d,转基因小麦和亲本小麦各剂量组雄性大鼠胸腺重量与对照组相比明显降低(P<0.01),各剂量组转基因小麦雄性大鼠胸腺重量和亲本小麦相比无显著性差异。其余雌雄各剂量组大鼠脏器重量及脏体比与对照组相比均无显著性差异。
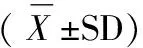
表5 转基因小麦对大鼠脏器重量及脏体比的影响
注:与对照组比较,**P<0.01。与相应亲本小麦组比较,P>0.05
2.5 肝、肾组织IgG、IgM免疫复合物检查
各组肝、肾组织均未见免疫复合物沉积见图1~4。
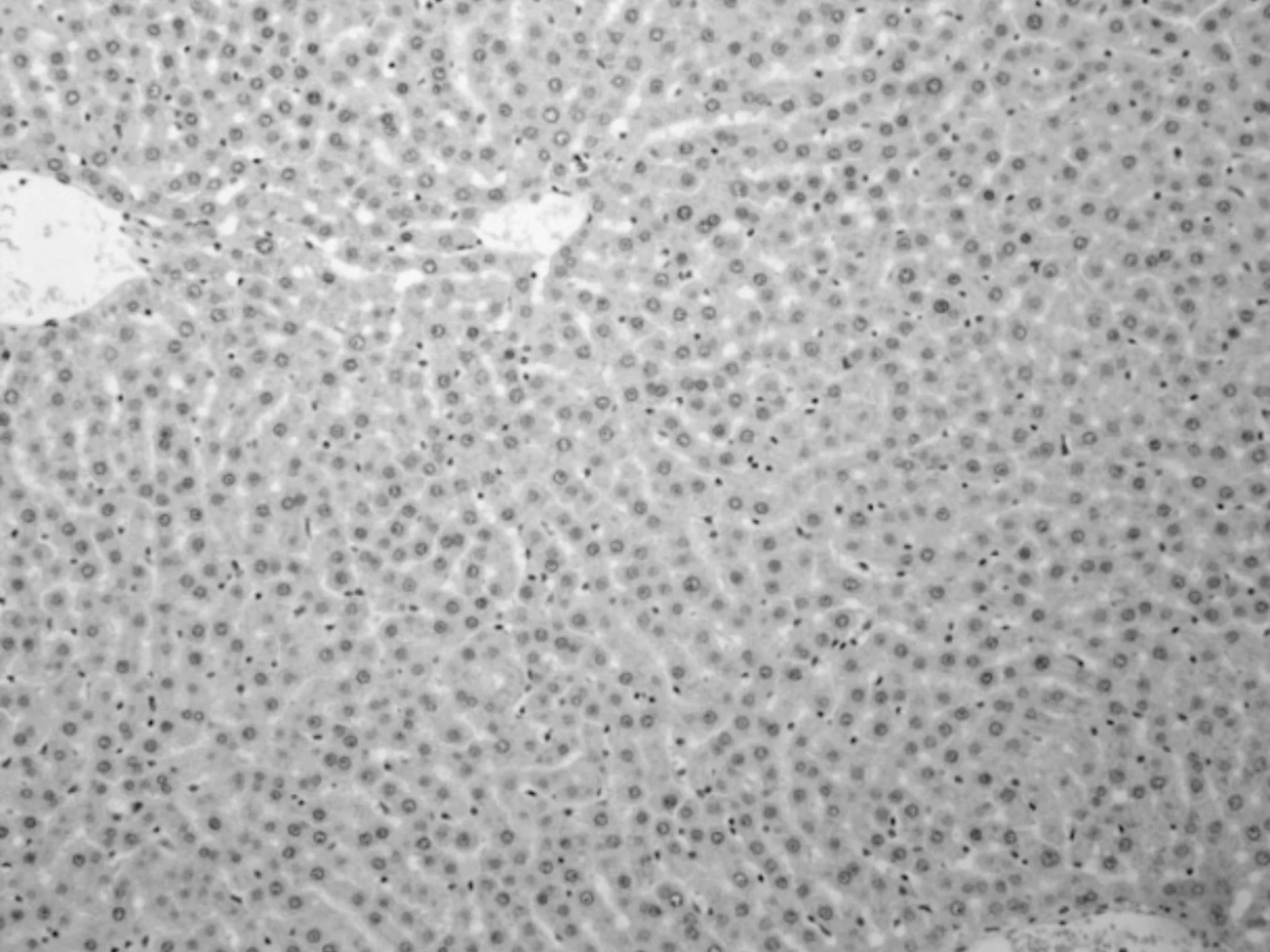
图1 肝组织IgG
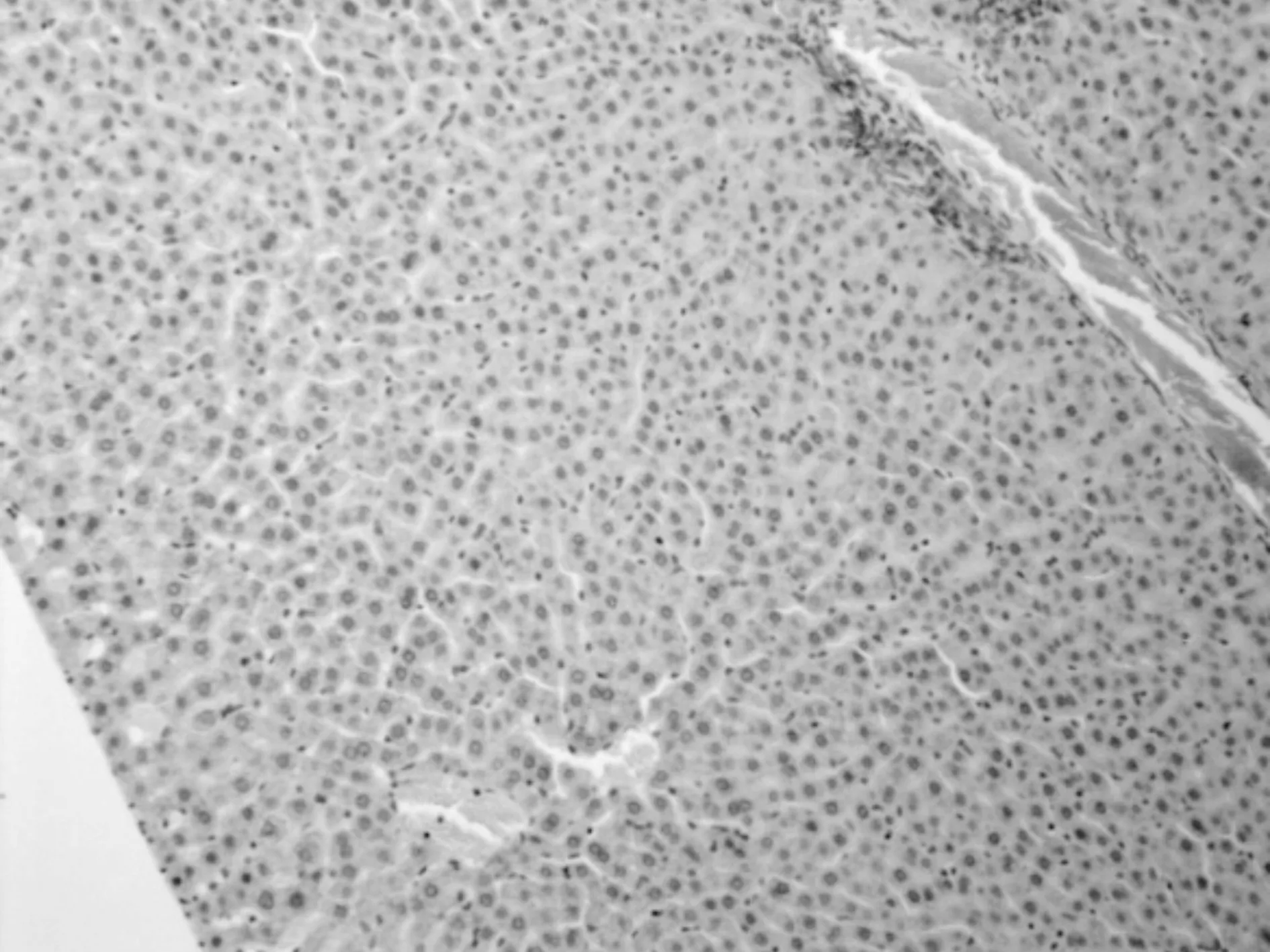
图2 肝组织IgM

图3 肾组织IgG
图4 肾组织IgM
3 结论与讨论
免疫毒性评价是转基因食品安全性评价的敏感指标,如Prescott V等[6]报道用含60%转Bt基因大米与含0.1%纯化Bt蛋白的饲料喂养大鼠28d,能诱导明显的抗Bt-IgG1反应,而大鼠90d喂养实验未观察到Bt蛋白对大鼠有毒性作用[7]。Finamore等[8]的研究也显示,转MON810基因玉米喂养断乳或老年小鼠30d或90d,对小鼠的肠道、脾脏、外周血淋巴细胞的细胞表型和血清细胞因子产生了不同的影响,但用转MON810基因玉米喂养大鼠的常规毒理学指标未检测到与转MON810相关的毒性反应。以上研究显示,转基因食品对机体免疫系统指标的改变明显早于常规毒理学指标的改变,因此,免疫毒性评价是评价转基因食品安全性的敏感指标,是转基因食品安全性评价必不可少的组成部分[9]。但是由于免疫系统的复杂性,目前没有一种实验方法能完全检测免疫毒性化合物所引起的免疫损伤,因此要确定外来物质是否对免疫系统结构或功能产生了影响,通常需要进行一系列试验。美国国家毒理学规划委员会(NTP)1988年推荐了啮齿类动物免疫毒性二级检测方案,由欧盟、美国、日本三方成员国组成的人用药品注册技术规范国际协调会(ICH)于2005对药品的免疫毒性评价达成共识,发布了人用药品免疫毒性研究指导原则[10]。
参考上述指导原则/检测方案,本课题选取大鼠的部分免疫指标进行检测,以了解转GmOREB3基因小麦90d喂养对大鼠免疫系统的影响。细胞表型结果显示,转基因小麦中剂量组雄性大鼠T淋巴细胞与对照组相比明显降低,转基因小麦高剂量组雄性大鼠B淋巴细胞与对照组相比明显降低,但上述指标转基因小麦组与亲本小麦相应剂量组比较无显著性差异,说明该差异并非由转入的基因引起。免疫反应涉及很多细胞因子,大多数细胞因子在正常大鼠体内含量较低,受限于大鼠multi-plex试剂盒限制,本课题选取与免疫毒性相关的MIP-1a、IL-4、IL-1b、IL-2、IL-6、IL-10、IL-18、MCP-1共8个指标对转GmOREB3基因小麦高剂量组、亲本小麦高剂量组和对照组大鼠血清进行检测。其中IL-4、IL-2、IL-6 检测结果明显低于试剂盒相应细胞因子的最低检测浓度,IL-1β、IL-10指标每组均有部分样本检测结果低于检测线,且高于检出限的样本例数各组间无明显差别。MIP-1a、IL-18、MCP-1的检测结果可见,各组间无显著性差异。综上可见,给予转GmOREB3基因小麦未引起大鼠血清细胞因子产生明显变化。脏器系数结果可见,各剂量组转基因小麦喂养大鼠的胸腺重量与对照组相比明显降低,但与相应的亲本小麦剂量组相比,未见显著性差异,说明该差异与转入的基因无明显相关性。其余各项指标各组之间均无显著性差异。
综上,转GmDREB3基因抗旱小麦喂养大鼠90d未见对大鼠免疫系统相关指标产生影响。当然,依据上述检测指标无法对转GmDREB3基因抗旱小麦的免疫毒性进行全面的评价,有必要从非特异性免疫功能分析、特异性体液和细胞免疫分析、肠道粘膜免疫分析等方面进行进一步深入研究,以全面了解转基因小麦对动物免疫系统的影响,为转基因食品的安全性评价提供更为可靠的数据,保障转基因食品的安全。◇
[1]Mallikarjuna G,Mallikarjuna K,Reddy MK,et al.Expression of OsDREB2A transcription factor confers enhanced dehydration and salt stress tolerance in rice(Oryza sativa L)[J]. Biotechnol Lett,2011,33(8):1689-1697.
[2]Li XP,Tian AG,Luo GZ,et al.Soybean DRE-binding transcription factors that are responsive to abiotic stresses [J]. Theoretical and Applied Genetics,2005,110(8):1355-1362.
[3]Ban QY,Liu GF,Wang YC.A dreb gene from Limonium bicolor mediates moledular and physiological responses to copper stress in transgenic tobacco [J]. J Plant Physiol,2011,168(5):449-458.
[4]European Food Safety Authority.Explanatory statement for the applicability of the Guidance of the EFSA Scientific Committee on conducting repeated-dose 90-day oral toxicity study in rodents on whole food/feed for GMO risk assessment [J]. EFSA Journal,2014,12(10):3871.
[5]中华人民共和国农业部.中华人民共和国农业行业标准.NY/T1102-2006 转基因植物及其产品食用安全检测 大鼠90d喂养试验[S].
[6]Stine Kroghsbo,Charlotte Madsen,Morten Poulsen,et al.Immunotoxicological studies of genetically modified rice expressing PHA-E lectin or Bt toxin in Wistar rats [J]. Toxicology,2008,245(1):24-34.
[7]Hammond BG,Dudek R,Lemen JK,et al.Results of a 90-day safety assurance study with rats fed grain from corn borer-protected corn [J]. Food Chem Toxicol,2006,44(7):1092-1099.
[8]Alberto Finamore,Marianna Roselli,Serena Britti,et al.Intestinal and peripheral immune response to MON810 maize ingestion in weaning and old mice [J]. J Agric Food Chem,2008,56(23):11533-11539.
[9]Momma K,Hashimoto W,Yoon H J,et al.Safety assessment of rice genetically modified with soybean glycinin by feeding studies on rats[J]. Biosci Biotechnol Biochem,2000,64(9):881-886.
[10]ICH:S8 (Step 4)Immunotoxicity Studies For Human Pharmaceuticals[S].

