应用2周龄ICR小鼠建立CVA16感染模型
王辉强,刘尚裕,李玉环
应用2周龄ICR小鼠建立CVA16感染模型
王辉强,刘尚裕,李玉环
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所病毒室
Enterovirus 71(EV71)和 coxsackievirus A16(CVA16)都属于小核糖核酸病毒科的单正链 RNA 病毒,是引起手足口病的两个主要病原体[1]。临床上,这两种病毒的感染通常是自限性的,小部分感染常与神经系统疾病相关,包括无菌性脑膜炎、脑干脑炎和急性弛缓性麻痹等[2]。手足口病已成为一个严重的公共卫生问题,在日本、马来西亚、新加坡、越南、中国大陆等亚太地区存在周期性的爆发流行[3-5]。目前临床上尚无有效的抗病毒药物用于手足口病的预防和治疗。
抗病毒药物和疫苗的研发依赖于体内外筛选模型的建立,目前国内外CVA16 的动物模型主要是 1 周龄以内的乳鼠模型,但是利用 1 周龄以内的乳鼠进行抗病毒实验操作难度较大,给药途径和给药容量明显受限,而且 1 周龄以内的乳鼠免疫系统发育尚不完善,在进行药物体内药效评价时有一定的局限性[6]。有研究报道,利用干扰素 α/β 和 γ 受体缺陷型小鼠(AG129)适应传代获得的 CVA16 毒株可以感染 12 周龄的 AG129 小鼠,但是该模型缺乏干扰素应答,对于通过调节先天免疫发挥抗 CVA16 作用的药物无法评价其体内药效,并且相对于常用的 ICR 等小鼠,AG129 小鼠的实验成本会增加[7]。本实验室通过将 CVA16 的临床分离株在 ICR 乳鼠上的逐渐适应传代成功建立了 2 周龄 ICR 小鼠的感染模型,采用细胞病变(CPE)法测定感染小鼠心、脾、肺、肾、小肠、脑和肌肉组织的 CVA16 病毒滴度,并利用 Western blot 方法检测各组织中 CVA16 蛋白的表达。另外,利用该模型初步评价抗病毒药物利巴韦林(RBV)的体内抗 CVA16 的药效。该模型的建立可以更好地服务于抗 CVA16 药物和疫苗的研发,也可进行 CVA16 发病机制的研究。
1 材料和方法
1.1 材料
1.1.1 实验动物 孕龄 17 ~ 18 d 的 ICR 小鼠购自北京维通利华实验动物技术有限公司[SCXK(京)2012-0001],待小鼠分娩后记录乳鼠日龄,根据国家科学委员会设立的指导方针,按实验动物使用的 3R 原则给予人道的关怀。
1.1.2 细胞和病毒 Vero 细胞为本室自行传代保存。CVA16(shzh05-1/GD/CHN/2005)由中国疾病预防控制中心提供,于 Vero 细胞中传代,–80 ℃冰箱保存。细胞培养所用 MEM 培养基、胎牛血清及 PBS 均购自美国 Invitrogen 公司。
1.2 方法
1.2.1 病毒接种与传代实验方法 将 100 μl 的 CVA16 原液(大约 1 × 104TCID50)腹腔注射于 1 日龄 ICR 小鼠体内,9 d 后取后肢肌肉,经研磨得到组织研磨液后感染 Vero 细胞,待 90% 以上细胞出现细胞病变时收集病毒,于–80 ℃反复冻融 3 次后离心得到 CVA16-MA-I 毒种。将 CVA16-MA-I 毒种原液 100 μl 腹腔注射感染 6 日龄 ICR 小鼠,7 d 后取后肢肌肉,经研磨得到组织研磨液后感染 Vero 细胞,收集得到 CVA16-MA-II 毒种。再将 CVA16-MA-II 毒种原液 100 μl 感染 12 日龄 ICR 小鼠,7 d 后取后肢肌肉,经研磨得到组织研磨液后感染 Vero 细胞,收集得到 CVA16-MA-III 毒种。12 日龄 ICR 小鼠腹腔注射感染 CVA16-MA-III 毒种原液 100 μl,7 d 后取后肢肌肉,经研磨得到组织研磨液后感染 Vero 细胞,收集得到 CVA16-MA-IV 毒种。利用 CVA16-MA-IV 毒种原液 100 μl 感染 2 周龄 ICR 小鼠,7 d 后取后肢肌肉,经研磨得到组织研磨液后感染 Vero 细胞,收集得到 CVA16-MA-V毒种。
1.2.2 适应毒株 CVA16-MA-V 的 LD50测定 将 CVA16-MA-V 毒种以1 × 100、1 × 10-1、1 × 10-2、1 × 10-34 个稀释度腹腔注射感染 2 周龄 ICR 小鼠,100 μl/只,观察小鼠死亡情况,记录死亡数并计算出 CVA16 对 2 周龄 ICR 小鼠的 LD50感染量,并作为后续实验感染量的基础。
1.2.3 小鼠组织中 CVA16 病毒滴度和病毒蛋白测定 将 CVA16-MA-V 毒种采用腹腔注射方式感染 2 周龄 ICR 小鼠(10 LD50),7 d 后采集小鼠心、脾、肺、肾、小肠、脑和肌肉组织,每种组织分两份并称重。将其中一份组织研磨得到的研磨液稀释后,感染 Vero 细胞(细胞数 3 ×104/孔)进行病毒滴度测定,在 72 h 后观察 CPE 并计算 TCID50。另一份组织采用动物组织蛋白提取试剂提取蛋白,采用 BCA 定量后进行 Western blot 检测。一抗 CVA16 和 β-actin 均 4 ℃孵育过夜。
1.2.4 利巴韦林体内药效评价 将 CVA16-MA-V 毒种10 LD50采用腹腔注射方式感染 2 周龄 ICR 小鼠(15 只),感染 1 h 后,用 50 mg/kg 的利巴韦林进行腹腔注射给药,正常对照组和病毒对照组腹腔注射等量的生理盐水,每天给药 1 次,共 7 d。每组随机选取 5 只小鼠,在末次给药后采集后肢肌肉组织,进行病毒滴度测定和病毒蛋白检测。另外 10 只小鼠观察发病及死亡情况,共观察 14 d。
1.2.5 病变(毒力)判定标准 根据临床表现划分 5 个等级:4 代表死亡;3 代表后肢瘫痪或垂死;2 代表后肢无力;1 代表毛发上竖散乱;0 代表正常。
1.3 统计学处理
采用 SPSS13.0 统计程序的卡方检验法比较存活率,并用 Kaplan-Meier 法比较平均生存时间。
2 结果
2.1 建立 2 周龄 CVA16 感染致死的 ICR 小鼠模型
首先,我们对适应传代获得的 CVA16-MA-V 毒种进行 LD50的测定,图 1 结果显示,不同稀释度的 CVA16-MA-V毒种采用腹腔注射方式感染 2 周龄 ICR 小鼠后,1 × 100、1 × 10-1、1 × 10-2稀释度的感染量小鼠全部死亡,而 1 × 10-3稀释度的小鼠一半发生死亡,CVA16-MA-V 毒种的 LD50为 1 × 10-3稀释度,经 Vero 细胞上病毒滴度检测,CVA16-MA-V 毒种的 LD50约为 10 TCID50。
用 10 LD50的 CVA16-MA-V 感染 2 周龄的 ICR 小鼠,小鼠感染后逐渐出现毛发散乱、后肢无力、后肢瘫痪的症状。后肢麻痹无力在发病初期是发展较为缓慢的,在死亡前 1 ~ 2 d 后肢麻痹无力发展为后肢瘫痪。在整个感染过程中,小鼠的体重发生显著的下降(图 2A)。另外,原 CVA16 毒株不能有效感染 1 周龄以上的小鼠,对于 1 周龄以下的小鼠可以感染,但是不会出现死亡。CVA16-MA-V 毒株可以对 2 周龄以内的小鼠造成感染死亡,但是 3 周龄及以上的 ICR 小鼠腹腔注射 CVA16-MA-V 后没有观察到发病症状和死亡。
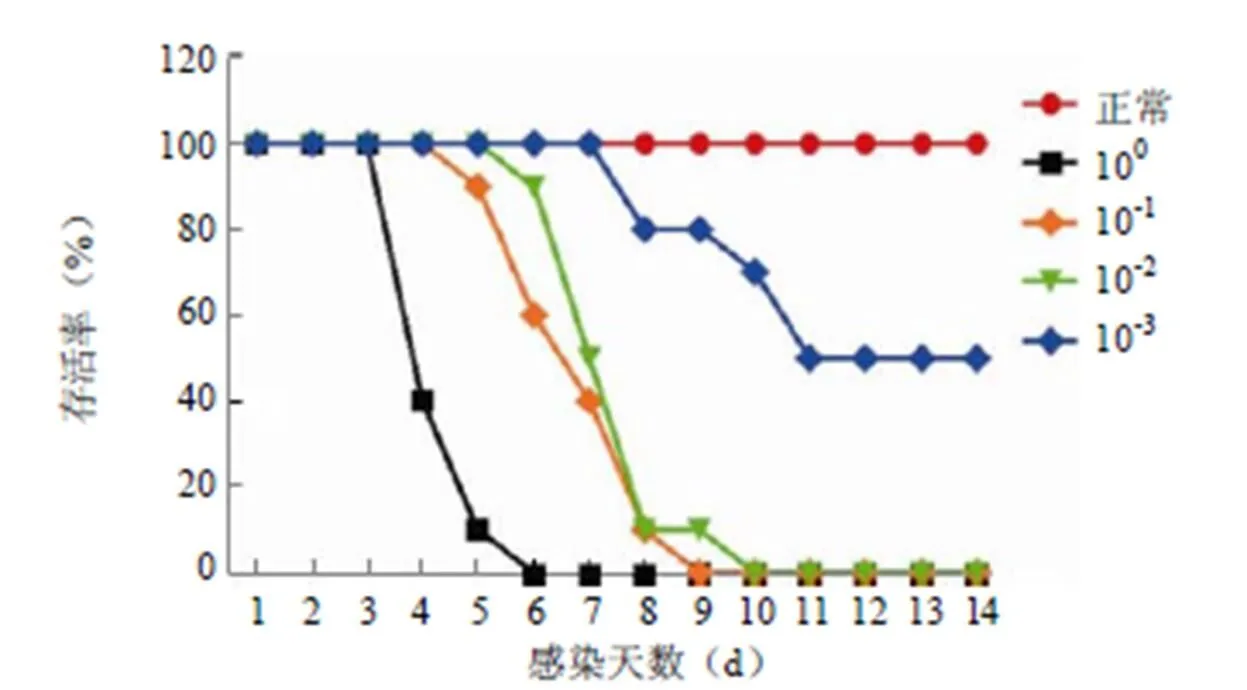
图 1 CVA16-MA-V 感染 ICR 小鼠的剂量依赖性
2.2 CVA16-MA-V 在感染 ICR 小鼠中的组织分布
采用腹腔注射方式,用 10 LD50的 CVA16-MA-V 感染 2 周龄的 ICR 小鼠,在感染后 7 d,采集小鼠的心脏、脾脏、肺、肾、脑、肠以及后肢肌肉组织。将各组织研磨后的组织研磨液感染 Vero 细胞,采用 CPE 的方法检测发现,在心脏、脾脏、肾脏、肠道和肌肉中均可检测到病毒(图 3A),且后肢肌肉中病毒载量最高。然而,在肺和大脑中没有检测到病毒。另外,用 Western blot 方法对各组织蛋白进行分析。结果如图 3B 所示,在心脏、脾脏、肾脏、肠和肌肉中也检测到 CVA16 蛋白表达,但在肺和大脑中均未检测到病毒蛋白。

图 2 利巴韦林对CVA16-MA-V 感染小鼠的抗病毒作用(A:小鼠感染9 d 内的体重;B:Western blot 检测小鼠肌肉中CVA16 的蛋白表达;C:小鼠组织的病毒滴度;D:小鼠感染14 d 的存活率;与病毒对照组比较,**P < 0.05)
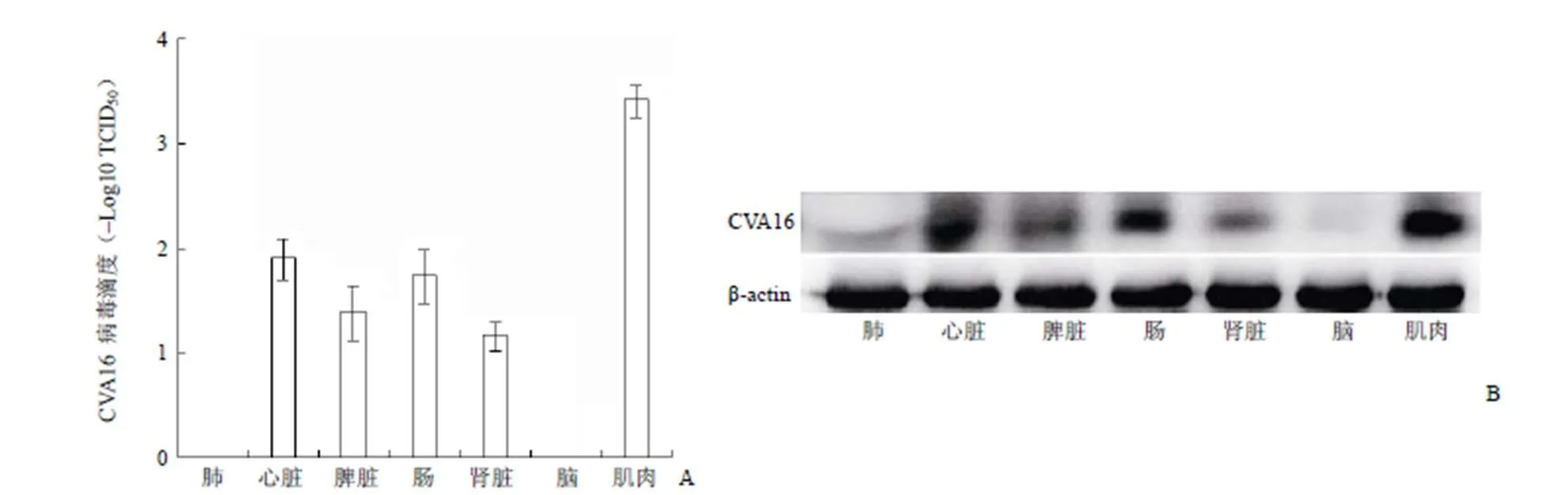
图 3 CVA16 感染后 7 d 小鼠组织中的病毒载量(A:CPE 法;B:Western blot 法)
表 1 利巴韦林治疗对 CVA16-MA-V 感染小鼠的体重(g)影响

时间(d)正常对照组病毒对照组利巴韦林组 27.38 ± 0.477.45 ± 0.377.04 ± 0.48 48.35 ± 0.368.08 ± 0.428.13 ± 0.42 68.89 ± 0.507.59 ± 0.39**8.37 ± 0.78# 810.92 ± 0.976.34 ± 0.42**8.03 ± 0.89#
注:n = 10;与正常对照组比较,**< 0.01;与病毒对照组比较,#< 0.05。

表 2 利巴韦林治疗对 CVA16-MA-V 感染小鼠死亡比例和平均存活时间的影响
注:n = 10;与正常对照组比较,**< 0.01;与病毒对照组比较,##< 0.01。

图 4 利巴韦林治疗延缓 CVA16-MA-V 感染小鼠的发病过程(A:正常小鼠的临床评分;B:病毒对照组感染小鼠的临床评分;C:利巴韦林治疗组小鼠的临床评分)
2.3 利巴韦林抑制 CVA16 的体内复制,延缓发病过程
建立 2 周龄的 CVA16 感染模型后,我们进一步研究该模型的体内药效评价适应性,明确该模型是否适合于抗 CVA16 的药物体内药效评价及机制研究。采用腹腔注射方式,用 10 LD50的 CVA16-MA-V 感染 2 周龄的 ICR 小鼠,利巴韦林治疗组腹腔注射给药 50 mg/kg,每天 1 次,连续 7 d。结果显示,治疗 7 d 的受感染小鼠肌肉组织中的 CVA16 病毒蛋白含量明显减少(图 2B)。此外,50 mg/kg 利巴韦林明显降低感染小鼠后肢肌肉中的 CVA16 病毒滴度(图 2C)。同时,我们也观察到 50 mg/kg 的利巴韦林治疗后,小鼠的体重减轻得到延缓(表1 和图 2A),并增加了受感染小鼠的存活率(图 2D)。病毒对照组小鼠的平均生存时间(MST)为(7.6 ± 1.1)d,而利巴韦林治疗组的小鼠平均生存时间为(10.8 ± 2.8)d(表2),利巴韦林明显延长小鼠的存活时间。图 4 所示,病毒对照组小鼠出现毛发散乱、后肢无力、后肢瘫痪,8 d 内全部死亡,而利巴韦林可以延缓感染小鼠的发病过程,起到保护小鼠的作用。
3 讨论
EV71 和 CVA16 是引起 5 岁以下儿童手足口病的两大主要病原体,而手足口病的爆发严重影响了社会稳定。然而,目前尚无有效的药物用于预防或治疗手足口病[8]。缺乏合适的动物模型阻碍了抗手足口病药物的研发。目前国内外已经有许多实验室建立了 EV71 感染的不同模型,包括免疫缺陷小鼠和转基因小鼠等,并用于候选药物的体内药效评价[9-12]。
在之前的研究中,我们使用 2 周龄的 BALB/c 小鼠建立了 EV71 感染的动物模型,并利用该模型评价了许多候选化合物的体内抗 EV71 的药效[13]。此次我们通过逐代适应的方法,获得可以感染 2 周龄 ICR 小鼠的 CVA16 适应株 CVA16-MA-V。CVA16-MA-V 感染 2 周龄的 ICR 小鼠可以引起肢体无力乃至瘫痪的症状,并且在众多组织器官中均可以检测到病毒,其中以肌肉中的病毒载量最高。利用该模型评价临床用抗病毒药物利巴韦林的体内抗 CVA16 药效,结果显示 50 mg/kg 的利巴韦林即可显著减少小鼠肌肉中 CVA16 的病毒滴度和病毒蛋白表达,又提高了感染小鼠的存活率和平均存活时间。我们会在后续的研究工作中进一步开展 HE 染色或免疫组化等方法检测药物的体内药效等研究,不断完善该模型的体内药效评价方法。综上所述,我们建立的 2 周龄 ICR 小鼠的 CVA16 感染模型对现有的 CVA16动物模型是个很好的补充,可以促进我国抗 CVA16 药物的研发及 CVA16 发病机制的研究。
[1] Pourianfar HR, Grollo L. Development of antiviral agents toward enterovirus 71 Infection. J Microbiol Immunol Infect, 2015, 48(1):4-8.
[2] Wang HQ, Meng S, Li ZR, et al. The antiviral effect of 7-hydroxyisoflavone against Enterovirus 71 in vitro. J Asian Nat Prod Res, 2013, 15(4):382-389.
[3] Yi L, Lu J, Kung HF, et al. The virology and developments toward control of human enterovirus 71. Crit Rev Microbiol, 2011, 37(4):313- 327.
[4] Yip CC, Lau SK, Woo PC, et al. Human enterovirus 71 epidemics: what's next? Emerg Health Threats J, 2013, 6(4):19780.
[5] Wang SM, Liu CC. Enterovirus 71: epidemiology, pathogenesis and management. Expert Rev Anti Infect Ther, 2009, 7(6):735-742.
[6] Wu TC, Wang YF, Lee YP, et al. Immunity to avirulent enterovirus 71 and coxsackie A16 virus protects against enterovirus 71infection in mice. J Virol, 2007, 81(19):10310-10315.
[7] Caine EA, Fuchs J, Das SC, et al. Efficacy of a trivalent hand, foot, and mouth disease vaccine against enterovirus 71 and coxsackieviruses A16 and A6 in mice. Viruses, 2005, 7(11):5919- 5932.
[8] Wang H, Li K, Ma L, et al. Berberine inhibits enterovirus 71 replication by downregulating the MEK/ERK signaling pathway and autophagy. Virol J, 2017, 14(1):2.
[9] Chen YC, Yu CK, Wang YF, et al. A murine oral enterovirus 71 infection model with central nervous system involvement. J Gen Virol, 2004, 85(Pt 1):69-77.
[10] Han JF, Cao RY, Deng YQ, et al. Antibody dependent enhancement infection of Enterovirus 71 in vitro and in vivo. Virol J, 2011, 8:106.
[11] Fujiia K, Nagatab N, Satob Y, et al. Transgenic mouse model for the study of enterovirus 71 neuropathogenesis. Proc Natl Acad Sci U S A, 2013, 110(36):14753-14758.
[12] Arita M, Ami Y, Wakita T, et al. Cooperative effect of the attenuation determinants derived from poliovirus sabin 1 strain isessential for attenuation of enterovirus 71 in the NOD/SCID mouse infection model. J Virol, 2008, 82(4):1787-1797.
[13] Wang HQ, Jiang JD, Li YH. Establishment of EV71 animal models with 2-week-old BALB/c mice. Acta Pharm Sinica, 2013, 48(3):343- 346. (in Chinese)王辉强, 蒋建东, 李玉环. 应用2周龄BALB/c小鼠建立EV71动物模型. 药学学报, 2013, 48(3):343-346.
国家自然科学基金(81503118);中国医学科学院医学与健康科技创新工程(CAMS-I2M-1-010);国家“重大新药创制”科技重大专项(2018ZX09711003-005-004)
李玉环,Email:yuhuanlibj@126.com
2018-01-25
10.3969/j.issn.1673-713X.2018.03.013

